دوره 28، شماره 5 - ( مرداد 1399 )
جلد 28 شماره 5 صفحات 2647-2635 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hashemian Z, Afsharian P. Role of Oxidative Stress in Polycystic Ovary Syndrome. JSSU 2020; 28 (5) :2635-2647
URL: http://jssu.ssu.ac.ir/article-1-5100-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5100-fa.html
هاشمیان زهره، افشاریان پروانه. نقش استرس اکسیداتیو در سندرم تخمدان پلیکیستیک. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (5) :2635-2647
متن کامل [PDF 921 kb]
(1498 دریافت)
| چکیده (HTML) (3699 مشاهده)
متن کامل: (29295 مشاهده)
مقدمه
سندرم تخمدان پلیکیستیک
سندرم تخمدان پلیکیستیک Polycystic Ovary Syndrome (PCOS) شایعترین اختلال غدد درونریز میان زنان در سنین باروری است و شایعترین علت ناباروری ناشی از عدم تخمکگذاری است. تظاهرات اصلی این سندرم شامل اختلال تخمکگذاری، هایپرآندروژنیسم و ظاهر مرفولوژیک تخمدانهای پلیکیستیک میباشند. اختلالات قاعدگی که معمولاً درPCOS مشاهده میشود شامل الیگومنوره، آمنوره و خونریزی قاعدگی نامنظم و طولانیمدت است (1).
معیارهای تشخیص سندرم تخمدان پلیکیستیک PCOS
تعریف PCOS بهدلیل ماهیت هتروژن این سندرم، بحثبرانگیز بوده و هنوز هم ناشناخته است. سندرم تخمدان پلیکیستیک یکی از شایعترین اختلالات غدد درونریز (آندوکرینوپاتی) در زنان و شایعترین علت نازایی ناشی از عدم تخمکگذاری میباشد. نامگذاری این سندرم به دلیل وجود تخمدانهای بزرگ محتوی تعداد زیادی کیست کوچک (در اغلب زنان مبتلا و نه در همه) میباشد. این بیماری اولین بار توسط اشتین و لونتال در سال 1935 میلادی تعریف شده است. این دانشمندان 7 بیمار که از عدم قاعدگی، هیرسوتیسم و بزرگی تخمدان همراه فولیکولهای زیاد رنج میبردند را مورد بررسی قراردادند. از آن پس، بهطور مرتب گزارشهایی از این اختلال داده شد تا اینکه در گردهمایی سال 2003 نوتردام، متخصصان PCO از تمام نقاط جهان گرد هم آمدند و یک معیار تشخیصی جهانی برای این بیماری در نظر گرفتند. معیار تشخیص این بیماری بر اساس حضور دو مورد از سه مورد ذیل میباشد:
1-هایپرآندروژنیسم بیوشیمیایی با تظاهرات کلینیکی، از جمله آلوپسیا (از دست دادن موضعی مو در پوست سر)، آکنه و هیرسوتیسم (پرمویی) بروز میکند.
2-وجود قاعدگی نامنظم الیگومنوره و آمنوره یا عدم تخمکگذاری.
3- وجود تخمدانهای پلیکیستیک در سونوگرافی بیش از 12 فولیکول در سایز کوچک 2 تا 9 میلیمتر میباشد. تشخیص سونوگرافی PCOS در بین سونوگرافیست ها متفاوت است. مقبولترین تعریف سونوگرافی PCOS توسطAdams و همکارانش ابراز شد که شامل وجود کیستهای متعدد 10 عدد یا بیشتر با قطر 8–2 میلیمتر است که در محیط تخمدان قرار گرفتهاند. از طرف دیگر وجود فولیکول های متعدد و افزایش استرومای تخمدان باعث بزرگ و حجیم شدن تخمدان میشود هر چند که با وجود علائم PCOS در بعضی از بیماران ممکن است که اندازه تخمدانها در محدوده نرمال باقی بماند. حدود 33-20 درصد زنان دارای این سندرم در سونوگرافی علایم ذکر شده را نشان میدهند، که حدود سه چهارم آن ها ویژگی های کلینیکی سندرم را دارا هستند (3, 2). این سندرم بیماری خاص دوره باروری و نوجوانی نیست، بلکه میتواند با اثرات متفاوت در زندگی فرد همراه باشد. عوارض اصلی این بیماری در نوجوانی شیوع آمنوره، الیگومنوره، هیرسوتیسم، چاقی و آکنه است. در سنین باروری، شکایت اصلی بیمار ناباروری و تخمکگذاری نامنظم است. عوارض سن نوجوانی هنوز در این دوره وجود دارد. در سنین قبل از یائسگی و بعد از یائسگی، این سندرم میتواند خطر ابتلا به دیابت نوع 2، فشار خون بالا، دیسلیپیدمی، بیماری قلبی عروقی و حتی سرطان اندومتر و احتمال سرطان پستان را افزایش دهد (4). همچنین هایپرآندروژنیسم یک عامل تثبیت شده در اتیولوژی این سندرم است، که تقریباً در 80-60 % موارد نمایان شده است. مقاومت به انسولین نیز یکی از عوامل پاتوفیزیولوژیک در 80-50% بیماران PCOS است (5).
ویژگیهای بیوشیمیایی PCOS
از آنجا که هورمون ضد مولرین (AMH) برخی جنبههای عملکرد تخمدان را منعکس میکند و اغلب PCOS توسط افزایش فولیکولهای آنترال در تخمدانها مشخص شده است، به این ترتیب AMH ممکن است در تشخیص PCOS مفید باشد. بهنظر میرسد در زنان، افزایش غلظتهای سرمی AMH با سه پارامتر PCOS، Oligo anovulation، هایپرآندروژنیسم و مورفولوژی تخمدان پلیکیستیک به خوبی در ارتباط است، اما هنوز بهطور عمومی شامل پانل بیوشیمیایی تشخیصی آن نمیشود. زنان مبتلا به PCOS سطوح بالاتری از تستوسترون آزاد در حال گردش CFT (Circulating free testosterone)، گلوکز پس از غذا، انسولین در حالت ناشتایی و تریگلیسرید و نیز سطوح پایینتری از گلوبولین متصل شونده به هورمون جنسی SHBG (Sex hormone binding globulin) را نشان میدهند، علاوه بر این در این بیماران افزایش نسبت LH (Luteinizing hormone) به FSH (Follicle-stimulating hormone) دیده میشود (6).
تظاهرات بالینی PCOS ناشی از اختالالات اندوکرینی
زنان مبتلا به این سندرم اغلب به اختلالات سیکل قاعدگی، تظاهرات بالینی هایپرآندروژنیسم و ناباروری دچار هستند. اختلالات قاعدگی که معمولاً در این سندرم مشاهده میشود شامل الیگومنوره، آمنوره و خونریزی قاعدگی نامنظم و طولانیمدت است (3). شرایط بسیاری میتوانند باعث هایپرآندروژنیسم در زنان شوند، اما شایعترین علت در سراسر جهان PCOS است (7). زنان مبتلا به PCOS، اغلب بهدلیل افزایش بیش از حد آندروژن محیطی دچار هیرسوتیسم، آکنه ولگاریس و آلوپسی آندروژنیک میشوند. یکی دیگر از اختلالات پوستی در PCOS ،آکانتوریس نیگریکنس است که یک نشانه شایع هایپر انسولینمی است (8). بنابر گزارش اخیر انجمنPCOS-Excess Androgen ، بررسی انجام شده بر روی 18 مطالعه صورت گرفته از سال 1983 تا 2007 که در برگیرنده 6281 بیمار PCOS بود، حاکی از آن است که 74/7% از زنان هیرسوتیسم داشتند (9). مقاومت به انسولین ممکن است منجر به فرونشانیSHBG ، افزایش سطح تستوسترون آزاد فعال از لحاظ بیولوژیکی و در نتیجه منجر به هیرسوتیسم شود (10). ظهور آکنه نیز میتواند یکی از نشانگرهای هایپرآندروژنیسم باشد. تقریباً در 30-15% زنان بالغ مبتلا بهپلیکیستیک، آکنه دیده میشود (3). آلوپسی آندروژنیک یکی از مواردی میباشد که کمتر مورد مطالعه قرار گرفته و شیوع پایینی از آن در PCOS گزارش شده است (11). تاثیر هایپراندروژنمی بر سطوح میزان مواد و واکنشهای اکسیدان و آنتیاکسیدانی در زنان مبتلا به PCOS هنوز ناشناخته است. با اینحال، در یک مطالعه انسانی نشان داده شده است که تولید ROS (Reactive oxygen species) ارتباط مستقیمی با تستوسترون و آندروستن¬دیون دارد که در نتیجه ممکن است به هایپرآندروژنیسم در زنان مبتلا به PCOS شود. ارتباط بین تستوسترون پلاسما یا آندرواستندیون (Androstenedione) و تولید ROS، نشان میدهد که ROS ممکن است بهطور مستقیم باعث تحریک هایپرآندروژنیسم میشود. مطالعات آزمایشگاهی نشان داده است که ROS، آنزیمهای استروئیدزای تخمدان تولیدکننده آندروژن را تحریک میکند، در حالی که آنتیاکسیدانهایی مانند استاتینها این آنزیم¬ها را سرکوب میکنند (12،13).
پیامدهای PCOS
1 -مقاومت به انسولین و دیابت
مکانیسمهای دخیل در مقاومت به انسولین با حضور عوامل ژنتیکی و محیطی، بهاحتمال زیاد پیچیده است (9). در زنان لاغر مبتلا به PCOS گزارش شده است که یک شکل ذاتی از مقاومت بهانسولین دارند که شامل نقصهای پس از اتصال در سیگنالینگ رسپتور انسولین است. در حالی که زنان چاق مبتلا به PCOS نه تنها از مقاومت به انسولین ذاتی PCOS رنج میبرند بلکه مقاومت به انسولین همراه با چاقی بیش از حد، فشار خون بالا و سایر عوامل متابولیک نیز به آن اضافه میشود (14). مقاومت به انسولین در بیماران PCOS ارتباط نزدیکی با چاقی شکمی و هایپرآندروژنیسم دارد (15). ارتباط بین هایپرآندروژنیسم و مقاومت به انسولین در بسیاری از مطالعات بهصورت معنیدار است اما نه به اندازه ارتباطی که بین ناهنجاریهای انسولین و چاقی است (16). به نظر می¬رسد خطر کلی ابتلا به دیابت نوع 2 و اختلال تحمل گلوکز(IGT) در بیماران PCOS 3 تا 7 برابر درمقایسه با جمعیت زنان سالم، بیشتر باشد (15).
2 -بیماری قلبی عروقی
مطالعات انجام شده در مورد زنان مبتلا به PCOS و زنان غیربیمار که از نظر BMI (Body mass index) مطابقت داشتند، به چندین عامل خطر بیماری قلبی عروقی مرتبط با PCOS اشاره دارند. دیسلیپیدمی در 70% بیماران PCOS ایالات متحده رخ میدهد. شایعترین ویژگیهای دیسلیپیدمی آتروژنیک در PCOS شامل هایپرتریگلیسریدمی، افزایش سطح کلسترول LDL و کاهش سطح کلسترول HDL میباشد (17). علاوه بر این، سایر عوامل خطر بیماری قلبی عروقی مانند فشار خون بالا، اختلال عملکرد اندوتلیال و التهاب نیز وجود دارد. زنان چاق مبتلا بهPCOS فشار سیستولیک بالاتری نسبت به گروه کنترل هموزن خود دارند و نیز زنان مبتلا به الیگومنوره و هیرسوتیسم فشار سیستولیک و دیاستولیک افزایش یافته دارند (18).
3- سرطان
نگرانیها در رابطه با این که زنان مبتلا به PCOS ممکن است در معرض خطر ابتلا به سرطان قرار گیرند، به دهه 1940 بازمیگردد. در یک مقاله منتشر شده در سال 2003، هاردیمن و همکارانش نتیجه گرفتند که شواهد برای افزایش خطر ابتلا به کارسینوم اندومتر در PCOS ناقص و متناقض بود (19). بهطورکلی پذیرفته شده است که زنان مبتلا به PCOSبا آمنوره، درمعرض خطر ابتلا به هایپرپالازی اندومتر و سرطان هستند. بحث و نگرانیهای زیادی در مورد خطر ابتلا به سرطان تخمدان در زنان با عدم تخمکگذاری وجود دارد، بهخصوص بهدلیل استفاده از داروهایی که برای القاء تخمکگذاری در این بیماران استفاده می شود. افزایش مداوم غلظتهای سرمی استروژن میتواند بهطور بالقوه رشد تومورهای حساس دیگر مانند کارسینوم پستان و تخمدان را نیز تقویت کند (20،21).
درمانهای رایج PCOS
درمان سندرم تخمدان پلیکیستیک رژیم غذایی کم کالری و ورزش می باشد، در کنار آنها میتوان از درمان های دارویی نیز بهره برد. هدف از درمان های دارویی برقرار کردن مجدد تخمکگذاری که منجر به بارداری میشود است، در حال حاضر 3 روش درمان بهطور متداول وجود دارند که عبارتند از: کلومیفن سیترات، مهار کنندههای آروماتاز و گنادوتروپینها، حساس کنندهها بهانسولین. بهطور معمول مراحل درمانی در این روش به این صورت می باشد که بیمار ابتدا تحت درمان با داروی کلومیفن سیترات (CC) Clomiphene Citrate قرار میگیرد، اگر تخمکگذاری رخ نداد و یا این دارو اندومتر رحم اثر نامطلوب گذاشت میتوان از مهار کنندههای آروماتاز مثل لتروزول استفاده کرد. در نهایت در روش درمانی سوم از داروهای کلومیفن سیترات همراه با گنادوتروپینها و یا لتروزول با گنادوتروپینها استفاده میشود. گاهاً همراه با این داروها حساس کننده¬های انسولین مثل متفورین برای افزایش حساسیت به انسولین و کمک به تخمکگذاری نیز تجویز میشود (3،4).
مقدمهای بر عوامل استرس اکسیداتیو
استرس اکسیداتیو وضعیت عدم تعادل بین تولید گونههای اکسیژن فعال ROSو میزان آنتیاکسیدان است. در شرایطی که این تعادل برهم بخورد، نتیجه آن افزایش سطح استرس اکسیداتیو است. سلولها و بافتهای تولید مثل فقط در شرایطی که تعادل در وضعیت آنتیاکسیدان و اکسیدان وجود داشته باشد، پایدار خواهند بود (22). رادیکالهای ناپایدار، بسیار واکنشپذیر و آزاد هستند و با گرفتن الکترون از اسیدهای نوکلئیک، پروتئین ها، لیپیدها و کربوهیدرات ها به ثبات می رسند و در نهایت به سلول¬ها آسیب می زنند (23). دو شکل عمده رادیکال آزاد ROS و RNS (Reactive nitrogen species) است. الکترون های آزاد به طور معمول در مسیرهای اکسیداسیون- احیا بهعنوان محصول فرعی تولید می شوند (22). بیشترین گونههــای واکنشگر اکســیژن (ROS) در میتوکندری بهطور عمده در فسفریلاسیون اکسیداتیو کمپلکس I NADH) دهیدروژناز) NADH dehydrogenase و کمپلکس III(کوآنزیم Q و سیتوکروم C اکسیدوردوکتاز) زنجیره انتقال الکترون تولید میشود و به فضای بین دو غشای میتوکندری منتقل می شود. از میان اکسیژن¬های فعال تولید شده 98% در واکنش های لیپولیز و تولید انرژی مصرف می¬شود و تنها دو درصد آن به سه شکل عمده رادیکال آزاد تبدیل میشود که شامل آنیون سوپراکسید (O2-)، پراکسید هیدروژن (H2O2) و هیدروکسیل (HO) اشاره کرد (24). بهعبارتی میتوان گفت ROS مولکولهای کوچک، ناپایدار و بسیار واکنشپذیری هستند که میتوانند پروتئین ها، لیپیدها و DNA را اکسید کنند. تجمع ROS منجر به استرس اکسیداتیو، اکسید شدن اجزای تشکیل دهنده سلولی شامل پروتئینها، DNA و لیپیدها میشود (27-25). مطالعات بسیاری نشان دادهاند که ROS با بیماریهایی مثل سرطان، بیماریهای قلبی-عروقی، نفروپاتی دیابتی و حتی با فرآیندهایی نظیر پیری و ناباروری نیز ارتباط دارد (28،29). اما از آغاز دهه 1990 بود که محققان دریافتند سلولها برای کنترل فعالیتهای فیزیولوژیک خود مقادیر کم و کنترل شده ROS را تولید میکنند و حتی نشان داده شده است که ROS ها بهعنوان پیک ثانویه نقش مثبتی در تنظیم فعالیت سلولها دارند و در واقع غلظتهای فیزیولوژیک آنها برای عملکرد طبیعی سلول لازم و ضروری است. مطالعات نشان دادهاند که در بیشتر سلولها، مقادیر فیزیولوژیک ROS توسط آنزیمهای خانواده NADPH اکسیداز(NOX) تولید میشود (31, 30). این آنزیمها در غشاء پلاسمایی سلولها حضور دارند و با اتصال کلسیم به آنها، تولیدROS را افزایش میدهند (33, 32).
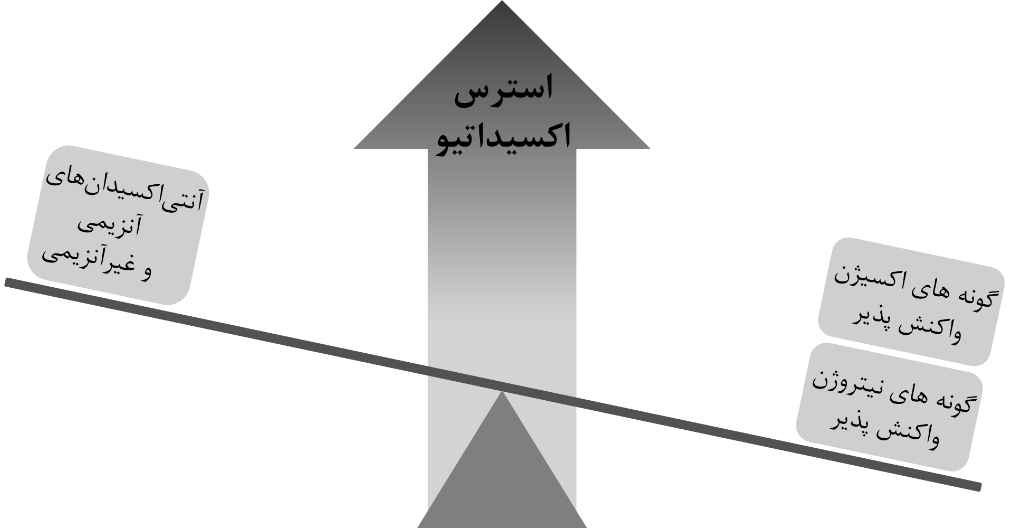
شکل 1: عوامل استرس اکسیداتیو وقتی ایجاد میشود که تعادل بین واکنشهای تولید رادیکال آزاد و واکنشهای آنتیاکسیدان به سمت تولید رادیکالها باشد، این امرنتیجه منفی در فرآیندهای تولیدمثل دارد (34).
گونههای واکنش پذیر اکسیژن(Reactive Oxygen Species)
مولکول اکسیژن، یک گیرنده مناسب برای الکترون است و زنجیره های انتقال الکترون در میتوکندری، که متشکل از سیستم پیچیده ای از پروتئینها و آنزیمهای (سیتوکرومها) موجود در غشاء داخلی میتوکندری است، در نهایت سبب انتقال 4 الکترون به یک مولکول اکسیژن میشوند. نتیجه این فعالیت میتوکندری، دوگانه و متضاد است. از یک طرف، میتوکندری منبع مهم انرژی را برای سلول فراهم میکند و احیاء اکسیژن سبب تولید 36 مولکول ATP میگردد و از طرف دیگر حدود 4 تا 0/4 درصد از اکسیژن بهطور کامل احیاء نشده و تنها با یک الکترون احیاء میشود و در نتیجه آنیون سوپراکسید تولید می شود. آنیون سوپراکسید یک رادیکال آزاد است. این مسئله باعث می شود که رادیکالهای آزاد از اتم یا مولکول اولیهای که از آن ایجاد شده اند، فعالتر باشند. گرچه آنیون سوپراکسید نیمه عمر کوتاهی دارد، اما یک عامل اکسیدکننده بسیار قوی است و می تواند تمام مولکولها را در سلول اکسید کند. آنیون سوپراکسید میتواند به صورت آنزیمی یا خودبه خود به H2O 2 تبدیل شود و در نهایت سبب تولید رادیکال های آزاد هیدروکسیل می شود. این رادیکال های آزاد، گونه های واکنشپذیر اکسیژن (ROS) نامیده می شوند. از جمله دیگر ROSها میتوان از اکسیدنیتریک (NO) آنیون هیپوکلرات (HClO3-) و آنیون پروکسی نیتریت ((ONOO و لیپید پراکسیدازها نام برد (35, 23). گونه های واکنش پذیر اکسیژن غیر از زنجیره انتقال اکسیژن در میتوکندری، توسط سیستم ها و واکنش های دیگری نیز تولید می شود، مثل سیستمهای انتقال الکترون میکروزومال، گزانتیناکسیداز و پراکسیدازها. NADPH اکسیداز نوتروفیل ها یکی از شناخته شده ترین اکسیدازها است که نقش مهمی در دفاع در برابر پاتوژن ها دارد. اکنون مشخص شده که اکثر سلولها حاوی NADPH اکسیداز )خانواده NOX) در غشای پلاسمایی خود می باشند و سطوح پایین و کنترل شده ROS را در زمان انجام فرآیندهای فیزیولوژیک تولید می کنند. پس مقادیر اندک ROS بهطور فیزیولوژیک تولید میشود و قابل ذکر است ROSها در غلظت های اندک بهعنوان پیامآور ثانویه عمل میکنند و سبب تنظیم آپوپتوز، فعال کردن فاکتورهای نسخهبرداری و تنظیم بیان ژنهای مربوط به آنزیمهای آنتیاکسیدان می شود (36).
آنتیاکسیدانها
در حالت فیزیولوژیک باید مقادیر ROS در سطوح پایین باقی بماند و به طور طبیعی آنتیاکسیدانهایی وجود دارند که رادیکالهای آزاد را از بین میبرند (37). سیستمهای دفاعی آنتیاکسیدانی شامل موارد زیر است:
-آنزیمهایی نظیر سوپراکسید دسموتاز، کاتالاز و پراکسیداز که واکنشهای زیر را به ترتیب تسریع میکنند:
2O20 + 2H+ H2O2 + O2
2HO2 2H2O2 + O2
H2O2 + NADH 2H2O2 + 2NAD
پروتئین انتقال دهنده ی آهن و مس نظیر ترانسفرین، فریتین و سرولوپلاسمین.
مولکولهای آنتیاکسیدان کوچک مثل گلوتاتیون، اسید اوریک، بیلیروبین، گلوکز و ویتامینهای E و A, C یوبی کوئینون، کاروتنوئیدها و فلاونوئیدها.
عناصری مانند مس، روی و سلنیوم که در فعالیت آنزیم های آنتیاکسیدانی نقش دارند. مثلاً آنزیم سوپراکسید دسموتاز برای عملکرد درست خود به مس و روی نیاز دارد (38). علیرغم وجود این سیستمهای آنتیاکسیدانی، در بعضی از شرایط تولید ROS افزایش می یابد. از جمله این شرایط میتوان بهمواجهه طولانی مدت با نور خورشید، مواجهه با انواع تشعشعات، تماس با مواد سرطانزا مثل آزبست، سیگار کشیدن، مصرف طولانیمدت بعضی از داروها از جمله قرص های جلوگیری از بارداری، ورزش شدید، مصرف الکل، آلودگی هوا و عوامل عفونی اشاره کرد. در تمام این شرایط تعادل بین اکسیدان ها و آنتیاکسیدان ها از بین رفته و مقدار اکسیدانها بیشتر از آنتیاکسیدانها میشود و این حالتی است که «استرس اکسیداتیو» نامیده میشود. در این وضعیت است که اثرات مضر اکسیدانها ظاهر میشود (39).
نقش ROS در پلیکیستیک
تظاهرات ناشی از بیماری میتواند در نتیجه فاکتورهای متعدد محیطی و ژنتیکی ایجادگردد (35). از جمله فاکتورهای محیطی میتوان بهگونههای واکنشگر اکسیژن ROS اشاره داشت (34). این گونه ها شامل سوپراکسید آنیون (O2) پراکسید هیدروژن (H2O2) و رادیکال هیدورکسیل (OH) بوده و و نقشهای فیزیولوژیکی در بسیاری از فرآیندهای مختلف دستگاه تولیدمثلی زنان از جمله بلوغ اووسیت، تخمکگذاری، لقاح و ریزش های آندومتری دارند. تخمدان از نظر متابولیکی یک عضو فعال است و بهطور مداوم تحت تاثیر انواع استرسها می باشد (40). برای مثال در شرایط پاتولوژیکی مانند تخمدان پلی کیستیک، استرس اکسیداتیو بیش از حد، ممکن است به هایپرپلازی مزانشیم تخمدان کمک کند (41). مولکول های ROS باعث آسیب به DNA اپیتلیوم تخمدانی یا آپوپتوز سلولی می شود. با این حال وضعیت اکسیداتیوی سلول، رشد فولیکولی، تشکیل جسم زرد، تمایز آندومتری و رشد جنینی را تعدیل میکند (42). Gong و همکارانش در سال 2015 بهمطالعه استرس اکسیداتیو در تخمدانهای موش صحرایی مدلPCO پرداختند (43). آنها بیان کردند که در منحنی های رشد، وزن تخمدان و وزن رحم بین گروههای مورد مطالعه، تفاوت معنیداری وجود داشت. Murri و همکاران در سال 2013، مارکرهای در گردش استرس اکسیداتیو و PCOS را در انسان بررسی کردند. آنها بیان کردند در زنان مبتلا به این بیماری مستقل از افزایش وزن، مارکرهای در گردش استرس اکسیداتیو غیرنرمال هستند و براساس این یافتهها پیشنهاد کردند که استرس اکسیداتیو ممکن است در پاتوفیزیولوژی این اختلال شایع شرکت کند (44). مولکول های ROS با مرکزیت اکسیژن و رادیکالهای آزاد هستند. آنها با داشتن یک الکترون تک در لایه خارجی فرم ناپایدار دارند و تمایل فراوانی برای ترکیب با مولکولها یا رادیکالهای دیگر دارند تا به شکل پایداری برسند (47-45).
نقش مالون دی آلدهید در پلیکیستیک
پراکسیداسیون اسیدهای چرب اشباع نشده، یک نوع واکنش زنجیره رادیکالی است که توسط کاهش یک اتم هیدروژن از یک گروه متیلن از زنجیره اسیدهای چرب آغاز میشود. رادیکالهای کربن تشکیل شده توسط این واکنش تمایل دارند که توسط بازآرایی مجدد مولکولی تثبیت شوند و منجر به تشکیل پیوندهای دوگانه میشوند. محصولات واکنش پراکسیداسیون لیپید بهطور گسترده بهعنوان شناساگرهای عوامل اکسیداسیون استرس استفاده میشوند. بهعنوان مثال، مالون دی آلدهید (MDA) Malondialdehyde در طول تجزیه اسیدهای چرب اشباع نشده تولید میشود و جزو محصولات نهایی پایدار پراکسیداسیون لیپیدی است و میتواند بهعنوان یک شناساگر مفید استفاده شود (48).
Kuçu و همکاران (2009) بر روی 31 بیمار پلی کیستیک (با میانگین سنی 23/8 سال) تحقیق کردهاند و نتایج نشان میدهد میزان MDA در خون بیماران در مقایسه با گروه کنترل که شامل افراد سالم است بالاتر بود. سپس این گروه بیماران در دو گروه مقاوم و غیرمقاوم به انسولین تقسیم شدند و بیان داشتند که میزان MDA در سطح قابل¬توجهی در بیماران پلیکیستیک جوان و بدون اضافه وزن و حتی غیرمقاوم به انسولین، بالاتر است (49).
نقش کربونیل پروتئین در پلی کیستیک
مقدار کربونیل پروتئین (PC) Protein carbonyl با یک روش ساده کلومتریک بعد از واکنش سرم با دینیتروفنیل هیدرازین سنجیده میشود. در سال 2007 Fenkci و همکاران نشان دادند میزان PC در بیماران پلی کیستیک با BMI نرمال نسبت به گروه کنترل به طور معنیداری بالاتر بود. نتایج آزمایش نشان داد که رادیکالهای آزاد به پروتئینها در بیماران PCOS آسیب میرسانند. علاوه بر این نشان داده شد که کربونیلهای پروتئین یک همبستگی مثبتی با انسولین ناشتا دارند، که حاکی از ارتباط قوی بین مقاومت انسولین و اکسیداسیون پروتئین در در بیماری پلی کیستیک است (50).
نقش نیتریک اکسید در پلیکیستیک
نیتریک اکسید (RNS)، رادیکال آزادی با مرکزیت نیتروژن هستند و دو مثال عمده آن نیتریک اکسید (NO) و نیتروژن دیاکسید (NO2) هستند. هنگام تبدیل ال-آرژنین به ال- سیترولین محصول NOتولید میشود (30). نیتریک اکسید در اندازه معمول و طبیعی در بهبود عملکرد سلولها کمک میکند اما مقدار اضافی آن سمی است (45). نیتریک اکسید با یک الکترون آزاد بسیار واکنشپذیر است و میتواند به پروتئینها، نوکلئوتیدها و لیپیدها صدمه بزند. RNS در بیماریهایی نظیر آسم، ایسکمی، شوک سپتیک و آترواسکلروز با دوز بالاتری همراه است (51). اندازه گیری غلظت NO با میزان غلظت NO3- و NO2- محاسبه میشود. محتوای NO توسط یک فرآیند دو مرحله ای متشکل از تبدیل نیترات به نیتریت و پس از آن با روش اسپکتروفتومتری در طول موج 540 نانومتر نیتریت کل ارزیابی میشود. Nacul و همکاران در سال 2007، نشان دادند که میزان NO در بیماران پلی کیستیک مشابه با گروه کنترل بود. با این وجود یک همبستگی معنی داری بین میزان انسولین ناشتا و نیتریک اکسید وجود دارد. این دادهها حاکی از آن است حضور NOبه وجود مقاومت به انسولین در بیماران پلی کیستیک وابسته است، اگر چه مطالعات بیشتری برای روشن شدن نقش NO در این بیماری مورد نیاز است (52).
نقش آنتی اکسیدان ها در پلی کیستیک
آنتی اکسیدان ها میزان اضافیROS را کاهش میدهند تا آسیب های قابلتوجهی که توسط این عوامل ایجاد می شوند را خنثی کند. به عبارتی آنتی اکسیدان ها به ایجاد تعادل بین تولید اکسیدانت های سودمند (اغلب بهعنوان مولکول های سیگنال دهنده سلولی عمل می کنند) و آسیبرسان کمک می کنند. دو دسته از آنتی اکسیدان ها وجود دارد: آنزیمی و غیرآنزیمی. آنتی اکسیدان های آنزیمی شامل آنزیم سوپراکسید دسموتاز (SOD)، گلوتاتیون پراکسیداز (GPx) و کاتالاز میباشد. اکسیدانت های غیرآنزیمی شامل گلوتاتیون (GSH) و آلفا-توکوفرول (ویتامینE)، بتا-کاروتن، آسکوربات (ویتامین C)، تائورین، ال-کارنیتین، کوآنزیم Q10 است. سه ایزوفرم از آنتی اکسیدان های آنزیمی در یوکاریوت ها وجود دارد که شامل منگنز-SOD (Mn-SOD)، مس/روی –SOD (Cu/Zn-SOD) و SOD خارج سلولی (EC-SOD) است (23). تحقیقات نشان می دهند، آنتی اکسیدان هایی که تاثیر منفی رادیکالهای آزاد اکسیژن را کاهش می دهند در باروری زنان نقش بسزایی دارند. مطالعات مختلفی در این مورد انجام شده است برای مثال بررسی تغییرات غلظت آنتی اکسیدان در سرم و مایع صفاقی در ناباروری ایدیوپاتیک، ناباروری لوله و بیماران آندومتریوز بررسی شده است. نتایج نشان میدهد غلظت فاکتورهای آنتیاکسیدانی در بیماریهای پلیکیستیکی نویددهنده است (54, 53).
نقش ظرفیت آنتی اکسیدان تام بر روی پلی کیستیک
ظرفیت آنتیاکسیدانی تام (Total antioxidant capacity) بهمعنای توانایی سرم در خنثی کردن رادیکال آزاد و محافظت از ساختار سلول از آسیبهای مولکولی است. روشهای مختلف تشخیصی برای TAC شرح داده شده است، یکی از آنها روش اسپکتروفتومتری است که طی آن کاتیون رادیکالی 2 و 2-آزینوبیس (3-اتیل بنزتیازولین-6–سولفونات) (ABTS) اندازهگیری میشود (55). روش دیگر برای اندازه گیری TAC از طریق تولید رادیکالهای هیدروکسیل است که از طریق واکنشهای فنتون تولید میشود. اگرچه نتایج مطالعات در مورد سطوح آنتیاکسیدانها بحث برانگیز است با این وجود میتوان نتیجهگیری کرد که یک عدم تعادل بین عوامل اکسیداتیو و آنتیاکسیدانها در بیماران پلیکیستیک رخ میدهد (56).
نقش سوپراکسید دسموتاز در پلی کیستیک
آنیون سوپر اکسید که بسیار سمی است در نتیجه احیاء ناکامل اکسیژن با اضافه شدن یک الکترون به اکسیژن مولکولی تولید میشود این محصول سمی توسط آنزیم سوپراکسید دسموتاز (SOD) سریعاً به پراکسید هیدروژن و هیدروژن تبدیل میشود. در سال 2009 Kuçu و همکاران نشان دادند میزان SOD در بیماران پلیکیستیک نسبت به گروه کنترل بهصورت معناداری بالاتر بود. بیماران انتخاب شده در این مطالعه بسیار جوان بودند که توانایی بیشتر برای مقابله با عوامل اکسیداسیون داشتند (57). البته در سال 2001 مطالعه ای نشان داد که بالا بودن میزان SOD در بیماران برای جبران خسارات ناشی از عوامل اکسیداتیو است (58).
مکمل های درمانی موثر بر استرس اکسیداتیو در PCOS
مکمل اسیدهای چرب امگا 3 به منظور کاهش سطح سرمی کلسترول تام، تریگلیسیرید، لیپو پروتئین با چگالی پایین و مالون دی آلدئید در نظر گرفته می شود و دارای اثر ضد التهابی و آنتی اکسیدانی است. اسید آلفا لیپوئیک یک آنتیاکسیدان قوی است که باعث بهبود حساسیت به انسولین و کنترل قند خون در بیماران مبتلا به دیابت نوع 2 می شود. همچنین این مکمل آنتیاکسیدان تاثیر مثبتی در زنان PCOS به همراه داشته است. N- استیل سیستئین یک آنتی اکسیدان حاوی تیول است که سطح گلوتاتیون داخل سلولی را بالا می برد و حساسیت بهانسولین را در زنان مبتلا به PCOS افزایش میدهد. این یافته ها، ما را به سمت ارزیابی آنتیاکسیدانهای دیگر هدایت میکند که میتوانند حساسیت به انسولین را بهبود بخشند، میزان تخمکگذاری را افزایش دهند و خطر ابتلا بهدیابت نوع 2 و بیماریهای قلبی و عروقی را در زنان مبتلا بهPCOS کاهش دهند (59,60).
نتیجهگیری
سندرم تخمدان پلیکیستیک یک اختلال رایج، ناهمگن و وراثتی است که زنان را در طول عمرشان تحتتاثیر قرار میدهد. تشخیص زودهنگام و مدیریت صحیح میتواند به کنترل این سندرم کمک کند و از پیامدهای بلندمدت آن جلوگیری کند. به این ترتیب پزشک در کنار درمان تظاهرات بالینی بیماران و به حداقل رساندن اثرات این عارضه بر روی باروری، جهت پیشگیری از عوارض دیر هنگام این اختلال مانند دیابت نوع 2، بیماری قلبی عروقی و سرطان اندومتر نیز اقدام کند. در این مقاله، بیماری پلی کیستیک و عوامل استرساکسیداتیو مورد بحث قرار گرفت. انواع متفاوتی از عوامل اکسیداسیون و آنتیاکسیدان ها شرح داده شد و با توجه بهمطالعات پیشین، نتیجه مشخصی برای ارتباط عوامل استرس اکسیداسیون و بیماری پلی کیستیک بیان نشده است و باید تحقیقات بیشتری بر روی مکانیسم اثر این عوامل بر روی بیماری ذکر شده انجام شود. علاوه بر این تحقیقاتی دیگر برای کاهش میزان چربی احشایی در بیمار PCOS در حال انجام است که با بررسی تاثیر این موضوع بر روی کاهش نشانگرهای خطر قلبی عروقی، بهبود مقاومت به انسولین و بهبود علائم بالینی بیماران پلی کیستیک همراه است.
تعارض در منافع: وجود ندارد.
سندرم تخمدان پلیکیستیک
سندرم تخمدان پلیکیستیک Polycystic Ovary Syndrome (PCOS) شایعترین اختلال غدد درونریز میان زنان در سنین باروری است و شایعترین علت ناباروری ناشی از عدم تخمکگذاری است. تظاهرات اصلی این سندرم شامل اختلال تخمکگذاری، هایپرآندروژنیسم و ظاهر مرفولوژیک تخمدانهای پلیکیستیک میباشند. اختلالات قاعدگی که معمولاً درPCOS مشاهده میشود شامل الیگومنوره، آمنوره و خونریزی قاعدگی نامنظم و طولانیمدت است (1).
معیارهای تشخیص سندرم تخمدان پلیکیستیک PCOS
تعریف PCOS بهدلیل ماهیت هتروژن این سندرم، بحثبرانگیز بوده و هنوز هم ناشناخته است. سندرم تخمدان پلیکیستیک یکی از شایعترین اختلالات غدد درونریز (آندوکرینوپاتی) در زنان و شایعترین علت نازایی ناشی از عدم تخمکگذاری میباشد. نامگذاری این سندرم به دلیل وجود تخمدانهای بزرگ محتوی تعداد زیادی کیست کوچک (در اغلب زنان مبتلا و نه در همه) میباشد. این بیماری اولین بار توسط اشتین و لونتال در سال 1935 میلادی تعریف شده است. این دانشمندان 7 بیمار که از عدم قاعدگی، هیرسوتیسم و بزرگی تخمدان همراه فولیکولهای زیاد رنج میبردند را مورد بررسی قراردادند. از آن پس، بهطور مرتب گزارشهایی از این اختلال داده شد تا اینکه در گردهمایی سال 2003 نوتردام، متخصصان PCO از تمام نقاط جهان گرد هم آمدند و یک معیار تشخیصی جهانی برای این بیماری در نظر گرفتند. معیار تشخیص این بیماری بر اساس حضور دو مورد از سه مورد ذیل میباشد:
1-هایپرآندروژنیسم بیوشیمیایی با تظاهرات کلینیکی، از جمله آلوپسیا (از دست دادن موضعی مو در پوست سر)، آکنه و هیرسوتیسم (پرمویی) بروز میکند.
2-وجود قاعدگی نامنظم الیگومنوره و آمنوره یا عدم تخمکگذاری.
3- وجود تخمدانهای پلیکیستیک در سونوگرافی بیش از 12 فولیکول در سایز کوچک 2 تا 9 میلیمتر میباشد. تشخیص سونوگرافی PCOS در بین سونوگرافیست ها متفاوت است. مقبولترین تعریف سونوگرافی PCOS توسطAdams و همکارانش ابراز شد که شامل وجود کیستهای متعدد 10 عدد یا بیشتر با قطر 8–2 میلیمتر است که در محیط تخمدان قرار گرفتهاند. از طرف دیگر وجود فولیکول های متعدد و افزایش استرومای تخمدان باعث بزرگ و حجیم شدن تخمدان میشود هر چند که با وجود علائم PCOS در بعضی از بیماران ممکن است که اندازه تخمدانها در محدوده نرمال باقی بماند. حدود 33-20 درصد زنان دارای این سندرم در سونوگرافی علایم ذکر شده را نشان میدهند، که حدود سه چهارم آن ها ویژگی های کلینیکی سندرم را دارا هستند (3, 2). این سندرم بیماری خاص دوره باروری و نوجوانی نیست، بلکه میتواند با اثرات متفاوت در زندگی فرد همراه باشد. عوارض اصلی این بیماری در نوجوانی شیوع آمنوره، الیگومنوره، هیرسوتیسم، چاقی و آکنه است. در سنین باروری، شکایت اصلی بیمار ناباروری و تخمکگذاری نامنظم است. عوارض سن نوجوانی هنوز در این دوره وجود دارد. در سنین قبل از یائسگی و بعد از یائسگی، این سندرم میتواند خطر ابتلا به دیابت نوع 2، فشار خون بالا، دیسلیپیدمی، بیماری قلبی عروقی و حتی سرطان اندومتر و احتمال سرطان پستان را افزایش دهد (4). همچنین هایپرآندروژنیسم یک عامل تثبیت شده در اتیولوژی این سندرم است، که تقریباً در 80-60 % موارد نمایان شده است. مقاومت به انسولین نیز یکی از عوامل پاتوفیزیولوژیک در 80-50% بیماران PCOS است (5).
ویژگیهای بیوشیمیایی PCOS
از آنجا که هورمون ضد مولرین (AMH) برخی جنبههای عملکرد تخمدان را منعکس میکند و اغلب PCOS توسط افزایش فولیکولهای آنترال در تخمدانها مشخص شده است، به این ترتیب AMH ممکن است در تشخیص PCOS مفید باشد. بهنظر میرسد در زنان، افزایش غلظتهای سرمی AMH با سه پارامتر PCOS، Oligo anovulation، هایپرآندروژنیسم و مورفولوژی تخمدان پلیکیستیک به خوبی در ارتباط است، اما هنوز بهطور عمومی شامل پانل بیوشیمیایی تشخیصی آن نمیشود. زنان مبتلا به PCOS سطوح بالاتری از تستوسترون آزاد در حال گردش CFT (Circulating free testosterone)، گلوکز پس از غذا، انسولین در حالت ناشتایی و تریگلیسرید و نیز سطوح پایینتری از گلوبولین متصل شونده به هورمون جنسی SHBG (Sex hormone binding globulin) را نشان میدهند، علاوه بر این در این بیماران افزایش نسبت LH (Luteinizing hormone) به FSH (Follicle-stimulating hormone) دیده میشود (6).
تظاهرات بالینی PCOS ناشی از اختالالات اندوکرینی
زنان مبتلا به این سندرم اغلب به اختلالات سیکل قاعدگی، تظاهرات بالینی هایپرآندروژنیسم و ناباروری دچار هستند. اختلالات قاعدگی که معمولاً در این سندرم مشاهده میشود شامل الیگومنوره، آمنوره و خونریزی قاعدگی نامنظم و طولانیمدت است (3). شرایط بسیاری میتوانند باعث هایپرآندروژنیسم در زنان شوند، اما شایعترین علت در سراسر جهان PCOS است (7). زنان مبتلا به PCOS، اغلب بهدلیل افزایش بیش از حد آندروژن محیطی دچار هیرسوتیسم، آکنه ولگاریس و آلوپسی آندروژنیک میشوند. یکی دیگر از اختلالات پوستی در PCOS ،آکانتوریس نیگریکنس است که یک نشانه شایع هایپر انسولینمی است (8). بنابر گزارش اخیر انجمنPCOS-Excess Androgen ، بررسی انجام شده بر روی 18 مطالعه صورت گرفته از سال 1983 تا 2007 که در برگیرنده 6281 بیمار PCOS بود، حاکی از آن است که 74/7% از زنان هیرسوتیسم داشتند (9). مقاومت به انسولین ممکن است منجر به فرونشانیSHBG ، افزایش سطح تستوسترون آزاد فعال از لحاظ بیولوژیکی و در نتیجه منجر به هیرسوتیسم شود (10). ظهور آکنه نیز میتواند یکی از نشانگرهای هایپرآندروژنیسم باشد. تقریباً در 30-15% زنان بالغ مبتلا بهپلیکیستیک، آکنه دیده میشود (3). آلوپسی آندروژنیک یکی از مواردی میباشد که کمتر مورد مطالعه قرار گرفته و شیوع پایینی از آن در PCOS گزارش شده است (11). تاثیر هایپراندروژنمی بر سطوح میزان مواد و واکنشهای اکسیدان و آنتیاکسیدانی در زنان مبتلا به PCOS هنوز ناشناخته است. با اینحال، در یک مطالعه انسانی نشان داده شده است که تولید ROS (Reactive oxygen species) ارتباط مستقیمی با تستوسترون و آندروستن¬دیون دارد که در نتیجه ممکن است به هایپرآندروژنیسم در زنان مبتلا به PCOS شود. ارتباط بین تستوسترون پلاسما یا آندرواستندیون (Androstenedione) و تولید ROS، نشان میدهد که ROS ممکن است بهطور مستقیم باعث تحریک هایپرآندروژنیسم میشود. مطالعات آزمایشگاهی نشان داده است که ROS، آنزیمهای استروئیدزای تخمدان تولیدکننده آندروژن را تحریک میکند، در حالی که آنتیاکسیدانهایی مانند استاتینها این آنزیم¬ها را سرکوب میکنند (12،13).
پیامدهای PCOS
1 -مقاومت به انسولین و دیابت
مکانیسمهای دخیل در مقاومت به انسولین با حضور عوامل ژنتیکی و محیطی، بهاحتمال زیاد پیچیده است (9). در زنان لاغر مبتلا به PCOS گزارش شده است که یک شکل ذاتی از مقاومت بهانسولین دارند که شامل نقصهای پس از اتصال در سیگنالینگ رسپتور انسولین است. در حالی که زنان چاق مبتلا به PCOS نه تنها از مقاومت به انسولین ذاتی PCOS رنج میبرند بلکه مقاومت به انسولین همراه با چاقی بیش از حد، فشار خون بالا و سایر عوامل متابولیک نیز به آن اضافه میشود (14). مقاومت به انسولین در بیماران PCOS ارتباط نزدیکی با چاقی شکمی و هایپرآندروژنیسم دارد (15). ارتباط بین هایپرآندروژنیسم و مقاومت به انسولین در بسیاری از مطالعات بهصورت معنیدار است اما نه به اندازه ارتباطی که بین ناهنجاریهای انسولین و چاقی است (16). به نظر می¬رسد خطر کلی ابتلا به دیابت نوع 2 و اختلال تحمل گلوکز(IGT) در بیماران PCOS 3 تا 7 برابر درمقایسه با جمعیت زنان سالم، بیشتر باشد (15).
2 -بیماری قلبی عروقی
مطالعات انجام شده در مورد زنان مبتلا به PCOS و زنان غیربیمار که از نظر BMI (Body mass index) مطابقت داشتند، به چندین عامل خطر بیماری قلبی عروقی مرتبط با PCOS اشاره دارند. دیسلیپیدمی در 70% بیماران PCOS ایالات متحده رخ میدهد. شایعترین ویژگیهای دیسلیپیدمی آتروژنیک در PCOS شامل هایپرتریگلیسریدمی، افزایش سطح کلسترول LDL و کاهش سطح کلسترول HDL میباشد (17). علاوه بر این، سایر عوامل خطر بیماری قلبی عروقی مانند فشار خون بالا، اختلال عملکرد اندوتلیال و التهاب نیز وجود دارد. زنان چاق مبتلا بهPCOS فشار سیستولیک بالاتری نسبت به گروه کنترل هموزن خود دارند و نیز زنان مبتلا به الیگومنوره و هیرسوتیسم فشار سیستولیک و دیاستولیک افزایش یافته دارند (18).
3- سرطان
نگرانیها در رابطه با این که زنان مبتلا به PCOS ممکن است در معرض خطر ابتلا به سرطان قرار گیرند، به دهه 1940 بازمیگردد. در یک مقاله منتشر شده در سال 2003، هاردیمن و همکارانش نتیجه گرفتند که شواهد برای افزایش خطر ابتلا به کارسینوم اندومتر در PCOS ناقص و متناقض بود (19). بهطورکلی پذیرفته شده است که زنان مبتلا به PCOSبا آمنوره، درمعرض خطر ابتلا به هایپرپالازی اندومتر و سرطان هستند. بحث و نگرانیهای زیادی در مورد خطر ابتلا به سرطان تخمدان در زنان با عدم تخمکگذاری وجود دارد، بهخصوص بهدلیل استفاده از داروهایی که برای القاء تخمکگذاری در این بیماران استفاده می شود. افزایش مداوم غلظتهای سرمی استروژن میتواند بهطور بالقوه رشد تومورهای حساس دیگر مانند کارسینوم پستان و تخمدان را نیز تقویت کند (20،21).
درمانهای رایج PCOS
درمان سندرم تخمدان پلیکیستیک رژیم غذایی کم کالری و ورزش می باشد، در کنار آنها میتوان از درمان های دارویی نیز بهره برد. هدف از درمان های دارویی برقرار کردن مجدد تخمکگذاری که منجر به بارداری میشود است، در حال حاضر 3 روش درمان بهطور متداول وجود دارند که عبارتند از: کلومیفن سیترات، مهار کنندههای آروماتاز و گنادوتروپینها، حساس کنندهها بهانسولین. بهطور معمول مراحل درمانی در این روش به این صورت می باشد که بیمار ابتدا تحت درمان با داروی کلومیفن سیترات (CC) Clomiphene Citrate قرار میگیرد، اگر تخمکگذاری رخ نداد و یا این دارو اندومتر رحم اثر نامطلوب گذاشت میتوان از مهار کنندههای آروماتاز مثل لتروزول استفاده کرد. در نهایت در روش درمانی سوم از داروهای کلومیفن سیترات همراه با گنادوتروپینها و یا لتروزول با گنادوتروپینها استفاده میشود. گاهاً همراه با این داروها حساس کننده¬های انسولین مثل متفورین برای افزایش حساسیت به انسولین و کمک به تخمکگذاری نیز تجویز میشود (3،4).
مقدمهای بر عوامل استرس اکسیداتیو
استرس اکسیداتیو وضعیت عدم تعادل بین تولید گونههای اکسیژن فعال ROSو میزان آنتیاکسیدان است. در شرایطی که این تعادل برهم بخورد، نتیجه آن افزایش سطح استرس اکسیداتیو است. سلولها و بافتهای تولید مثل فقط در شرایطی که تعادل در وضعیت آنتیاکسیدان و اکسیدان وجود داشته باشد، پایدار خواهند بود (22). رادیکالهای ناپایدار، بسیار واکنشپذیر و آزاد هستند و با گرفتن الکترون از اسیدهای نوکلئیک، پروتئین ها، لیپیدها و کربوهیدرات ها به ثبات می رسند و در نهایت به سلول¬ها آسیب می زنند (23). دو شکل عمده رادیکال آزاد ROS و RNS (Reactive nitrogen species) است. الکترون های آزاد به طور معمول در مسیرهای اکسیداسیون- احیا بهعنوان محصول فرعی تولید می شوند (22). بیشترین گونههــای واکنشگر اکســیژن (ROS) در میتوکندری بهطور عمده در فسفریلاسیون اکسیداتیو کمپلکس I NADH) دهیدروژناز) NADH dehydrogenase و کمپلکس III(کوآنزیم Q و سیتوکروم C اکسیدوردوکتاز) زنجیره انتقال الکترون تولید میشود و به فضای بین دو غشای میتوکندری منتقل می شود. از میان اکسیژن¬های فعال تولید شده 98% در واکنش های لیپولیز و تولید انرژی مصرف می¬شود و تنها دو درصد آن به سه شکل عمده رادیکال آزاد تبدیل میشود که شامل آنیون سوپراکسید (O2-)، پراکسید هیدروژن (H2O2) و هیدروکسیل (HO) اشاره کرد (24). بهعبارتی میتوان گفت ROS مولکولهای کوچک، ناپایدار و بسیار واکنشپذیری هستند که میتوانند پروتئین ها، لیپیدها و DNA را اکسید کنند. تجمع ROS منجر به استرس اکسیداتیو، اکسید شدن اجزای تشکیل دهنده سلولی شامل پروتئینها، DNA و لیپیدها میشود (27-25). مطالعات بسیاری نشان دادهاند که ROS با بیماریهایی مثل سرطان، بیماریهای قلبی-عروقی، نفروپاتی دیابتی و حتی با فرآیندهایی نظیر پیری و ناباروری نیز ارتباط دارد (28،29). اما از آغاز دهه 1990 بود که محققان دریافتند سلولها برای کنترل فعالیتهای فیزیولوژیک خود مقادیر کم و کنترل شده ROS را تولید میکنند و حتی نشان داده شده است که ROS ها بهعنوان پیک ثانویه نقش مثبتی در تنظیم فعالیت سلولها دارند و در واقع غلظتهای فیزیولوژیک آنها برای عملکرد طبیعی سلول لازم و ضروری است. مطالعات نشان دادهاند که در بیشتر سلولها، مقادیر فیزیولوژیک ROS توسط آنزیمهای خانواده NADPH اکسیداز(NOX) تولید میشود (31, 30). این آنزیمها در غشاء پلاسمایی سلولها حضور دارند و با اتصال کلسیم به آنها، تولیدROS را افزایش میدهند (33, 32).

شکل 1: عوامل استرس اکسیداتیو وقتی ایجاد میشود که تعادل بین واکنشهای تولید رادیکال آزاد و واکنشهای آنتیاکسیدان به سمت تولید رادیکالها باشد، این امرنتیجه منفی در فرآیندهای تولیدمثل دارد (34).
گونههای واکنش پذیر اکسیژن(Reactive Oxygen Species)
مولکول اکسیژن، یک گیرنده مناسب برای الکترون است و زنجیره های انتقال الکترون در میتوکندری، که متشکل از سیستم پیچیده ای از پروتئینها و آنزیمهای (سیتوکرومها) موجود در غشاء داخلی میتوکندری است، در نهایت سبب انتقال 4 الکترون به یک مولکول اکسیژن میشوند. نتیجه این فعالیت میتوکندری، دوگانه و متضاد است. از یک طرف، میتوکندری منبع مهم انرژی را برای سلول فراهم میکند و احیاء اکسیژن سبب تولید 36 مولکول ATP میگردد و از طرف دیگر حدود 4 تا 0/4 درصد از اکسیژن بهطور کامل احیاء نشده و تنها با یک الکترون احیاء میشود و در نتیجه آنیون سوپراکسید تولید می شود. آنیون سوپراکسید یک رادیکال آزاد است. این مسئله باعث می شود که رادیکالهای آزاد از اتم یا مولکول اولیهای که از آن ایجاد شده اند، فعالتر باشند. گرچه آنیون سوپراکسید نیمه عمر کوتاهی دارد، اما یک عامل اکسیدکننده بسیار قوی است و می تواند تمام مولکولها را در سلول اکسید کند. آنیون سوپراکسید میتواند به صورت آنزیمی یا خودبه خود به H2O 2 تبدیل شود و در نهایت سبب تولید رادیکال های آزاد هیدروکسیل می شود. این رادیکال های آزاد، گونه های واکنشپذیر اکسیژن (ROS) نامیده می شوند. از جمله دیگر ROSها میتوان از اکسیدنیتریک (NO) آنیون هیپوکلرات (HClO3-) و آنیون پروکسی نیتریت ((ONOO و لیپید پراکسیدازها نام برد (35, 23). گونه های واکنش پذیر اکسیژن غیر از زنجیره انتقال اکسیژن در میتوکندری، توسط سیستم ها و واکنش های دیگری نیز تولید می شود، مثل سیستمهای انتقال الکترون میکروزومال، گزانتیناکسیداز و پراکسیدازها. NADPH اکسیداز نوتروفیل ها یکی از شناخته شده ترین اکسیدازها است که نقش مهمی در دفاع در برابر پاتوژن ها دارد. اکنون مشخص شده که اکثر سلولها حاوی NADPH اکسیداز )خانواده NOX) در غشای پلاسمایی خود می باشند و سطوح پایین و کنترل شده ROS را در زمان انجام فرآیندهای فیزیولوژیک تولید می کنند. پس مقادیر اندک ROS بهطور فیزیولوژیک تولید میشود و قابل ذکر است ROSها در غلظت های اندک بهعنوان پیامآور ثانویه عمل میکنند و سبب تنظیم آپوپتوز، فعال کردن فاکتورهای نسخهبرداری و تنظیم بیان ژنهای مربوط به آنزیمهای آنتیاکسیدان می شود (36).
آنتیاکسیدانها
در حالت فیزیولوژیک باید مقادیر ROS در سطوح پایین باقی بماند و به طور طبیعی آنتیاکسیدانهایی وجود دارند که رادیکالهای آزاد را از بین میبرند (37). سیستمهای دفاعی آنتیاکسیدانی شامل موارد زیر است:
-آنزیمهایی نظیر سوپراکسید دسموتاز، کاتالاز و پراکسیداز که واکنشهای زیر را به ترتیب تسریع میکنند:
2O20 + 2H+ H2O2 + O2
2HO2 2H2O2 + O2
H2O2 + NADH 2H2O2 + 2NAD
پروتئین انتقال دهنده ی آهن و مس نظیر ترانسفرین، فریتین و سرولوپلاسمین.
مولکولهای آنتیاکسیدان کوچک مثل گلوتاتیون، اسید اوریک، بیلیروبین، گلوکز و ویتامینهای E و A, C یوبی کوئینون، کاروتنوئیدها و فلاونوئیدها.
عناصری مانند مس، روی و سلنیوم که در فعالیت آنزیم های آنتیاکسیدانی نقش دارند. مثلاً آنزیم سوپراکسید دسموتاز برای عملکرد درست خود به مس و روی نیاز دارد (38). علیرغم وجود این سیستمهای آنتیاکسیدانی، در بعضی از شرایط تولید ROS افزایش می یابد. از جمله این شرایط میتوان بهمواجهه طولانی مدت با نور خورشید، مواجهه با انواع تشعشعات، تماس با مواد سرطانزا مثل آزبست، سیگار کشیدن، مصرف طولانیمدت بعضی از داروها از جمله قرص های جلوگیری از بارداری، ورزش شدید، مصرف الکل، آلودگی هوا و عوامل عفونی اشاره کرد. در تمام این شرایط تعادل بین اکسیدان ها و آنتیاکسیدان ها از بین رفته و مقدار اکسیدانها بیشتر از آنتیاکسیدانها میشود و این حالتی است که «استرس اکسیداتیو» نامیده میشود. در این وضعیت است که اثرات مضر اکسیدانها ظاهر میشود (39).
نقش ROS در پلیکیستیک
تظاهرات ناشی از بیماری میتواند در نتیجه فاکتورهای متعدد محیطی و ژنتیکی ایجادگردد (35). از جمله فاکتورهای محیطی میتوان بهگونههای واکنشگر اکسیژن ROS اشاره داشت (34). این گونه ها شامل سوپراکسید آنیون (O2) پراکسید هیدروژن (H2O2) و رادیکال هیدورکسیل (OH) بوده و و نقشهای فیزیولوژیکی در بسیاری از فرآیندهای مختلف دستگاه تولیدمثلی زنان از جمله بلوغ اووسیت، تخمکگذاری، لقاح و ریزش های آندومتری دارند. تخمدان از نظر متابولیکی یک عضو فعال است و بهطور مداوم تحت تاثیر انواع استرسها می باشد (40). برای مثال در شرایط پاتولوژیکی مانند تخمدان پلی کیستیک، استرس اکسیداتیو بیش از حد، ممکن است به هایپرپلازی مزانشیم تخمدان کمک کند (41). مولکول های ROS باعث آسیب به DNA اپیتلیوم تخمدانی یا آپوپتوز سلولی می شود. با این حال وضعیت اکسیداتیوی سلول، رشد فولیکولی، تشکیل جسم زرد، تمایز آندومتری و رشد جنینی را تعدیل میکند (42). Gong و همکارانش در سال 2015 بهمطالعه استرس اکسیداتیو در تخمدانهای موش صحرایی مدلPCO پرداختند (43). آنها بیان کردند که در منحنی های رشد، وزن تخمدان و وزن رحم بین گروههای مورد مطالعه، تفاوت معنیداری وجود داشت. Murri و همکاران در سال 2013، مارکرهای در گردش استرس اکسیداتیو و PCOS را در انسان بررسی کردند. آنها بیان کردند در زنان مبتلا به این بیماری مستقل از افزایش وزن، مارکرهای در گردش استرس اکسیداتیو غیرنرمال هستند و براساس این یافتهها پیشنهاد کردند که استرس اکسیداتیو ممکن است در پاتوفیزیولوژی این اختلال شایع شرکت کند (44). مولکول های ROS با مرکزیت اکسیژن و رادیکالهای آزاد هستند. آنها با داشتن یک الکترون تک در لایه خارجی فرم ناپایدار دارند و تمایل فراوانی برای ترکیب با مولکولها یا رادیکالهای دیگر دارند تا به شکل پایداری برسند (47-45).
نقش مالون دی آلدهید در پلیکیستیک
پراکسیداسیون اسیدهای چرب اشباع نشده، یک نوع واکنش زنجیره رادیکالی است که توسط کاهش یک اتم هیدروژن از یک گروه متیلن از زنجیره اسیدهای چرب آغاز میشود. رادیکالهای کربن تشکیل شده توسط این واکنش تمایل دارند که توسط بازآرایی مجدد مولکولی تثبیت شوند و منجر به تشکیل پیوندهای دوگانه میشوند. محصولات واکنش پراکسیداسیون لیپید بهطور گسترده بهعنوان شناساگرهای عوامل اکسیداسیون استرس استفاده میشوند. بهعنوان مثال، مالون دی آلدهید (MDA) Malondialdehyde در طول تجزیه اسیدهای چرب اشباع نشده تولید میشود و جزو محصولات نهایی پایدار پراکسیداسیون لیپیدی است و میتواند بهعنوان یک شناساگر مفید استفاده شود (48).
Kuçu و همکاران (2009) بر روی 31 بیمار پلی کیستیک (با میانگین سنی 23/8 سال) تحقیق کردهاند و نتایج نشان میدهد میزان MDA در خون بیماران در مقایسه با گروه کنترل که شامل افراد سالم است بالاتر بود. سپس این گروه بیماران در دو گروه مقاوم و غیرمقاوم به انسولین تقسیم شدند و بیان داشتند که میزان MDA در سطح قابل¬توجهی در بیماران پلیکیستیک جوان و بدون اضافه وزن و حتی غیرمقاوم به انسولین، بالاتر است (49).
نقش کربونیل پروتئین در پلی کیستیک
مقدار کربونیل پروتئین (PC) Protein carbonyl با یک روش ساده کلومتریک بعد از واکنش سرم با دینیتروفنیل هیدرازین سنجیده میشود. در سال 2007 Fenkci و همکاران نشان دادند میزان PC در بیماران پلی کیستیک با BMI نرمال نسبت به گروه کنترل به طور معنیداری بالاتر بود. نتایج آزمایش نشان داد که رادیکالهای آزاد به پروتئینها در بیماران PCOS آسیب میرسانند. علاوه بر این نشان داده شد که کربونیلهای پروتئین یک همبستگی مثبتی با انسولین ناشتا دارند، که حاکی از ارتباط قوی بین مقاومت انسولین و اکسیداسیون پروتئین در در بیماری پلی کیستیک است (50).
نقش نیتریک اکسید در پلیکیستیک
نیتریک اکسید (RNS)، رادیکال آزادی با مرکزیت نیتروژن هستند و دو مثال عمده آن نیتریک اکسید (NO) و نیتروژن دیاکسید (NO2) هستند. هنگام تبدیل ال-آرژنین به ال- سیترولین محصول NOتولید میشود (30). نیتریک اکسید در اندازه معمول و طبیعی در بهبود عملکرد سلولها کمک میکند اما مقدار اضافی آن سمی است (45). نیتریک اکسید با یک الکترون آزاد بسیار واکنشپذیر است و میتواند به پروتئینها، نوکلئوتیدها و لیپیدها صدمه بزند. RNS در بیماریهایی نظیر آسم، ایسکمی، شوک سپتیک و آترواسکلروز با دوز بالاتری همراه است (51). اندازه گیری غلظت NO با میزان غلظت NO3- و NO2- محاسبه میشود. محتوای NO توسط یک فرآیند دو مرحله ای متشکل از تبدیل نیترات به نیتریت و پس از آن با روش اسپکتروفتومتری در طول موج 540 نانومتر نیتریت کل ارزیابی میشود. Nacul و همکاران در سال 2007، نشان دادند که میزان NO در بیماران پلی کیستیک مشابه با گروه کنترل بود. با این وجود یک همبستگی معنی داری بین میزان انسولین ناشتا و نیتریک اکسید وجود دارد. این دادهها حاکی از آن است حضور NOبه وجود مقاومت به انسولین در بیماران پلی کیستیک وابسته است، اگر چه مطالعات بیشتری برای روشن شدن نقش NO در این بیماری مورد نیاز است (52).
نقش آنتی اکسیدان ها در پلی کیستیک
آنتی اکسیدان ها میزان اضافیROS را کاهش میدهند تا آسیب های قابلتوجهی که توسط این عوامل ایجاد می شوند را خنثی کند. به عبارتی آنتی اکسیدان ها به ایجاد تعادل بین تولید اکسیدانت های سودمند (اغلب بهعنوان مولکول های سیگنال دهنده سلولی عمل می کنند) و آسیبرسان کمک می کنند. دو دسته از آنتی اکسیدان ها وجود دارد: آنزیمی و غیرآنزیمی. آنتی اکسیدان های آنزیمی شامل آنزیم سوپراکسید دسموتاز (SOD)، گلوتاتیون پراکسیداز (GPx) و کاتالاز میباشد. اکسیدانت های غیرآنزیمی شامل گلوتاتیون (GSH) و آلفا-توکوفرول (ویتامینE)، بتا-کاروتن، آسکوربات (ویتامین C)، تائورین، ال-کارنیتین، کوآنزیم Q10 است. سه ایزوفرم از آنتی اکسیدان های آنزیمی در یوکاریوت ها وجود دارد که شامل منگنز-SOD (Mn-SOD)، مس/روی –SOD (Cu/Zn-SOD) و SOD خارج سلولی (EC-SOD) است (23). تحقیقات نشان می دهند، آنتی اکسیدان هایی که تاثیر منفی رادیکالهای آزاد اکسیژن را کاهش می دهند در باروری زنان نقش بسزایی دارند. مطالعات مختلفی در این مورد انجام شده است برای مثال بررسی تغییرات غلظت آنتی اکسیدان در سرم و مایع صفاقی در ناباروری ایدیوپاتیک، ناباروری لوله و بیماران آندومتریوز بررسی شده است. نتایج نشان میدهد غلظت فاکتورهای آنتیاکسیدانی در بیماریهای پلیکیستیکی نویددهنده است (54, 53).
نقش ظرفیت آنتی اکسیدان تام بر روی پلی کیستیک
ظرفیت آنتیاکسیدانی تام (Total antioxidant capacity) بهمعنای توانایی سرم در خنثی کردن رادیکال آزاد و محافظت از ساختار سلول از آسیبهای مولکولی است. روشهای مختلف تشخیصی برای TAC شرح داده شده است، یکی از آنها روش اسپکتروفتومتری است که طی آن کاتیون رادیکالی 2 و 2-آزینوبیس (3-اتیل بنزتیازولین-6–سولفونات) (ABTS) اندازهگیری میشود (55). روش دیگر برای اندازه گیری TAC از طریق تولید رادیکالهای هیدروکسیل است که از طریق واکنشهای فنتون تولید میشود. اگرچه نتایج مطالعات در مورد سطوح آنتیاکسیدانها بحث برانگیز است با این وجود میتوان نتیجهگیری کرد که یک عدم تعادل بین عوامل اکسیداتیو و آنتیاکسیدانها در بیماران پلیکیستیک رخ میدهد (56).
نقش سوپراکسید دسموتاز در پلی کیستیک
آنیون سوپر اکسید که بسیار سمی است در نتیجه احیاء ناکامل اکسیژن با اضافه شدن یک الکترون به اکسیژن مولکولی تولید میشود این محصول سمی توسط آنزیم سوپراکسید دسموتاز (SOD) سریعاً به پراکسید هیدروژن و هیدروژن تبدیل میشود. در سال 2009 Kuçu و همکاران نشان دادند میزان SOD در بیماران پلیکیستیک نسبت به گروه کنترل بهصورت معناداری بالاتر بود. بیماران انتخاب شده در این مطالعه بسیار جوان بودند که توانایی بیشتر برای مقابله با عوامل اکسیداسیون داشتند (57). البته در سال 2001 مطالعه ای نشان داد که بالا بودن میزان SOD در بیماران برای جبران خسارات ناشی از عوامل اکسیداتیو است (58).
مکمل های درمانی موثر بر استرس اکسیداتیو در PCOS
مکمل اسیدهای چرب امگا 3 به منظور کاهش سطح سرمی کلسترول تام، تریگلیسیرید، لیپو پروتئین با چگالی پایین و مالون دی آلدئید در نظر گرفته می شود و دارای اثر ضد التهابی و آنتی اکسیدانی است. اسید آلفا لیپوئیک یک آنتیاکسیدان قوی است که باعث بهبود حساسیت به انسولین و کنترل قند خون در بیماران مبتلا به دیابت نوع 2 می شود. همچنین این مکمل آنتیاکسیدان تاثیر مثبتی در زنان PCOS به همراه داشته است. N- استیل سیستئین یک آنتی اکسیدان حاوی تیول است که سطح گلوتاتیون داخل سلولی را بالا می برد و حساسیت بهانسولین را در زنان مبتلا به PCOS افزایش میدهد. این یافته ها، ما را به سمت ارزیابی آنتیاکسیدانهای دیگر هدایت میکند که میتوانند حساسیت به انسولین را بهبود بخشند، میزان تخمکگذاری را افزایش دهند و خطر ابتلا بهدیابت نوع 2 و بیماریهای قلبی و عروقی را در زنان مبتلا بهPCOS کاهش دهند (59,60).
نتیجهگیری
سندرم تخمدان پلیکیستیک یک اختلال رایج، ناهمگن و وراثتی است که زنان را در طول عمرشان تحتتاثیر قرار میدهد. تشخیص زودهنگام و مدیریت صحیح میتواند به کنترل این سندرم کمک کند و از پیامدهای بلندمدت آن جلوگیری کند. به این ترتیب پزشک در کنار درمان تظاهرات بالینی بیماران و به حداقل رساندن اثرات این عارضه بر روی باروری، جهت پیشگیری از عوارض دیر هنگام این اختلال مانند دیابت نوع 2، بیماری قلبی عروقی و سرطان اندومتر نیز اقدام کند. در این مقاله، بیماری پلی کیستیک و عوامل استرساکسیداتیو مورد بحث قرار گرفت. انواع متفاوتی از عوامل اکسیداسیون و آنتیاکسیدان ها شرح داده شد و با توجه بهمطالعات پیشین، نتیجه مشخصی برای ارتباط عوامل استرس اکسیداسیون و بیماری پلی کیستیک بیان نشده است و باید تحقیقات بیشتری بر روی مکانیسم اثر این عوامل بر روی بیماری ذکر شده انجام شود. علاوه بر این تحقیقاتی دیگر برای کاهش میزان چربی احشایی در بیمار PCOS در حال انجام است که با بررسی تاثیر این موضوع بر روی کاهش نشانگرهای خطر قلبی عروقی، بهبود مقاومت به انسولین و بهبود علائم بالینی بیماران پلی کیستیک همراه است.
تعارض در منافع: وجود ندارد.
References:
1-McGowan MP. Polycystic Ovary Syndrome: A Common Endocrine Disorder and Risk Factor for Vascular Disease. Current Treatment Options in Cardiovascular Med 2011; 13(4): 289-301.
2-El Hayek S, Bitar L, Hamdar LH, Mirza FG, Daoud G. Poly Cystic Ovarian Syndrome: An Updated Overview. Frontiers in physiol 2016; 7: 124.
3-Sirmans SM, Pate KA. Epidemiology, Diagnosis, and Management of Polycystic Ovary Syndrome. Clinical Epidemiol 2014; 6: 1.
4-Jalilian A, Kiani F, Sayehmiri F, Sayehmiri K, Khodaee Z, Akbari M. Prevalence of Polycystic Ovary Syndrome and its Associated Complications in Iranian Women: A Meta-Analysis. Iran J Reproduct Med 2015; 13(10): 591.
5-Teede H, Deeks A, Moran L. Polycystic Ovary Syndrome: A Complex Condition with Psychological, Reproductive and Metabolic Manifestations that Impacts on Health Across the Lifespan. BMC Med 2010; 8(1): 41.
6-Vilmann LS, Thisted E, Baker JL, Holm J-C. Development of Obesity and Polycystic Ovary Syndrome in Adolescents. Horm Res in Paediatr 2012; 78(5-6): 269-78.
7-Meek CL, Bravis V, Don A, Kaplan F. Polycystic Ovary Syndrome and the Differential Diagnosis of Hyperandrogenism. The Obstetrician & Gynaecol 2013; 15(3): 171-6.
8-Lee AT, Zane LT. Dermatologic Manifestations of Polycystic Ovary Syndrome. American J Clin Dermatol 2007; 8(4): 201-19.
9-Pasquali R, Gambineri A. Therapy of Endocrine Disease: Treatment of Hirsutism in the Polycystic Ovary Syndrome. Eur J Endocrinol 2014; 170(2): R75-90.
10-Allahbadia GN, Merchant R. Polycystic Ovary Syndrome and Impact on Health. Middle East Fertility Society J 2011; 16(1): 19-37.
11-Lowenstein EJ. Diagnosis And Management of the Dermatologic Manifestations of the Polycystic Ovary Syndrome. Dermatologic Therapy 2006; 19(4): 210-23.
12-González F, Minium J, Rote NS, Kirwan JP. Hyperglycemia Alters Tumor Necrosis Factor-Α Release from Mononuclear Cells in Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metabol 2005; 90(9): 5336-42.
13-Piotrowski P, Rzepczynska I, Kwintkiewicz J, Duleba A, editors. Oxidative Stress Induces Expression of CYP11A, CYP17, Star and 3 Beta HSD in Rat Theca-Interstitial Cells. J Society for Gynecologic Investigation; 2005; 12( 2): 319A.
14-Shi Y, Cui Y, Sun X, Ma G, Ma Z, Gao Q, et al. Hypertension in Women with Polycystic Ovary Syndrome: Prevalence and Associated Cardiovascular Risk Factors. Eur J Obstetrics Gynecol Reproductive Biol 2014; 173: 66-70.
15-Hudecova M, Holte J, Olovsson M, Larsson A, Berne C, Poromaa IS. Diabetes And Impaired Glucose Tolerance in Patients with Polycystic Ovary Syndrome-A Long Term Follow-Up. Human Reproduction 2011; 26(6): 1462-8.
16-Traub ML. Assessing and Treating Insulin Resistance in Women with Polycystic Ovarian Syndrome. World J Diabetes 2011; 2(3): 33.
17-Goodarzi MO, Dumesic DA, Chazenbalk G, Azziz R. Polycystic Ovary Syndrome: Etiology, Pathogenesis and Diagnosis. Nature Rev Endocrinol 2011; 7(4): 219.
18-Nandi A, Chen Z, Patel R, Poretsky L. Polycystic Ovary Syndrome. Endocrinol Metab Clin 2014; 43(1): 123-47.
19-Haoula Z, Salman M, Atiomo W. Evaluating the Association between Endometrial Cancer and Polycystic Ovary Syndrome. Human Reproduct 2012; 27(5): 1327-31.
20-Daniilidis A, Dinas K. Long Term Health Consequences of Polycystic Ovarian Syndrome: a Review Analysis. Hippokratia 2009; 13(2): 90.
21-Yin W, Falconer H, Yin L, Xu L, Ye W. Association between Polycystic Ovary Syndrome and Cancer Risk. JAMA Oncol 2019; 5(1): 106-7.
22-Agarwal A, Said TM, Bedaiwy MA, Banerjee J, Alvarez JG. Oxidative Stress in an Assisted Reproductive Techniques Setting. Fertil Steril 2006; 86(3): 503-12.
23-Agarwal A, Gupta S, Sekhon L, Shah R. Redox Considerations in Female Reproductive Function and Assisted Reproduction: From Molecular Mechanisms to Health Implications. Antioxid edox Signal 2008; 10(8): 1375-404.
24-Inoue M, Sato EF, Nishikawa M, Park A-M, Kira Y, Imada I, et al. Mitochondrial Generation of Reactive Oxygen Species and its Role in Aerobic Life. Curr Med Chem 2003; 10(23): 2495-505.
25-Finkel T. Oxidant Signals and Oxidative Stress. Curr Opin Cell Biol 2003; 15(2): 247-54.
26-Scherz-Shouval R, Elazar Z. Ros, Mitochondria and the Regulation of Autophagy. Trends in Cell Biol 2007; 17(9): 422-7.
27-Kern JC, Kehrer JP. Free Radicals and Apoptosis: Relationships with Glutathione, Thioredoxin, and the BCL Family of Proteins. Front Biosci 2005; 10: 1727-38.
28-Halliwell B. Free Radicals and Antioxidants: Updating a Personal View. Nutr Rev 2012; 70(5): 257-65.
29-Montezano AC, Touyz RM. Molecular Mechanisms of Hypertension—Reactive Oxygen Species and Antioxidants: A Basic Science Update for the Clinician. Can J Cardiol 2012; 28(3): 288-95.
30-Stief T. The Routine Blood ROS Generation Assay (BRGA) Triggered by Typical Septic Concentrations of Zymosan A. Hemostasis Laboratory 2013; 6(1): 89.
31-Armstrong JS, Bivalacqua TJ, Chamulitrat W, Sikka S, Hellstrom WJ. A Comparison of the NADPH Oxidase in Human Sperm and White Blood Cells. Int J Androl 2002; 25(4): 223-9.
32-Brown DI, Griendling KK. Nox Proteins in Signal Transduction. Free Radic Biol Med 2009; 47(9): 1239-53.
33-Bánfi B, Tirone F, Durussel I, Knisz J, Moskwa P, Molnár GZ, et al. Mechanism of Ca2+ Activation of the NADPH Oxidase 5 (NOX5). J Biol Chem 2004; 279(18): 18583-91.
34-Raha S, Robinson BH. Mitochondria, Oxygen Free Radicals, and Apoptosis. Am J Med Genet 2001; 106(1): 62-70.
35-Dasgupta S, Reddy BM. Present Status of Understanding on the Genetic Etiology of Polycystic Ovary Syndrome. J Postgraduate Med 2008; 54(2): 115-25.
36-Bae YS, Oh H, Rhee SG, Do Yoo Y. Regulation of Reactive Oxygen Species Generation in Cell Signaling. Mol Cells 2011; 32(6): 491-509.
37-de Lamirande E, O’Flaherty C. Sperm Activation: Role of Reactive Oxygen Species and Kinases. Biochim Biophys Acta 2008; 1784(1): 106-15.
38-Blokhina O, Virolainen E, Fagerstedt KV. Antioxidants, Oxidative Damage and Oxygen Deprivation Stress: A Review. Ann Bot 2003; 91(2): 179-94.
39-Cancer: A Methodological Approach for Studying the Link Between Cancer and the Environment. In: INSERM Collective Expertise Centre. INSERM Collective Expert Reports. Paris: Institut National De La Santé Et De La Recherche Médicale; 2005.
40-Sugino N, Karube-Harada A, Taketani T, Sakata A, Nakamura Y. Withdrawal of Ovarian Steroids Stimulates Prostaglandin F2α Production through Nuclear Factor-Κb Activation Via Oxygen Radicals in Human Endometrial Stromal Cells: Potential Relevance to Menstruation. J Reprod Dev 2004; 50(2): 215-25.
41-Fujii J, Iuchi Y, Okada F. Fundamental Roles of Reactive Oxygen Species and Protective Mechanisms in the Female Reproductive System. Reproductive Biol Endocrinol 2005; 3(1): 43.
42-Ghasemzadeh A, Farzadi L, Khaki A, Ahmadi SK. Effect of Allium Cepa Seeds Ethanolic Extract on Experimental Polycystic Ovary Syndrome (PCOS) Apoptosis Induced by Estradiol-Valerate. Life Sci J 2013; 10(4s): 170-5.
43-Gong J, Wu D, Zhang L, Li J, Zhao X, Zhang D. Study on the Oxidative Stress in the Ovaries of a Rat Model of Polycystic Ovary. Sichuan Da Xue Xue Bao Yi Xue Ban 2015; 46(2): 238-42, 247.
44-Murri M, Luque-Ramírez M, Insenser M, Ojeda-Ojeda M, Escobar-Morreale HF. Circulating Markers of Oxidative Stress and Polycystic Ovary Syndrome (PCOS): A Systematic Review and Meta-Analysis. Hum Reprod Update 2013; 19(3): 268-88.
45-Agarwal A, Gupta S, Sharma RK. Role of Oxidative Stress in Female Reproduction. Reproductive Biology Endocrinol 2005; 3(1): 28.
46-Palomba S, Daolio J, La Sala GB. Oocyte Competence on Women with Polycystic Ovary Syndrome. Trends Endocrinol Metabol 2017; 28(3): 186-98.
47-Fathi FH. Biomarkers of Oxidative Stress in Polycystic Ovary Disorder. Annals of the College of Medicine, Mosul 2020; 41(2): 112-16.
48-Abuja PM, Albertini R. Methods for Monitoring Oxidative Stress, Lipid Peroxidation and Oxidation Resistance Of Lipoproteins. Clin Chim Acta 2001; 306(1-2): 1-17.
49-Palacio J, Iborra A, Ulcova‐Gallova Z, Badia R, Martinez P. The Presence of Antibodies to Oxidative Modified Proteins in Serum from Polycystic Ovary Syndrome Patients. Clin Exp Immunol 2006; 144(2): 217-22.
50-Fenkci IV, Serteser M, Fenkci S, Kose S. Paraoxonase Levels in Women with Polycystic Ovary Syndrome. The J Reprod Med 2007; 52(10): 879-83.
51-Nazıroğlu M. Role of Selenium on Calcium Signaling and Oxidative Stress-Induced Molecular Pathways in Epilepsy. Neurochem Res 2009; 34(12): 2181-91.
52-Nacul A, Andrade C, Schwarz P, de Bittencourt Jr PH, Spritzer P. Nitric Oxide and Fibrinogen in Polycystic Ovary Syndrome: Associations with Insulin Resistance and Obesity. Eur J Obstet Gynecol Reprod Biol 2007; 133(2): 191-6.
53-Jozwik M, Wolczynski S, Jozwik M, Szamatowicz M. Oxidative Stress Markers in Preovulatory Follicular Fluid in Humans. Mol Hum Reprod 1999; 5(5): 409-13.
54-Paszkowski T, Traub A, Robinson S, McMaster D. Selenium Dependent Glutathione Peroxidase Activity in Human Follicular Fluid. Clin Chim Acta 1995; 236(2): 173-80.
55-Mahfouz R, Sharma R, Sharma D, Sabanegh E, Agarwal A. Diagnostic Value of the Total Antioxidant Capacity (TAC) in Human Seminal Plasma. Fertil Steril 2009; 91(3): 805-11.
56-Verit FF, Erel O. Oxidative Stress in Nonobese Women with Polycystic Ovary Syndrome: Correlations with Endocrine and Screening Parameters. Gynecol Obstet Invest 2008; 65(4): 233-9.
57-Kuşçu NK, Var A. Oxidative Stress but Not Endothelial Dysfunction Exists in Non Obese, Young Group of Patients with Polycystic Ovary Syndrome. Acta Obstet Gynecol Scand 2009; 88(5): 612-7.
58-Sabuncu T, Vural H, Harma M, Harma M. Oxidative Stress In Polycystic Ovary Syndrome And Its Contribution To The Risk Of Cardiovascular Disease. Clin Biochem 2001; 34(5): 407-13
59-Macut D, Bjekić-Macut J, Savić-Radojević A. Dyslipidemia and Oxidative Stress in PCOS Inpolycystic Ovary Syndrome. Karger 2013; 40: 51-63.
60-Mokhtari V, Afsharian P, Shahhoseini M, Kalantar SM, Moini A. A Review on Various Uses of N-Acetyl Cysteine. Cell J 2017; 19(1): 11-7.
1-McGowan MP. Polycystic Ovary Syndrome: A Common Endocrine Disorder and Risk Factor for Vascular Disease. Current Treatment Options in Cardiovascular Med 2011; 13(4): 289-301.
2-El Hayek S, Bitar L, Hamdar LH, Mirza FG, Daoud G. Poly Cystic Ovarian Syndrome: An Updated Overview. Frontiers in physiol 2016; 7: 124.
3-Sirmans SM, Pate KA. Epidemiology, Diagnosis, and Management of Polycystic Ovary Syndrome. Clinical Epidemiol 2014; 6: 1.
4-Jalilian A, Kiani F, Sayehmiri F, Sayehmiri K, Khodaee Z, Akbari M. Prevalence of Polycystic Ovary Syndrome and its Associated Complications in Iranian Women: A Meta-Analysis. Iran J Reproduct Med 2015; 13(10): 591.
5-Teede H, Deeks A, Moran L. Polycystic Ovary Syndrome: A Complex Condition with Psychological, Reproductive and Metabolic Manifestations that Impacts on Health Across the Lifespan. BMC Med 2010; 8(1): 41.
6-Vilmann LS, Thisted E, Baker JL, Holm J-C. Development of Obesity and Polycystic Ovary Syndrome in Adolescents. Horm Res in Paediatr 2012; 78(5-6): 269-78.
7-Meek CL, Bravis V, Don A, Kaplan F. Polycystic Ovary Syndrome and the Differential Diagnosis of Hyperandrogenism. The Obstetrician & Gynaecol 2013; 15(3): 171-6.
8-Lee AT, Zane LT. Dermatologic Manifestations of Polycystic Ovary Syndrome. American J Clin Dermatol 2007; 8(4): 201-19.
9-Pasquali R, Gambineri A. Therapy of Endocrine Disease: Treatment of Hirsutism in the Polycystic Ovary Syndrome. Eur J Endocrinol 2014; 170(2): R75-90.
10-Allahbadia GN, Merchant R. Polycystic Ovary Syndrome and Impact on Health. Middle East Fertility Society J 2011; 16(1): 19-37.
11-Lowenstein EJ. Diagnosis And Management of the Dermatologic Manifestations of the Polycystic Ovary Syndrome. Dermatologic Therapy 2006; 19(4): 210-23.
12-González F, Minium J, Rote NS, Kirwan JP. Hyperglycemia Alters Tumor Necrosis Factor-Α Release from Mononuclear Cells in Women with Polycystic Ovary Syndrome. J Clin Endocrinol Metabol 2005; 90(9): 5336-42.
13-Piotrowski P, Rzepczynska I, Kwintkiewicz J, Duleba A, editors. Oxidative Stress Induces Expression of CYP11A, CYP17, Star and 3 Beta HSD in Rat Theca-Interstitial Cells. J Society for Gynecologic Investigation; 2005; 12( 2): 319A.
14-Shi Y, Cui Y, Sun X, Ma G, Ma Z, Gao Q, et al. Hypertension in Women with Polycystic Ovary Syndrome: Prevalence and Associated Cardiovascular Risk Factors. Eur J Obstetrics Gynecol Reproductive Biol 2014; 173: 66-70.
15-Hudecova M, Holte J, Olovsson M, Larsson A, Berne C, Poromaa IS. Diabetes And Impaired Glucose Tolerance in Patients with Polycystic Ovary Syndrome-A Long Term Follow-Up. Human Reproduction 2011; 26(6): 1462-8.
16-Traub ML. Assessing and Treating Insulin Resistance in Women with Polycystic Ovarian Syndrome. World J Diabetes 2011; 2(3): 33.
17-Goodarzi MO, Dumesic DA, Chazenbalk G, Azziz R. Polycystic Ovary Syndrome: Etiology, Pathogenesis and Diagnosis. Nature Rev Endocrinol 2011; 7(4): 219.
18-Nandi A, Chen Z, Patel R, Poretsky L. Polycystic Ovary Syndrome. Endocrinol Metab Clin 2014; 43(1): 123-47.
19-Haoula Z, Salman M, Atiomo W. Evaluating the Association between Endometrial Cancer and Polycystic Ovary Syndrome. Human Reproduct 2012; 27(5): 1327-31.
20-Daniilidis A, Dinas K. Long Term Health Consequences of Polycystic Ovarian Syndrome: a Review Analysis. Hippokratia 2009; 13(2): 90.
21-Yin W, Falconer H, Yin L, Xu L, Ye W. Association between Polycystic Ovary Syndrome and Cancer Risk. JAMA Oncol 2019; 5(1): 106-7.
22-Agarwal A, Said TM, Bedaiwy MA, Banerjee J, Alvarez JG. Oxidative Stress in an Assisted Reproductive Techniques Setting. Fertil Steril 2006; 86(3): 503-12.
23-Agarwal A, Gupta S, Sekhon L, Shah R. Redox Considerations in Female Reproductive Function and Assisted Reproduction: From Molecular Mechanisms to Health Implications. Antioxid edox Signal 2008; 10(8): 1375-404.
24-Inoue M, Sato EF, Nishikawa M, Park A-M, Kira Y, Imada I, et al. Mitochondrial Generation of Reactive Oxygen Species and its Role in Aerobic Life. Curr Med Chem 2003; 10(23): 2495-505.
25-Finkel T. Oxidant Signals and Oxidative Stress. Curr Opin Cell Biol 2003; 15(2): 247-54.
26-Scherz-Shouval R, Elazar Z. Ros, Mitochondria and the Regulation of Autophagy. Trends in Cell Biol 2007; 17(9): 422-7.
27-Kern JC, Kehrer JP. Free Radicals and Apoptosis: Relationships with Glutathione, Thioredoxin, and the BCL Family of Proteins. Front Biosci 2005; 10: 1727-38.
28-Halliwell B. Free Radicals and Antioxidants: Updating a Personal View. Nutr Rev 2012; 70(5): 257-65.
29-Montezano AC, Touyz RM. Molecular Mechanisms of Hypertension—Reactive Oxygen Species and Antioxidants: A Basic Science Update for the Clinician. Can J Cardiol 2012; 28(3): 288-95.
30-Stief T. The Routine Blood ROS Generation Assay (BRGA) Triggered by Typical Septic Concentrations of Zymosan A. Hemostasis Laboratory 2013; 6(1): 89.
31-Armstrong JS, Bivalacqua TJ, Chamulitrat W, Sikka S, Hellstrom WJ. A Comparison of the NADPH Oxidase in Human Sperm and White Blood Cells. Int J Androl 2002; 25(4): 223-9.
32-Brown DI, Griendling KK. Nox Proteins in Signal Transduction. Free Radic Biol Med 2009; 47(9): 1239-53.
33-Bánfi B, Tirone F, Durussel I, Knisz J, Moskwa P, Molnár GZ, et al. Mechanism of Ca2+ Activation of the NADPH Oxidase 5 (NOX5). J Biol Chem 2004; 279(18): 18583-91.
34-Raha S, Robinson BH. Mitochondria, Oxygen Free Radicals, and Apoptosis. Am J Med Genet 2001; 106(1): 62-70.
35-Dasgupta S, Reddy BM. Present Status of Understanding on the Genetic Etiology of Polycystic Ovary Syndrome. J Postgraduate Med 2008; 54(2): 115-25.
36-Bae YS, Oh H, Rhee SG, Do Yoo Y. Regulation of Reactive Oxygen Species Generation in Cell Signaling. Mol Cells 2011; 32(6): 491-509.
37-de Lamirande E, O’Flaherty C. Sperm Activation: Role of Reactive Oxygen Species and Kinases. Biochim Biophys Acta 2008; 1784(1): 106-15.
38-Blokhina O, Virolainen E, Fagerstedt KV. Antioxidants, Oxidative Damage and Oxygen Deprivation Stress: A Review. Ann Bot 2003; 91(2): 179-94.
39-Cancer: A Methodological Approach for Studying the Link Between Cancer and the Environment. In: INSERM Collective Expertise Centre. INSERM Collective Expert Reports. Paris: Institut National De La Santé Et De La Recherche Médicale; 2005.
40-Sugino N, Karube-Harada A, Taketani T, Sakata A, Nakamura Y. Withdrawal of Ovarian Steroids Stimulates Prostaglandin F2α Production through Nuclear Factor-Κb Activation Via Oxygen Radicals in Human Endometrial Stromal Cells: Potential Relevance to Menstruation. J Reprod Dev 2004; 50(2): 215-25.
41-Fujii J, Iuchi Y, Okada F. Fundamental Roles of Reactive Oxygen Species and Protective Mechanisms in the Female Reproductive System. Reproductive Biol Endocrinol 2005; 3(1): 43.
42-Ghasemzadeh A, Farzadi L, Khaki A, Ahmadi SK. Effect of Allium Cepa Seeds Ethanolic Extract on Experimental Polycystic Ovary Syndrome (PCOS) Apoptosis Induced by Estradiol-Valerate. Life Sci J 2013; 10(4s): 170-5.
43-Gong J, Wu D, Zhang L, Li J, Zhao X, Zhang D. Study on the Oxidative Stress in the Ovaries of a Rat Model of Polycystic Ovary. Sichuan Da Xue Xue Bao Yi Xue Ban 2015; 46(2): 238-42, 247.
44-Murri M, Luque-Ramírez M, Insenser M, Ojeda-Ojeda M, Escobar-Morreale HF. Circulating Markers of Oxidative Stress and Polycystic Ovary Syndrome (PCOS): A Systematic Review and Meta-Analysis. Hum Reprod Update 2013; 19(3): 268-88.
45-Agarwal A, Gupta S, Sharma RK. Role of Oxidative Stress in Female Reproduction. Reproductive Biology Endocrinol 2005; 3(1): 28.
46-Palomba S, Daolio J, La Sala GB. Oocyte Competence on Women with Polycystic Ovary Syndrome. Trends Endocrinol Metabol 2017; 28(3): 186-98.
47-Fathi FH. Biomarkers of Oxidative Stress in Polycystic Ovary Disorder. Annals of the College of Medicine, Mosul 2020; 41(2): 112-16.
48-Abuja PM, Albertini R. Methods for Monitoring Oxidative Stress, Lipid Peroxidation and Oxidation Resistance Of Lipoproteins. Clin Chim Acta 2001; 306(1-2): 1-17.
49-Palacio J, Iborra A, Ulcova‐Gallova Z, Badia R, Martinez P. The Presence of Antibodies to Oxidative Modified Proteins in Serum from Polycystic Ovary Syndrome Patients. Clin Exp Immunol 2006; 144(2): 217-22.
50-Fenkci IV, Serteser M, Fenkci S, Kose S. Paraoxonase Levels in Women with Polycystic Ovary Syndrome. The J Reprod Med 2007; 52(10): 879-83.
51-Nazıroğlu M. Role of Selenium on Calcium Signaling and Oxidative Stress-Induced Molecular Pathways in Epilepsy. Neurochem Res 2009; 34(12): 2181-91.
52-Nacul A, Andrade C, Schwarz P, de Bittencourt Jr PH, Spritzer P. Nitric Oxide and Fibrinogen in Polycystic Ovary Syndrome: Associations with Insulin Resistance and Obesity. Eur J Obstet Gynecol Reprod Biol 2007; 133(2): 191-6.
53-Jozwik M, Wolczynski S, Jozwik M, Szamatowicz M. Oxidative Stress Markers in Preovulatory Follicular Fluid in Humans. Mol Hum Reprod 1999; 5(5): 409-13.
54-Paszkowski T, Traub A, Robinson S, McMaster D. Selenium Dependent Glutathione Peroxidase Activity in Human Follicular Fluid. Clin Chim Acta 1995; 236(2): 173-80.
55-Mahfouz R, Sharma R, Sharma D, Sabanegh E, Agarwal A. Diagnostic Value of the Total Antioxidant Capacity (TAC) in Human Seminal Plasma. Fertil Steril 2009; 91(3): 805-11.
56-Verit FF, Erel O. Oxidative Stress in Nonobese Women with Polycystic Ovary Syndrome: Correlations with Endocrine and Screening Parameters. Gynecol Obstet Invest 2008; 65(4): 233-9.
57-Kuşçu NK, Var A. Oxidative Stress but Not Endothelial Dysfunction Exists in Non Obese, Young Group of Patients with Polycystic Ovary Syndrome. Acta Obstet Gynecol Scand 2009; 88(5): 612-7.
58-Sabuncu T, Vural H, Harma M, Harma M. Oxidative Stress In Polycystic Ovary Syndrome And Its Contribution To The Risk Of Cardiovascular Disease. Clin Biochem 2001; 34(5): 407-13
59-Macut D, Bjekić-Macut J, Savić-Radojević A. Dyslipidemia and Oxidative Stress in PCOS Inpolycystic Ovary Syndrome. Karger 2013; 40: 51-63.
60-Mokhtari V, Afsharian P, Shahhoseini M, Kalantar SM, Moini A. A Review on Various Uses of N-Acetyl Cysteine. Cell J 2017; 19(1): 11-7.
نوع مطالعه: مروری |
موضوع مقاله:
زنان و زایمان
دریافت: 1398/12/16 | پذیرش: 1399/5/10 | انتشار: 1399/5/10
دریافت: 1398/12/16 | پذیرش: 1399/5/10 | انتشار: 1399/5/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







