دوره 28، شماره 3 - ( خرداد 1399 )
جلد 28 شماره 3 صفحات 2514-2502 |
برگشت به فهرست نسخه ها
Ethics code: EE/97.24.3.70013/scu.ac.ir
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Moradi S, Habibi A H, Tabande M R, Shakerian S. Comparison of Nitric Oxide Changes in Hippocampal Tissue and Pain Sensation in Male Rats Parkinson's Model Following 6 Weeks of Continuous and Intermittent Training. JSSU 2020; 28 (3) :2502-2514
URL: http://jssu.ssu.ac.ir/article-1-5069-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5069-fa.html
مرادی سعید، حبیبی عبدالحمید، تابنده محمدرضا، شاکریان سعید. مقایسه تغییرات نیتریک اکساید بافت هیپوکمپ و حس درد رت های نر مدل پارکینسونی متعاقب 6 هفته تمرینات تداومی و تناوبی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (3) :2502-2514
متن کامل [PDF 791 kb]
(844 دریافت)
| چکیده (HTML) (2053 مشاهده)
متن کامل: (1696 مشاهده)
مقدمه
بیماری پارکینسون (Parkinson) یک بیماری پیشرونده عصبی است که پیشبینی میشود تا سال 2030 حدود 9 میلیون نفر در سراسر جهان را مبتلا کند (1). پارکینسون یک بیماری سیستم عصبی است که در اثر از بین رفتن نورونهای دوپامینرژیک در مادۀ سیاه ایجاد شده و دارای علائمی همچون رعشه در زمان استراحت، علایم روانی و اختلالات وضعیتی و حرکتی میباشد (2). با ایجاد اختلال در بخش هایی از مغز، اجسام لویی شروع به تجمع در محل از بین رفتن نورونهای دوپامینرژیک (Dopaminergic) میکنند (3).
استرس اکسیداتیو (Oxidative stress) عامل اصلی دژنراسیون در تعدادی از بیماریهای نورودژنراتیو مانند: پارکینسون، آلزایمر و مالتیپلاسکلروزیس میباشد (4). استرس اکسیداتیو ناشی از یک عدم تعادل بین تولید گونههای باز فعال اکسیژن (ROS) و توانایی سیستم زیستی برای سمزدایی این واسطههای فعال میباشد. استرس اکسیداتیو سبب القای آسیب اکسیداتیو در هیپوکمپ و آسیب سلول های هرمی میشود (4). هیپوکمپ بالغین یک مرکز حیاتی برای فرآیندهای یادگیری و حافظه میباشد که به شدت نسبت به بیماریهای نورولوژیک نظیر پارکینسون آسیبپذیر میباشد. استرس اکسایشی یکی از گذرگاههای مهمی است که منجر به مرگ سلولی نورونی القاء شده توسط نیتریک اکساید (NO) میگردد. نیتریک اکسید رادیکالی آزاد با پیچیدگی بیوشیمیایی قابلتوجه است که درگیریاش در پارکینسون به اثبات رسیده است با این حال میزان مشارکت NO در پارکینسون هنوز مشخص نشده است (5). این وضعیت بخشی به علت نقشهای مخالفی است که NO به مدت طولانی به عنوان عامل اصلی التهاب شدید در CNS در نظر گرفته میشد اما یافتهها نشان دادند که NO از یک طرف عمل پیشالتهابی دارد و از طرفی دیگر به کنترل فرایند های پاسخ ایمنی کمک می کند و نقش ضد التهابی دارد، NO می تواند بهعنوان فعال کننده مرگ سلولی یا بازدارنده مرگ سلولی عمل کند که این وضعیت وابسته به محیط بیولوژیکی یعنی حضور یا عدم حضور سیگنالهای بازدارنده یا تحریکی است (5). نیتریک اکساید بهعنوان یک گونۀ فعال نیتروژن است این رادیکال آزاد گازی، یک پیامبر بیولوژیک با قدرت انتشار بالاست که نقش مهمی در فیزیولوژی سیستم عصبی مرکزی بازی میکند. نیتریک اکساید پس از تولید به سرعت با سوپر اکسید واکنش داده و رادیکالهای قوی پراکسینیتریت و هیدروکسیل را تولید میکند. گونههای واکنشگر اکسیژن و و نیتروژن در مجموع موجب ایجاد استرس اکسیداتیو در سیستم عصبی خواهند شد (6). در این راستا الجراح و همکاران (2013) در مطالعهای نشان دادند که 4 هفته ورزشی استقامتی بر روی تردمیل دارای تأثیر مثبت در بیان NO و iNOS (Inhalational nitric oxide) در جسم مخطط رتهای مدل پارکینسونی است. در این مطالعه NO افزایش قابل توجهی در جسم مخطط موش پارکینسونی در مقایسه با موش سالم نشان داد که تمرین ورزشی میزان NO در بیماران پارکینسونی را نسبت به گروه کنترل کاهش داد (7). همچنین مورای و همکاران ( 2014 ) در مطالعهای تاثیر تمرین ورزشی بر شاخصهای آنتی اکسیدانی و شاخصهای التهابی بیماران پارکینسونی را بررسی کردند. در مطالعهای نشان دادند که ورزش میتواند یک رویکرد کاملاً منطقی برای توسعۀ درمانهای محافظتی و عصبی بیماری پارکینسون باشد. ورزش باعث، تحریک دفاع آنتیاکسیدانی و کاهش التهاب میشود (8). نیتریک اکساید ضمن اینکه به عنوان یک گشاد کننده عروق و نیز یک نوروترانسمیتر میباشد، در غلظت های بالاتر با تشکیل پراکسی نیتریت و نیتروزیل دار کردن پیامبرهای سیگنال سلولی در تنظیم روند التهاب مؤثر است، بنابراین ضمن اینکه نیتریک اکساید دارای نقش فیزیولوژیکی در سیگنال سلولی نورونی است، اما سنتز بیش از حد آن باعث ایجاد بیماریهای نورودژنراتیو می شود (9). همچنین نشان داده شده است درد از عوارضی است که براحتی در بیماری پارکینسون قابل شناسایی بوده و در بعضی از مبتلایان موجب ناتوانی جدی شده و بر کیفیت زندگی اثر منفی میگذارد. البته شکل درد در این بیماران مختلف بوده که بر اساس نوع خود، درمان متفاوتی را هم میطلبد. عمده درمان ها شامل تجویز دارو و یا جراحی است (10). تحقیقات جدید نشان داده که هستههای قاعدهای نه تنها در کنترل حرکتی نقش دارند بلکه در بروز احساسات، یادگیری، تصمیمگیری و نیز پردازش حس درد هم تاثیرگذار هستند (11). شواهد نوروآناتومیک نشان میدهد که اطلاعات درد ممکن است از طریق مسیرهای مختلف به عقدههای قاعدهای برسند. در این راستا مطالعات الکتروفیزیولوژیک نشان دادهاند که سلولهای عصبی در عقدههای قاعدهای به محرکهای حسی پاسخ میدهند و نورون جسم سیاه و جسم مخطط به محرکهای مکانیکی و یا آسیب رسان دو طرفه با میدان گیرندگی بزرگ پاسخ میدهند. علاوه بر این، مطالعات تصویر برداری سیستم عصبی نشان داده اند که گیرندههای D2 دوپامینی جسم مخطط در تعدیل درد نقش بارزی دارند (12). علل افزایش شکایات درد در بیماران پارکینسونی متعدد است و احتمالاً حدود 30 تا 50 درصد آن ها درد را عنوان میکنند علاوه بر آسیب های عصبی، دفورمیتی و آرتروز مفصلی هم باعث بروز دردهای اسکلتی عضلانی میشود که شاخص ترین آنها درد شانه و کمر میباشد (13).
بیماری پارکینسون بهطورکامل درمانشدنی نیست، اما کنترل عوارض آن تا حدود زیادی دستیافتنی است و مانع ناتوانشدن و ازکارافتادگی بیمار میشود. در این راستا ورزش از اهمیت زیادی بر خوردار است و نشان داده شده است که از مشکلات ارتوپدیک مرتبط با علائم اولیه پارکینسون جلوگیری میکند (14). در بین الگوهای ورزشی گوناگون، فعالیت داوطلبانه روی تردمیل، دوی اجباری تردمیل و حرکات عضلانی مقاومتی، رایجترین مدلهای ورزشی هستند. این ورزشها جدا از مزایای بدنی خود، عملکرد شناختی را بهبود میدهند و بازتوانی عصبی را بعد از وقوع آسیب مغزی آسانتر میکنند (10). در زمینه تأثیر تمرین ورزشی بر فعالیتهای آنزیمهای اکسایشی و ضداکسایشی اطلاعات ضدونقیضی وجود دارد، اما بهنظر میرسد ورزش با ایجاد تعادل وضعیت اکسیداسیون و احیا در بهبود عملکرد مغزی نقش دارد؛ بهطوریکه مقاومت علیه استرس اکسایشی را افزایش میدهد و بهبود استرس اکسایشی را تسریع میکند (15). تمرین ورزشی زندهماندن سلولهای عصبی را افزایش میدهد و برقراری عملکردهای مغز را بعد از آسیب تسهیل میکند (15)، اما در پژوهشهای انجامشده درمورد بیماران مبتلا به پارکینسون نتایج ضدونقیضی درباره تأثیر تمرینهای ورزشی بر تغییرات سیستم دوپامینرژیک و حفاظت عصبی گزارش شده است. لذا با توجه به افزایش شکایت از درد در بیماران پارکینسونی نسبت به همسالان غیرپارکینسونی خود به نظر می رسد که این پردردی با سیستم دوپامینرژیک مغز هم مربوط باشد، بنابراین از آنجایی که هنوز بهطور کامل تغییرات ساز وکار حس درد در بیماران پارکینسونی شناسایی نشده است، و همچنین با توجه به نقشهای متضاد NO در بیماری پارکینسون، این تحقیق با هدف بررسی تاثیر 6 هفته تمرینات هوازی تداومی و تناوبی بر نیتریک اکساید و حس درد در رتهای مدل پارکینسونی انجام شد.
روش بررسی
تحقیق حاضر از نوع تحقیقات تجربی بود، که در زمستان 1397 انجام شد.در تحقیق حاضر از 24 سر رت نر بالغ 12 هفته ای نژاد ویستار با میانگین وزن 250-300 گرم استفاده شد. نمونه¬های تحقیق از خانه حیوانات دانشگاه شهید چمران اهواز خریداری شدند، رتها در آزمایشگاه جوندگان دانشکده دامپزشکی دانشگاه شهید چمران اهواز به مدت دو هفته به منظور سازگاری با محیط نگهداری شدند. همچنین، کلیۀ گروهها به صورت آزاد به آب و غذا دسترسی داشتند. حیوانات به صورت گروه¬های چهار سرموش در قفس پلی کربنات شفاف در محیطی با دمای 20 تا 22 درجۀسانتیگراد در شرایط 12 ساعت روشنایی و 12 ساعت تاریکی با رطوبت نسبی 55-45 درصد نگهداری شدند. سپس بهمدت یک هفته بهمنظور آشنایی با تردمیل مخصوص جوندگان (5 لاین ساخت کشور ایران) با سرعت 3 متر بر دقیقه و بهمدت 10 دقیقه و 5 روز در هفته به آشنا سازی با تردمیل پرداختند، این حیوانات پس از آشنایی با نحوه فعالیت روی نوارگردان به 4 گروه تقسیم شدند که عبارت هستند از: 1)گروه کنترل سالم 2)گروه کنترل پارکینسون 3) گروه تمرین تداومی+بیماری 4)گروه تمرین تناوبی+ بیماری. همچنین آزمودنی¬ها قبل از گروهبندی با استفاده از ترازوی دیجیتال وزنکشی شدند و سعی شد تا میانگین وزن بین گروههای مختلف (250-300 گرم) تا حد ممکن به هم نزدیک باشد.
روش القای بیماری پارکینسون
بیماری پارکینسون به¬وسیله تزریق رزرپین با دوز 1 میلیگرم به ازای هر کیلوگرم وزن بدن طی دو روز متوالی بهصورت درون صفاقی ایجاد شد. جهت آماده سازی رزرپین به ترتیب ذیل عمل شد، ابتدا مقدار مورد نظر از رزرپین در 0/03 میلیلیتر محلول اسید استیک گلاسیال حل و سپس محلول با استفاده از آب مقطر به حجم رسانده شد و بر اساس وزن به هر موش تزریق شد (16). لازم به ذکر است محلولی که جهت رقیق سازی رزپین استفاده شد به گروههای سالم نیز به صورت درون صفاقی تزریق شد.
روش بررسی القای بیماری
الف) برای تأیید القای پارکینسون در موشها، آزمایشهای زیر انجام گرفت: از آزمون چرخشی با فاصله دو هفته پس از تزریق رزپین استفاده شد. در این آزمون، موش از محدوده 2 سانتیمتری محل اتصال دم با بدن، گرفته شده و به بالا آورده میشود؛ به طوری¬که بینی حیوان 2 سانتیمتر بالای سطح اتّکا قرار گیرد و در صورتی¬که نتواند تعادلش را حفظ کند، و به طرفین چرخش کند نشانه پارکینسونی شدن موش ها تلقی میگردد (17). ب) بررسی تعادل آزمودنی¬ها با استفاده از آزمون تعادلی روتارود و مقایسه گروه¬های سالم و بیمار، برای ارزیابی فعالیت تعادلی توسط این دستگاه، ابتدا به هر حیوان دوبار فرصت برای عادت کردن و تطابق با دستگاه داده شد، حیوان روی میله افقی چرخنده که سرعت حرکت آن متغیر است به قطر 3 سانتیمتر با سرعت اولیه 5 دور در دقیقه قرار گرفت و سپس سرعت چرخش میله در طی مدت 300 ثانیه (5 دقیقه) به تدریج تا 25 دور در دقیقه افزایش یافت ملاک اصلی برای تعادل در همه گروه¬ها سرعت 25 دور در دقیقه بود. زمان حفظ تعادل و باقی¬ماندن روی میله، برای هر حیوان ثبت شد. مدت زمانی را که حیوان بتواند تعادل خود را حفظ و در مقابل حرکت گردونه مقاومت کند، به¬عنوان زمان مقاومت حیوان ثبت شد. حداکثر زمان مورد بررسی برای هر حیوان در این آزمون 300 ثانیه در نظر گرفته می¬شود. این آزمایش سه بار تکرار شد و فاصله بین تکرارها 30 دقیقه بود و میانگین آنها گرفته شد (18).
روش بررسی حس درد
با بکارگیری مدل تست فرمالین (تزریق ۶۰ میکرولیتر محلول فرمالین2/5% به زیر پوست کف پای راست حیوان)، پاسخ به درد در گروه ها بهمدت ۶۰ دقیقه مورد بررسی قرار گرفت. نحوه نمره دهی به رفتار درد بدین صورت بود که: (۰- نگه داشتن وزن بهطور مساوی روی دو پا، ۱۔ لنگش هنگام راه رفتن یا گذاشتن ناخن به کف، ۲- بالا نگه داشتن پنجه تزریق شده و ۳- گاز گرفتن یا لیسیدن پنجه تزریق شده (19). مشاهده رفتار درد هر۱۵ ثانیه و در کل بهمدت یک ساعت پس از تزریق فرمالین انجام و اطلاعات بهدست آمده برای هر موش بهطور میانگین محاسبه شد.
برنامه تمرین تداومی
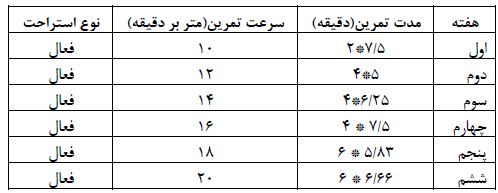
(جدول 1) برنامه تمرین تداومی به مدت 6 هفته و هر هفته 5 جلسه (تمام روز های هفته بجز سه شنبه و جمعه) انجام شد، برنامه تمرین هوازی تداومی به این صورت بود که سرعت برنامه تمرینی در هفته های اول از 10 متر در دقیقه آغاز شد. از هفته دوم تا ششم، سرعت تمرین هفته ای 2 متر در دقیقه افزایش یافت به گونه ای که در هفته آخر به 20 متر در دقیقه رسید. مدت تمرین در گروه تداومی از هفته اول تا ششم، روزانه طوری افزایش یافت که در آن مدت فعالیت از 15 دقیقه در روز اول به 40 دقیقه در هفته ششم رسید (20). برنامه تمرین تناوبی (جدول2): برنامه تمرین تناوبی با شدت متوسط نیز به مدت 6 هفته و هر هفته 5 جلسه انجام شد برنامه تمرین هوازی تناوبی به این صورت بود که سرعت برنامه تمرینی در هفتههای اول از 10 متر در دقیقه آغاز شد. از هفته دوم تا ششم، سرعت تمرین هفته ای 2 متر در دقیقه افزایش یافت به گونهای که در هفته آخر به 20 متر در دقیقه رسید. مدت تمرین در گروه تناوبی از هفته اول تا ششم، روزانه طوری افزایش یافت که در آن مدت فعالیت از 15 دقیقه در روز اول به 40 دقیقه در هفته ششم رسید. گروه تمرین تناوبی مدت زمان مشخص شده تمرین را در هفته نخست در دو نوبت در هفتههای دوم تا چهارم در چهار نوبت و در هفتههای پنجم تا ششم در شش نوبت اجرا کردند (20). فواصل استراحتی بین نوبتهای تمرینی به صورت یک به یک چهارم (برای مثال هر 4 دقیقه تمرین 1 دقیقه استراحت فعال) بهصورت دویدن فعال و با سرعت 3 متر بر دقیقه در نظرگرفته شد. هر دو گروه تمرینی در ابتدای هر جلسه تمرینی به مدت 3 دقیقه با سرعت 1 متر در دقیقه بهمنظور گرم کردن، دویدند و سپس برای رسیدن به سرعت مورد نظر به ازای هر دقیقه، 2 متر در دقیقه به سرعت نوار گردان افزوده شد، و در پایان تمرین نیز مدت 3 دقیقه با سرعت 1 متر در دقیقه به منظور سرد کردن، دویدند.
روش بافتبرداری
ابتدا، موش ها با ترکیب کتامین و زایلازین به ترتیب با دوز 100 و 10 میلیگرم در هر کیلوگرم بیهوش شدند. سپس، با جدا کردن کل مغز و خارج کردن آن از کاسۀ جمجمه، هیپوکمپ مغز از سایر قسمتهای مختلف مغز جدا شد و بلافاصله در یخچال مخصوص در دمای 70 – درجه نگهداری شد. همچنین، بافت با استفاده از بافر ریپا (RIPA) هموژن شد، برای هموژن کردن بافت، چهار الی پنج برابر وزن نمونه ها بافر لیز کننده ریخته شد و با هموژنایزر دور 3000 به مدت چهار زمان30 ثانیهای با فاصله زمانی 5 دقیقه همگون شدند. سپس بافت هموژن شده به مدت 10 دقیقه در دمای 4+ درجه سانتیگراد و در دور 15000 سانتریفیوژ گردید. مایع بالایی حاصل از سانتریفیوژ به یک تیوب جدید منتقل و سپس تا زمان انجام کار در فریزر 20- نگهداری گردید. پس از هموژنایز و سانتریفیوژ، نمونه ها به روش الایزا و با دستگاه دستگاه الایزاریدر اسپکتروفتومتر اندازه گیری شدند، که نیتریک اکساید با استفاده از کیت اندازه گیری شرکت زلبایو ساخت کشور آلمان (با شماره سریال (ZB-A819128) و با حساسیت (5.01 ng/L) اندازهگیری شد.
تجزیه و تحلیل آماری
برای محاسبه و تجزیه و تحلیل آماری اطلاعات خام از نرمافزارversion 22 SPSS و برای ترسیم نمودار از نرمافزار Excel استفاده شد. هم چنین سطح معنیداری برای تمام روشهای آماری در سطح احتمال (0/05> P) برای تعیین توزیع طبیعی دادهها از آزمون شایپیرو-ویلک در سطح معنیداری (p≤ 0/05) استفاده شد. همچنین برای تجزیه و تحلیل آماری از روش تحلیل واریانس یک راهه و آزمونها تعقیبی LSD استفاده شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شهید چمران اهواز تایید شده است (کد اخلاق EE/97.24.3.70013/scu.ac.ir )
نتایج
نتایج آزمون تحلیل واریانس یک راهه نشان داد در متغیر NO بین گروههای پژوهش اختلاف معنیداری وجود دارد (p ≤0/02)، (F=3/27)، (df=5). نتایج آزمون تعقیبی LSD نشان داد (جدول3) گروه کنترل پارکینسون افزایش معنیداری نسبت به گروه کنترل سالم (p ≤0/002)، تمرین تداومی + بیماری (p ≤0/046)، و تمرین تناوبی + بیماری (p ≤0/02)نشان داد. که نشان داده شد دو نوع تمرین انجام شده باعث کاهش معنیداری در این متغیر میشود. همچنین نشان داده شد بین دو گروه تمرینی اختلاف معنیداری وجود ندارد (p ≤0/68).
نتایج آزمون تحلیل واریانس یک راهه نشان داد در متغیر درد بین گروه های پژوهش اختلاف معنیداری وجود دارد (p ≤0/01)، (F=27/12)،(df=3). نتایج آزمون تعقیبی LSD نشان داد (جدول4) گروه کنترل پارکینسون افزایش درد معنیداری نسبت به گروه کنترل سالم (p ≤0/001)دارد. همچنین نشان داده شد دو نوع تمرین تداومی، و تمرین تناوبی باعث کاهش میزان احساس درد میشود (p ≤0/001)، که نشان داده شد بین دو گروه تمرینی اختلاف معنیداری وجود ندارد(p ≤0/23)
جدول1: برنامه تمرین تداومی گروه های پژوهش
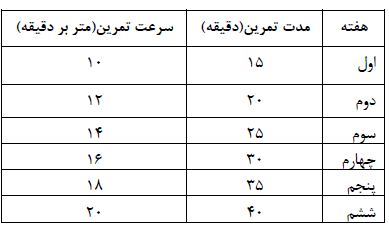
جدول2: برنامه تمرین تناوبی گروه های پژوهش
جدول 3: نتایج آزمون تعقیبی LSD برای متغیر NO
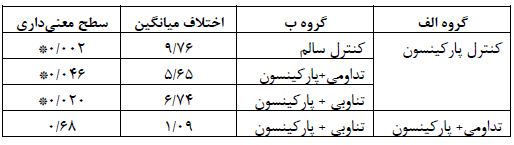
* سطح معنیداری 0/05≥p
جدول4: نتایج آزمون تعقیبی LSD برای متغیر درد
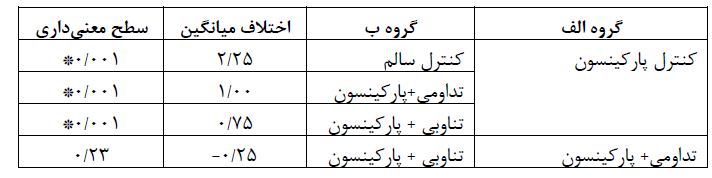
* سطح معنیداری 0/05≥p
بحث
بهطور کلی مهمترین نتیجه این تحقیق نشان داد که بیماری پارکینسون باعث افزایش سطوح نیتریک اکساید در گروههای مبتلا به بیماری میشود، که نشان داده شد تمرینات ورزشی سطوح نیتریک اکساید را بهطور معنیداری کاهش داد. همچنین نشان داده شد بین دو نوع تمرین تداومی و تناوبی تفاوت معنیداری در بهبود نیتریک اکساید وجود ندارد. استرس اکسیداتیو سبب القای آسیب اکسیداتیو در هیپوکمپ و سلولهای هرمی میگردد. از طرفی، سلول های فعال مغزی در ریسک مشخصی از خطر آسیب دیدگی توسط رادیکال های آزاد قرار دارند چرا که سلول های مغزی مصرف اکسیژن بالایی دارند و غشاهای نورونی سیستم اعصاب مرکزی غنی از پلیمر های اسید چرب غیر اشباع میباشد که هدفهای بالقوه ای برای پراکسیداسیون لیپیدی میباشد. تجمع محصولات نهایی پراکسیداسیون لیپیدی نیز می تواند در نقایص شناختی دخیل باشند (21) مطالعه چندین بیماری پیشنهاد میکند که نیتریک اکساید ممکن است در انواع بیماری های انحطاط عصبی و التهاب درگیر شود. افزایش غلظتی از نیتریک اکساید در سیستم عصبی مرکزی معمولاً منجر به افزایش در ایزوفرمهایی از نیتریک اکساید سنتاز القایی (که معمولاً توسط التهاب سلولی تولید می گردد) میشود (22). سطوح بیش از حد NO در مغز با آسیب بافتی ناشی از ایسکمی مغزی و سایر فرآیندهای تحلیل عصبی مرتبط است (23). از آنجا که NO هم در اعصاب مرکزی و هم در اعصاب محیطی از طریق تغییر شکل آرژنین به سیترولین توسط NOS تولید میشود، روشی که سرکوب کننده تولید محصولات NO از طریق مهار nNOS باشد، میتواند به عنوان درمانی امیدوار کننده برای برخی از انواع بیماریهای عصبی مورد استفاده قرار گیرد (24) بنابراین، فعالیت ورزشی منظم به عنوان یک روش شناخته شده جهت جلوگیری از بیماریهای نورودژنراتیو وابسته به سن نشان داده شده است. درواقع، تمرینهای ورزشی بسته به شدت، مدت و نوع تمرین ورزشی و تأثیر آن بر شاخصهای فشار اکسایشی و نروتروفینی متفاوت میباشند دراینراستا باید این نکته را درنظر گرفت که در هنگام ورزش شدید، مصرف اکسیژن در بدن حدود هشت تا 10 برابر افزایش مییابد؛ بههمیندلیل، با افزایش تولید رادیکالهای آزاد اکسیژن بهعلت افزایش مصرف اکسیژن ممکن است ظرفیت دفاع آنتیاکسیدانی بدن تضعیف شود؛ بنابراین، ورزش حاد و شدید موجب افزایش استرس اکسیداتیو میشود، اما ورزش منظم و متوسط ازطریق افزایش دفاع آنتیاکسیدانی موجب کاهش استرس اکسیداتیو خواهد شد بنابراین در این تحقیق جهت استفاده از استراحت های بین تمرینات تناوبی جهت جلوگیری از افزایش بیش از حد اکسیژن و در پی آن افزایش احتمالی رادیکال های آزاد اکسیژن و مقایسه با تمرینات تداومی از این دو روش تمرین هوازی با شدت متوسط استفاده شد. شواهدی وجود دارد دال بر اینکه ورزش فیزیکی منظم اثرات مفید بر مغز داشته، از جمله حفاظت نورونی و بهبود حافظه فضایی در حیوانات آزمایشگاهی (25). نتایج تحقیق حاضر با نتایج تحقیق الجراح و همکاران (2013) همسو میباشد این محققین در تحقیق خود نشان دادند تمرینات استقامتی باعث تنظیم مجدد سطوح نیتریک اکساید در بیماران پارکینسونی میشود (7). همچنین تحقیقات دیگری از جمله هوشمندی و همکاران (1394)، زاروس و همکاران (2009) نشان دادند (27،26) تمرینات ورزشی هوازی باعث کاهش سطوح نیتریک اکساید افراد میشود. مکانیسم دقیق کاهش NO از طریق فعالیت بدنی مشخص نیست اما در توجیه این کاهش دو دلیل را میتوان بیان کرد. دلیل اول: در برخی از بررسیها، اختلال تنظیم سایتوکین ها در بیماران نورودژنراتیو گزارش شده است. این اختلال موجب افزایش سایتوکینهای پیشالتهابی و در مقابل کاهش سایتوکینهای ضدالتهابی میشود (28) با توجه به نقشی که سایتوکینهای پیشالتهابی در افزایش NO دارند (29) و همچنین با نظر به این نکته که ورزش دارای اثرات ضد التهابی میباشد (30) و میتواند اثرات ضدالتهابی خود را از طریق کاهش سایتوکین های پیشالتهابی از جمله 17-6-18-IL (interleukin)، (Tumornecrosis factor )TNF-α، IL-1β و IFN-γ (28) و افزایش سایتوکینهای ضدالتهابی از جمله 10-IL و 4-IL اعمال کند، بنابراین این احتمال وجود دارد که فعالیت ورزشی از طریق کاهش سایتوکینهای پیشالتهابی و افزایش سایتوکینهای ضدالتهابی موجب کاهش NO شده باشد. دلیل دوم: در بیماران نورودژنراتیو به دلیل اختلال در سیستم دفاع آنتیاکسیدانی تولید رادیکالهای آزاد از جمله NO افزایش مییابد (31) سیستم دفاع آنتیاکسیدانی، ترکیبات اکسایشی را قبل از آسیب به مولکولهای مختلف خنثی میکند. در این بیماران فعالیت آنزیمهای آنتیاکسیدانی کاهش مییابد. تضعیف سیستم دفاع آنتی اکسیدانی در سیستم عصبی مرکزی بیماران ممکن است آنها را نسبت به اثرات رادیکالهای آزاد آسیب پذیر کند (32). کمبود دو آنتیاکسیدان اسید اوریک و ویتامین E در بیماران نورودژنراتیو مشاهده شده است (30). اسیداوریک سدی در برابر استرس اکسیداتیو است، بنابراین تحقیقات بیشتر درباره ی NO، سایر رادیکالهای آزاد و آنتیاکسیدانها در آینده ضرورت دارد. اگرچه گزارش شده است که درد یکی از نگرانکنندهترین علائم در افراد مبتلا به پارکینسون است، اما شناخت و مدیریت درد در اقدامات بالینی توجه کمی را نشان میدهد (33) این ممکن است بهدلیل ماهیت پیچیده درد و نوروفیزیولوژی ضعیف آن و همچنین کمبود آزمایشات ارزیابی مداخلات احتمالی برای مدیریت درد در پارکینسون باشد. در نتیجه، درمان و مدیریت فعلی درد در مبتلایان به پارکینسون عمدتاً مبتنی بر نظر متخصص و تجربه بالینی است. داروها ، از جمله عوامل دوپامینرژیک و مسکنهای معمولی، ممکن است به کاهش درد کمک کنند. علاوه بر این ، ورزش اغلب به عنوان یکی از مؤلفههای یک برنامه کنترل درد توصیه میشود (34). لذا تحقیق حاضر به بررسی دو روش تمرینی هوازی بر درد القا شده با فرمالین پرداخته است که نتایج تحقیق حاضر نشان داد القای بیماری پارکینسون باعث افزایش احساس درد در آزمودنیها میشود که نشان داده شد انجام 6 هفته تمرینات تداومی و تناوبی باعث کاهش این احساس درد در بین گروههای تجربی مورد مطالعه میشود. درد علامت غیر حرکتی است که در 85٪ از بیماران مبتلا به بیماری پارکینسون وجود دارد، اما اغلب درمان نمیشود (35). این درد به احتمال زیاد تحت تأثیر بسیاری از عوامل، از جمله روند بیماری، اختلالات پارکینسون و همچنین شرایط درد عضلانی اسکلتی و یا نوروپاتیک است (36). ورزش بهعنوان یکی از مؤلفههای برنامههای مدیریت درد در نظر گرفته میشود. با این حال، تأثیر ورزش بر درد در این بیماران بهطور دقیق مشخص نیست. شواهد در حال ظهور نشان میدهد که ورزش ممکن است باعث تقویت نوروپلاستیسیته شود (یعنی تشکیل مجدد آناتومیک، فیزیولوژیک و عملکرد مجدد مغز) در پاسخ به تغییر
در محیط یا رفتار (37)، و ترمیم عصبی (یعنی بازسازی بافت عصبی آسیب دیده) (38). شواهدی از مطالعات حیوانی وجود دارد که ورزش میتواند با افزایش عوامل عصبی مغزی، استحکام سیناپسی و آنژیوژنز و همچنین تحریک نوروژنز و بهبود متابولیسم و پاسخ ایمنی باعث تقویت عصبی و ترمیم عصبی شود (35). جالب است که توی و همکاران (2014) در یک مدل جوندگان پارکینسونی نشان دادند، دویدن تردمیل منجر به واژگونی این ریزش ستون فقرات دندریتیک میشود (39). بنابراین، تغییرات دندریتیک ناشی از ورزش یافت شده در مدل جوندگان پارکینسون شواهد اولیه را ارائه میدهد که ورزش میتواند از طریق مکانیسمهای نوروپلاستیک بر درد در افراد مبتلا به PD تأثیر بگذارد (40). آلن و همکاران (2015) در مطالعهای شرح میدهد که تأثیر بالقوه ورزش بر روی فرآیندهای پاتوفیزیولوژیک مربوط به درد موجود در پارکینسون است. شواهد جدید از مطالعات حیوانی و انسانی نشان میدهد که ورزش با افزایش عوامل عصبی مغزی، استحکام سیناپسی و رگزایی و همچنین تحریک نوروژنز و بهبود متابولیسم و پاسخ ایمنی میتواند به سلول های عصبی و ترمیم عصب کمک کند (41). این تغییرات ممکن است در بهبود پردازش مرکزی درد مفید باشد. همچنین شواهدی وجود دارد که ورزش میتواند هر دو مسیر مهار کننده درد دوپامینرژیک و غیر دوپامینرژیک را فعال کند، که نشان میدهد که ورزش ممکن است به تعدیل حس درد در پارکینسون کمک کند. در حالی که داده های بالینی در مورد اثرات ورزش برای تسکین درد در مبتلایان به پارکینسون کم است، به طور محدود دستورالعملهای اولیه برای تجویز ورزش برای مدیریت درد در پارکینسون ارائه شده است و لذا از آنجا که درد در مبتلایان به پارکینسون با اختلال در خواب، افسردگی و کاهش کیفیت زندگی همراه است (42)، انجام تحقیقات بیشتر برای بهبود و درمان این عارضه احساس میشود. به طور کلی در مورد تفاوتهای دو مدل تمرینی نتایج این تحقیق نشان داد در دو متغیر بررسی شده در این تحقیق بین دو مدل تمرینی تفاوت معنیداری وجود ندارد این عدم تفاوت میتواند به علت استفاده از شدت یکسان در دو نوع تمرینات باشد.
نتیجهگیری
بهطور خلاصه نتایج پژوهش حاضر نشان میدهد که القای بیماری پارکینسون باعث افزایش سطوح نیتریک اکساید و حس درد در بیماران پارکینسونی میشود که نتایج تحقیق حاضر نشان داد انجام تمرینات هوازی تداومی و تناوبی باعث کاهش سطوح نیتریک اکساید و حس درد میشود که بین دو روش تمرین تداومی و تناوبی اختلاف معنیداری مشاهده نشد.
سپاسگزاری
بدین وسیله از تمامی همکاریهای دانشکده تربیت بدنی و دانشکده دامپزشکی دانشگاه شهید چمران اهواز که ما را در انجام این پژوهش یاری نمودند کمال تشکر و قدر دانی را دارم، این مطالعه حاصل پایاننامه کارشناسیارشد، مصوب دانشگاه شهید چمران اهواز با کد 9742611 می باشد.
حامی مالی: اداره ورزش و جوانان استان خوزستان.
تعارض در منافع: وجود ندارد.
بیماری پارکینسون (Parkinson) یک بیماری پیشرونده عصبی است که پیشبینی میشود تا سال 2030 حدود 9 میلیون نفر در سراسر جهان را مبتلا کند (1). پارکینسون یک بیماری سیستم عصبی است که در اثر از بین رفتن نورونهای دوپامینرژیک در مادۀ سیاه ایجاد شده و دارای علائمی همچون رعشه در زمان استراحت، علایم روانی و اختلالات وضعیتی و حرکتی میباشد (2). با ایجاد اختلال در بخش هایی از مغز، اجسام لویی شروع به تجمع در محل از بین رفتن نورونهای دوپامینرژیک (Dopaminergic) میکنند (3).
استرس اکسیداتیو (Oxidative stress) عامل اصلی دژنراسیون در تعدادی از بیماریهای نورودژنراتیو مانند: پارکینسون، آلزایمر و مالتیپلاسکلروزیس میباشد (4). استرس اکسیداتیو ناشی از یک عدم تعادل بین تولید گونههای باز فعال اکسیژن (ROS) و توانایی سیستم زیستی برای سمزدایی این واسطههای فعال میباشد. استرس اکسیداتیو سبب القای آسیب اکسیداتیو در هیپوکمپ و آسیب سلول های هرمی میشود (4). هیپوکمپ بالغین یک مرکز حیاتی برای فرآیندهای یادگیری و حافظه میباشد که به شدت نسبت به بیماریهای نورولوژیک نظیر پارکینسون آسیبپذیر میباشد. استرس اکسایشی یکی از گذرگاههای مهمی است که منجر به مرگ سلولی نورونی القاء شده توسط نیتریک اکساید (NO) میگردد. نیتریک اکسید رادیکالی آزاد با پیچیدگی بیوشیمیایی قابلتوجه است که درگیریاش در پارکینسون به اثبات رسیده است با این حال میزان مشارکت NO در پارکینسون هنوز مشخص نشده است (5). این وضعیت بخشی به علت نقشهای مخالفی است که NO به مدت طولانی به عنوان عامل اصلی التهاب شدید در CNS در نظر گرفته میشد اما یافتهها نشان دادند که NO از یک طرف عمل پیشالتهابی دارد و از طرفی دیگر به کنترل فرایند های پاسخ ایمنی کمک می کند و نقش ضد التهابی دارد، NO می تواند بهعنوان فعال کننده مرگ سلولی یا بازدارنده مرگ سلولی عمل کند که این وضعیت وابسته به محیط بیولوژیکی یعنی حضور یا عدم حضور سیگنالهای بازدارنده یا تحریکی است (5). نیتریک اکساید بهعنوان یک گونۀ فعال نیتروژن است این رادیکال آزاد گازی، یک پیامبر بیولوژیک با قدرت انتشار بالاست که نقش مهمی در فیزیولوژی سیستم عصبی مرکزی بازی میکند. نیتریک اکساید پس از تولید به سرعت با سوپر اکسید واکنش داده و رادیکالهای قوی پراکسینیتریت و هیدروکسیل را تولید میکند. گونههای واکنشگر اکسیژن و و نیتروژن در مجموع موجب ایجاد استرس اکسیداتیو در سیستم عصبی خواهند شد (6). در این راستا الجراح و همکاران (2013) در مطالعهای نشان دادند که 4 هفته ورزشی استقامتی بر روی تردمیل دارای تأثیر مثبت در بیان NO و iNOS (Inhalational nitric oxide) در جسم مخطط رتهای مدل پارکینسونی است. در این مطالعه NO افزایش قابل توجهی در جسم مخطط موش پارکینسونی در مقایسه با موش سالم نشان داد که تمرین ورزشی میزان NO در بیماران پارکینسونی را نسبت به گروه کنترل کاهش داد (7). همچنین مورای و همکاران ( 2014 ) در مطالعهای تاثیر تمرین ورزشی بر شاخصهای آنتی اکسیدانی و شاخصهای التهابی بیماران پارکینسونی را بررسی کردند. در مطالعهای نشان دادند که ورزش میتواند یک رویکرد کاملاً منطقی برای توسعۀ درمانهای محافظتی و عصبی بیماری پارکینسون باشد. ورزش باعث، تحریک دفاع آنتیاکسیدانی و کاهش التهاب میشود (8). نیتریک اکساید ضمن اینکه به عنوان یک گشاد کننده عروق و نیز یک نوروترانسمیتر میباشد، در غلظت های بالاتر با تشکیل پراکسی نیتریت و نیتروزیل دار کردن پیامبرهای سیگنال سلولی در تنظیم روند التهاب مؤثر است، بنابراین ضمن اینکه نیتریک اکساید دارای نقش فیزیولوژیکی در سیگنال سلولی نورونی است، اما سنتز بیش از حد آن باعث ایجاد بیماریهای نورودژنراتیو می شود (9). همچنین نشان داده شده است درد از عوارضی است که براحتی در بیماری پارکینسون قابل شناسایی بوده و در بعضی از مبتلایان موجب ناتوانی جدی شده و بر کیفیت زندگی اثر منفی میگذارد. البته شکل درد در این بیماران مختلف بوده که بر اساس نوع خود، درمان متفاوتی را هم میطلبد. عمده درمان ها شامل تجویز دارو و یا جراحی است (10). تحقیقات جدید نشان داده که هستههای قاعدهای نه تنها در کنترل حرکتی نقش دارند بلکه در بروز احساسات، یادگیری، تصمیمگیری و نیز پردازش حس درد هم تاثیرگذار هستند (11). شواهد نوروآناتومیک نشان میدهد که اطلاعات درد ممکن است از طریق مسیرهای مختلف به عقدههای قاعدهای برسند. در این راستا مطالعات الکتروفیزیولوژیک نشان دادهاند که سلولهای عصبی در عقدههای قاعدهای به محرکهای حسی پاسخ میدهند و نورون جسم سیاه و جسم مخطط به محرکهای مکانیکی و یا آسیب رسان دو طرفه با میدان گیرندگی بزرگ پاسخ میدهند. علاوه بر این، مطالعات تصویر برداری سیستم عصبی نشان داده اند که گیرندههای D2 دوپامینی جسم مخطط در تعدیل درد نقش بارزی دارند (12). علل افزایش شکایات درد در بیماران پارکینسونی متعدد است و احتمالاً حدود 30 تا 50 درصد آن ها درد را عنوان میکنند علاوه بر آسیب های عصبی، دفورمیتی و آرتروز مفصلی هم باعث بروز دردهای اسکلتی عضلانی میشود که شاخص ترین آنها درد شانه و کمر میباشد (13).
بیماری پارکینسون بهطورکامل درمانشدنی نیست، اما کنترل عوارض آن تا حدود زیادی دستیافتنی است و مانع ناتوانشدن و ازکارافتادگی بیمار میشود. در این راستا ورزش از اهمیت زیادی بر خوردار است و نشان داده شده است که از مشکلات ارتوپدیک مرتبط با علائم اولیه پارکینسون جلوگیری میکند (14). در بین الگوهای ورزشی گوناگون، فعالیت داوطلبانه روی تردمیل، دوی اجباری تردمیل و حرکات عضلانی مقاومتی، رایجترین مدلهای ورزشی هستند. این ورزشها جدا از مزایای بدنی خود، عملکرد شناختی را بهبود میدهند و بازتوانی عصبی را بعد از وقوع آسیب مغزی آسانتر میکنند (10). در زمینه تأثیر تمرین ورزشی بر فعالیتهای آنزیمهای اکسایشی و ضداکسایشی اطلاعات ضدونقیضی وجود دارد، اما بهنظر میرسد ورزش با ایجاد تعادل وضعیت اکسیداسیون و احیا در بهبود عملکرد مغزی نقش دارد؛ بهطوریکه مقاومت علیه استرس اکسایشی را افزایش میدهد و بهبود استرس اکسایشی را تسریع میکند (15). تمرین ورزشی زندهماندن سلولهای عصبی را افزایش میدهد و برقراری عملکردهای مغز را بعد از آسیب تسهیل میکند (15)، اما در پژوهشهای انجامشده درمورد بیماران مبتلا به پارکینسون نتایج ضدونقیضی درباره تأثیر تمرینهای ورزشی بر تغییرات سیستم دوپامینرژیک و حفاظت عصبی گزارش شده است. لذا با توجه به افزایش شکایت از درد در بیماران پارکینسونی نسبت به همسالان غیرپارکینسونی خود به نظر می رسد که این پردردی با سیستم دوپامینرژیک مغز هم مربوط باشد، بنابراین از آنجایی که هنوز بهطور کامل تغییرات ساز وکار حس درد در بیماران پارکینسونی شناسایی نشده است، و همچنین با توجه به نقشهای متضاد NO در بیماری پارکینسون، این تحقیق با هدف بررسی تاثیر 6 هفته تمرینات هوازی تداومی و تناوبی بر نیتریک اکساید و حس درد در رتهای مدل پارکینسونی انجام شد.
روش بررسی
تحقیق حاضر از نوع تحقیقات تجربی بود، که در زمستان 1397 انجام شد.در تحقیق حاضر از 24 سر رت نر بالغ 12 هفته ای نژاد ویستار با میانگین وزن 250-300 گرم استفاده شد. نمونه¬های تحقیق از خانه حیوانات دانشگاه شهید چمران اهواز خریداری شدند، رتها در آزمایشگاه جوندگان دانشکده دامپزشکی دانشگاه شهید چمران اهواز به مدت دو هفته به منظور سازگاری با محیط نگهداری شدند. همچنین، کلیۀ گروهها به صورت آزاد به آب و غذا دسترسی داشتند. حیوانات به صورت گروه¬های چهار سرموش در قفس پلی کربنات شفاف در محیطی با دمای 20 تا 22 درجۀسانتیگراد در شرایط 12 ساعت روشنایی و 12 ساعت تاریکی با رطوبت نسبی 55-45 درصد نگهداری شدند. سپس بهمدت یک هفته بهمنظور آشنایی با تردمیل مخصوص جوندگان (5 لاین ساخت کشور ایران) با سرعت 3 متر بر دقیقه و بهمدت 10 دقیقه و 5 روز در هفته به آشنا سازی با تردمیل پرداختند، این حیوانات پس از آشنایی با نحوه فعالیت روی نوارگردان به 4 گروه تقسیم شدند که عبارت هستند از: 1)گروه کنترل سالم 2)گروه کنترل پارکینسون 3) گروه تمرین تداومی+بیماری 4)گروه تمرین تناوبی+ بیماری. همچنین آزمودنی¬ها قبل از گروهبندی با استفاده از ترازوی دیجیتال وزنکشی شدند و سعی شد تا میانگین وزن بین گروههای مختلف (250-300 گرم) تا حد ممکن به هم نزدیک باشد.
روش القای بیماری پارکینسون
بیماری پارکینسون به¬وسیله تزریق رزرپین با دوز 1 میلیگرم به ازای هر کیلوگرم وزن بدن طی دو روز متوالی بهصورت درون صفاقی ایجاد شد. جهت آماده سازی رزرپین به ترتیب ذیل عمل شد، ابتدا مقدار مورد نظر از رزرپین در 0/03 میلیلیتر محلول اسید استیک گلاسیال حل و سپس محلول با استفاده از آب مقطر به حجم رسانده شد و بر اساس وزن به هر موش تزریق شد (16). لازم به ذکر است محلولی که جهت رقیق سازی رزپین استفاده شد به گروههای سالم نیز به صورت درون صفاقی تزریق شد.
روش بررسی القای بیماری
الف) برای تأیید القای پارکینسون در موشها، آزمایشهای زیر انجام گرفت: از آزمون چرخشی با فاصله دو هفته پس از تزریق رزپین استفاده شد. در این آزمون، موش از محدوده 2 سانتیمتری محل اتصال دم با بدن، گرفته شده و به بالا آورده میشود؛ به طوری¬که بینی حیوان 2 سانتیمتر بالای سطح اتّکا قرار گیرد و در صورتی¬که نتواند تعادلش را حفظ کند، و به طرفین چرخش کند نشانه پارکینسونی شدن موش ها تلقی میگردد (17). ب) بررسی تعادل آزمودنی¬ها با استفاده از آزمون تعادلی روتارود و مقایسه گروه¬های سالم و بیمار، برای ارزیابی فعالیت تعادلی توسط این دستگاه، ابتدا به هر حیوان دوبار فرصت برای عادت کردن و تطابق با دستگاه داده شد، حیوان روی میله افقی چرخنده که سرعت حرکت آن متغیر است به قطر 3 سانتیمتر با سرعت اولیه 5 دور در دقیقه قرار گرفت و سپس سرعت چرخش میله در طی مدت 300 ثانیه (5 دقیقه) به تدریج تا 25 دور در دقیقه افزایش یافت ملاک اصلی برای تعادل در همه گروه¬ها سرعت 25 دور در دقیقه بود. زمان حفظ تعادل و باقی¬ماندن روی میله، برای هر حیوان ثبت شد. مدت زمانی را که حیوان بتواند تعادل خود را حفظ و در مقابل حرکت گردونه مقاومت کند، به¬عنوان زمان مقاومت حیوان ثبت شد. حداکثر زمان مورد بررسی برای هر حیوان در این آزمون 300 ثانیه در نظر گرفته می¬شود. این آزمایش سه بار تکرار شد و فاصله بین تکرارها 30 دقیقه بود و میانگین آنها گرفته شد (18).
روش بررسی حس درد
با بکارگیری مدل تست فرمالین (تزریق ۶۰ میکرولیتر محلول فرمالین2/5% به زیر پوست کف پای راست حیوان)، پاسخ به درد در گروه ها بهمدت ۶۰ دقیقه مورد بررسی قرار گرفت. نحوه نمره دهی به رفتار درد بدین صورت بود که: (۰- نگه داشتن وزن بهطور مساوی روی دو پا، ۱۔ لنگش هنگام راه رفتن یا گذاشتن ناخن به کف، ۲- بالا نگه داشتن پنجه تزریق شده و ۳- گاز گرفتن یا لیسیدن پنجه تزریق شده (19). مشاهده رفتار درد هر۱۵ ثانیه و در کل بهمدت یک ساعت پس از تزریق فرمالین انجام و اطلاعات بهدست آمده برای هر موش بهطور میانگین محاسبه شد.
برنامه تمرین تداومی
(جدول 1) برنامه تمرین تداومی به مدت 6 هفته و هر هفته 5 جلسه (تمام روز های هفته بجز سه شنبه و جمعه) انجام شد، برنامه تمرین هوازی تداومی به این صورت بود که سرعت برنامه تمرینی در هفته های اول از 10 متر در دقیقه آغاز شد. از هفته دوم تا ششم، سرعت تمرین هفته ای 2 متر در دقیقه افزایش یافت به گونه ای که در هفته آخر به 20 متر در دقیقه رسید. مدت تمرین در گروه تداومی از هفته اول تا ششم، روزانه طوری افزایش یافت که در آن مدت فعالیت از 15 دقیقه در روز اول به 40 دقیقه در هفته ششم رسید (20). برنامه تمرین تناوبی (جدول2): برنامه تمرین تناوبی با شدت متوسط نیز به مدت 6 هفته و هر هفته 5 جلسه انجام شد برنامه تمرین هوازی تناوبی به این صورت بود که سرعت برنامه تمرینی در هفتههای اول از 10 متر در دقیقه آغاز شد. از هفته دوم تا ششم، سرعت تمرین هفته ای 2 متر در دقیقه افزایش یافت به گونهای که در هفته آخر به 20 متر در دقیقه رسید. مدت تمرین در گروه تناوبی از هفته اول تا ششم، روزانه طوری افزایش یافت که در آن مدت فعالیت از 15 دقیقه در روز اول به 40 دقیقه در هفته ششم رسید. گروه تمرین تناوبی مدت زمان مشخص شده تمرین را در هفته نخست در دو نوبت در هفتههای دوم تا چهارم در چهار نوبت و در هفتههای پنجم تا ششم در شش نوبت اجرا کردند (20). فواصل استراحتی بین نوبتهای تمرینی به صورت یک به یک چهارم (برای مثال هر 4 دقیقه تمرین 1 دقیقه استراحت فعال) بهصورت دویدن فعال و با سرعت 3 متر بر دقیقه در نظرگرفته شد. هر دو گروه تمرینی در ابتدای هر جلسه تمرینی به مدت 3 دقیقه با سرعت 1 متر در دقیقه بهمنظور گرم کردن، دویدند و سپس برای رسیدن به سرعت مورد نظر به ازای هر دقیقه، 2 متر در دقیقه به سرعت نوار گردان افزوده شد، و در پایان تمرین نیز مدت 3 دقیقه با سرعت 1 متر در دقیقه به منظور سرد کردن، دویدند.
روش بافتبرداری
ابتدا، موش ها با ترکیب کتامین و زایلازین به ترتیب با دوز 100 و 10 میلیگرم در هر کیلوگرم بیهوش شدند. سپس، با جدا کردن کل مغز و خارج کردن آن از کاسۀ جمجمه، هیپوکمپ مغز از سایر قسمتهای مختلف مغز جدا شد و بلافاصله در یخچال مخصوص در دمای 70 – درجه نگهداری شد. همچنین، بافت با استفاده از بافر ریپا (RIPA) هموژن شد، برای هموژن کردن بافت، چهار الی پنج برابر وزن نمونه ها بافر لیز کننده ریخته شد و با هموژنایزر دور 3000 به مدت چهار زمان30 ثانیهای با فاصله زمانی 5 دقیقه همگون شدند. سپس بافت هموژن شده به مدت 10 دقیقه در دمای 4+ درجه سانتیگراد و در دور 15000 سانتریفیوژ گردید. مایع بالایی حاصل از سانتریفیوژ به یک تیوب جدید منتقل و سپس تا زمان انجام کار در فریزر 20- نگهداری گردید. پس از هموژنایز و سانتریفیوژ، نمونه ها به روش الایزا و با دستگاه دستگاه الایزاریدر اسپکتروفتومتر اندازه گیری شدند، که نیتریک اکساید با استفاده از کیت اندازه گیری شرکت زلبایو ساخت کشور آلمان (با شماره سریال (ZB-A819128) و با حساسیت (5.01 ng/L) اندازهگیری شد.
تجزیه و تحلیل آماری
برای محاسبه و تجزیه و تحلیل آماری اطلاعات خام از نرمافزارversion 22 SPSS و برای ترسیم نمودار از نرمافزار Excel استفاده شد. هم چنین سطح معنیداری برای تمام روشهای آماری در سطح احتمال (0/05> P) برای تعیین توزیع طبیعی دادهها از آزمون شایپیرو-ویلک در سطح معنیداری (p≤ 0/05) استفاده شد. همچنین برای تجزیه و تحلیل آماری از روش تحلیل واریانس یک راهه و آزمونها تعقیبی LSD استفاده شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شهید چمران اهواز تایید شده است (کد اخلاق EE/97.24.3.70013/scu.ac.ir )
نتایج
نتایج آزمون تحلیل واریانس یک راهه نشان داد در متغیر NO بین گروههای پژوهش اختلاف معنیداری وجود دارد (p ≤0/02)، (F=3/27)، (df=5). نتایج آزمون تعقیبی LSD نشان داد (جدول3) گروه کنترل پارکینسون افزایش معنیداری نسبت به گروه کنترل سالم (p ≤0/002)، تمرین تداومی + بیماری (p ≤0/046)، و تمرین تناوبی + بیماری (p ≤0/02)نشان داد. که نشان داده شد دو نوع تمرین انجام شده باعث کاهش معنیداری در این متغیر میشود. همچنین نشان داده شد بین دو گروه تمرینی اختلاف معنیداری وجود ندارد (p ≤0/68).
نتایج آزمون تحلیل واریانس یک راهه نشان داد در متغیر درد بین گروه های پژوهش اختلاف معنیداری وجود دارد (p ≤0/01)، (F=27/12)،(df=3). نتایج آزمون تعقیبی LSD نشان داد (جدول4) گروه کنترل پارکینسون افزایش درد معنیداری نسبت به گروه کنترل سالم (p ≤0/001)دارد. همچنین نشان داده شد دو نوع تمرین تداومی، و تمرین تناوبی باعث کاهش میزان احساس درد میشود (p ≤0/001)، که نشان داده شد بین دو گروه تمرینی اختلاف معنیداری وجود ندارد(p ≤0/23)
جدول1: برنامه تمرین تداومی گروه های پژوهش

جدول2: برنامه تمرین تناوبی گروه های پژوهش

جدول 3: نتایج آزمون تعقیبی LSD برای متغیر NO

* سطح معنیداری 0/05≥p
جدول4: نتایج آزمون تعقیبی LSD برای متغیر درد

* سطح معنیداری 0/05≥p
بحث
بهطور کلی مهمترین نتیجه این تحقیق نشان داد که بیماری پارکینسون باعث افزایش سطوح نیتریک اکساید در گروههای مبتلا به بیماری میشود، که نشان داده شد تمرینات ورزشی سطوح نیتریک اکساید را بهطور معنیداری کاهش داد. همچنین نشان داده شد بین دو نوع تمرین تداومی و تناوبی تفاوت معنیداری در بهبود نیتریک اکساید وجود ندارد. استرس اکسیداتیو سبب القای آسیب اکسیداتیو در هیپوکمپ و سلولهای هرمی میگردد. از طرفی، سلول های فعال مغزی در ریسک مشخصی از خطر آسیب دیدگی توسط رادیکال های آزاد قرار دارند چرا که سلول های مغزی مصرف اکسیژن بالایی دارند و غشاهای نورونی سیستم اعصاب مرکزی غنی از پلیمر های اسید چرب غیر اشباع میباشد که هدفهای بالقوه ای برای پراکسیداسیون لیپیدی میباشد. تجمع محصولات نهایی پراکسیداسیون لیپیدی نیز می تواند در نقایص شناختی دخیل باشند (21) مطالعه چندین بیماری پیشنهاد میکند که نیتریک اکساید ممکن است در انواع بیماری های انحطاط عصبی و التهاب درگیر شود. افزایش غلظتی از نیتریک اکساید در سیستم عصبی مرکزی معمولاً منجر به افزایش در ایزوفرمهایی از نیتریک اکساید سنتاز القایی (که معمولاً توسط التهاب سلولی تولید می گردد) میشود (22). سطوح بیش از حد NO در مغز با آسیب بافتی ناشی از ایسکمی مغزی و سایر فرآیندهای تحلیل عصبی مرتبط است (23). از آنجا که NO هم در اعصاب مرکزی و هم در اعصاب محیطی از طریق تغییر شکل آرژنین به سیترولین توسط NOS تولید میشود، روشی که سرکوب کننده تولید محصولات NO از طریق مهار nNOS باشد، میتواند به عنوان درمانی امیدوار کننده برای برخی از انواع بیماریهای عصبی مورد استفاده قرار گیرد (24) بنابراین، فعالیت ورزشی منظم به عنوان یک روش شناخته شده جهت جلوگیری از بیماریهای نورودژنراتیو وابسته به سن نشان داده شده است. درواقع، تمرینهای ورزشی بسته به شدت، مدت و نوع تمرین ورزشی و تأثیر آن بر شاخصهای فشار اکسایشی و نروتروفینی متفاوت میباشند دراینراستا باید این نکته را درنظر گرفت که در هنگام ورزش شدید، مصرف اکسیژن در بدن حدود هشت تا 10 برابر افزایش مییابد؛ بههمیندلیل، با افزایش تولید رادیکالهای آزاد اکسیژن بهعلت افزایش مصرف اکسیژن ممکن است ظرفیت دفاع آنتیاکسیدانی بدن تضعیف شود؛ بنابراین، ورزش حاد و شدید موجب افزایش استرس اکسیداتیو میشود، اما ورزش منظم و متوسط ازطریق افزایش دفاع آنتیاکسیدانی موجب کاهش استرس اکسیداتیو خواهد شد بنابراین در این تحقیق جهت استفاده از استراحت های بین تمرینات تناوبی جهت جلوگیری از افزایش بیش از حد اکسیژن و در پی آن افزایش احتمالی رادیکال های آزاد اکسیژن و مقایسه با تمرینات تداومی از این دو روش تمرین هوازی با شدت متوسط استفاده شد. شواهدی وجود دارد دال بر اینکه ورزش فیزیکی منظم اثرات مفید بر مغز داشته، از جمله حفاظت نورونی و بهبود حافظه فضایی در حیوانات آزمایشگاهی (25). نتایج تحقیق حاضر با نتایج تحقیق الجراح و همکاران (2013) همسو میباشد این محققین در تحقیق خود نشان دادند تمرینات استقامتی باعث تنظیم مجدد سطوح نیتریک اکساید در بیماران پارکینسونی میشود (7). همچنین تحقیقات دیگری از جمله هوشمندی و همکاران (1394)، زاروس و همکاران (2009) نشان دادند (27،26) تمرینات ورزشی هوازی باعث کاهش سطوح نیتریک اکساید افراد میشود. مکانیسم دقیق کاهش NO از طریق فعالیت بدنی مشخص نیست اما در توجیه این کاهش دو دلیل را میتوان بیان کرد. دلیل اول: در برخی از بررسیها، اختلال تنظیم سایتوکین ها در بیماران نورودژنراتیو گزارش شده است. این اختلال موجب افزایش سایتوکینهای پیشالتهابی و در مقابل کاهش سایتوکینهای ضدالتهابی میشود (28) با توجه به نقشی که سایتوکینهای پیشالتهابی در افزایش NO دارند (29) و همچنین با نظر به این نکته که ورزش دارای اثرات ضد التهابی میباشد (30) و میتواند اثرات ضدالتهابی خود را از طریق کاهش سایتوکین های پیشالتهابی از جمله 17-6-18-IL (interleukin)، (Tumornecrosis factor )TNF-α، IL-1β و IFN-γ (28) و افزایش سایتوکینهای ضدالتهابی از جمله 10-IL و 4-IL اعمال کند، بنابراین این احتمال وجود دارد که فعالیت ورزشی از طریق کاهش سایتوکینهای پیشالتهابی و افزایش سایتوکینهای ضدالتهابی موجب کاهش NO شده باشد. دلیل دوم: در بیماران نورودژنراتیو به دلیل اختلال در سیستم دفاع آنتیاکسیدانی تولید رادیکالهای آزاد از جمله NO افزایش مییابد (31) سیستم دفاع آنتیاکسیدانی، ترکیبات اکسایشی را قبل از آسیب به مولکولهای مختلف خنثی میکند. در این بیماران فعالیت آنزیمهای آنتیاکسیدانی کاهش مییابد. تضعیف سیستم دفاع آنتی اکسیدانی در سیستم عصبی مرکزی بیماران ممکن است آنها را نسبت به اثرات رادیکالهای آزاد آسیب پذیر کند (32). کمبود دو آنتیاکسیدان اسید اوریک و ویتامین E در بیماران نورودژنراتیو مشاهده شده است (30). اسیداوریک سدی در برابر استرس اکسیداتیو است، بنابراین تحقیقات بیشتر درباره ی NO، سایر رادیکالهای آزاد و آنتیاکسیدانها در آینده ضرورت دارد. اگرچه گزارش شده است که درد یکی از نگرانکنندهترین علائم در افراد مبتلا به پارکینسون است، اما شناخت و مدیریت درد در اقدامات بالینی توجه کمی را نشان میدهد (33) این ممکن است بهدلیل ماهیت پیچیده درد و نوروفیزیولوژی ضعیف آن و همچنین کمبود آزمایشات ارزیابی مداخلات احتمالی برای مدیریت درد در پارکینسون باشد. در نتیجه، درمان و مدیریت فعلی درد در مبتلایان به پارکینسون عمدتاً مبتنی بر نظر متخصص و تجربه بالینی است. داروها ، از جمله عوامل دوپامینرژیک و مسکنهای معمولی، ممکن است به کاهش درد کمک کنند. علاوه بر این ، ورزش اغلب به عنوان یکی از مؤلفههای یک برنامه کنترل درد توصیه میشود (34). لذا تحقیق حاضر به بررسی دو روش تمرینی هوازی بر درد القا شده با فرمالین پرداخته است که نتایج تحقیق حاضر نشان داد القای بیماری پارکینسون باعث افزایش احساس درد در آزمودنیها میشود که نشان داده شد انجام 6 هفته تمرینات تداومی و تناوبی باعث کاهش این احساس درد در بین گروههای تجربی مورد مطالعه میشود. درد علامت غیر حرکتی است که در 85٪ از بیماران مبتلا به بیماری پارکینسون وجود دارد، اما اغلب درمان نمیشود (35). این درد به احتمال زیاد تحت تأثیر بسیاری از عوامل، از جمله روند بیماری، اختلالات پارکینسون و همچنین شرایط درد عضلانی اسکلتی و یا نوروپاتیک است (36). ورزش بهعنوان یکی از مؤلفههای برنامههای مدیریت درد در نظر گرفته میشود. با این حال، تأثیر ورزش بر درد در این بیماران بهطور دقیق مشخص نیست. شواهد در حال ظهور نشان میدهد که ورزش ممکن است باعث تقویت نوروپلاستیسیته شود (یعنی تشکیل مجدد آناتومیک، فیزیولوژیک و عملکرد مجدد مغز) در پاسخ به تغییر
در محیط یا رفتار (37)، و ترمیم عصبی (یعنی بازسازی بافت عصبی آسیب دیده) (38). شواهدی از مطالعات حیوانی وجود دارد که ورزش میتواند با افزایش عوامل عصبی مغزی، استحکام سیناپسی و آنژیوژنز و همچنین تحریک نوروژنز و بهبود متابولیسم و پاسخ ایمنی باعث تقویت عصبی و ترمیم عصبی شود (35). جالب است که توی و همکاران (2014) در یک مدل جوندگان پارکینسونی نشان دادند، دویدن تردمیل منجر به واژگونی این ریزش ستون فقرات دندریتیک میشود (39). بنابراین، تغییرات دندریتیک ناشی از ورزش یافت شده در مدل جوندگان پارکینسون شواهد اولیه را ارائه میدهد که ورزش میتواند از طریق مکانیسمهای نوروپلاستیک بر درد در افراد مبتلا به PD تأثیر بگذارد (40). آلن و همکاران (2015) در مطالعهای شرح میدهد که تأثیر بالقوه ورزش بر روی فرآیندهای پاتوفیزیولوژیک مربوط به درد موجود در پارکینسون است. شواهد جدید از مطالعات حیوانی و انسانی نشان میدهد که ورزش با افزایش عوامل عصبی مغزی، استحکام سیناپسی و رگزایی و همچنین تحریک نوروژنز و بهبود متابولیسم و پاسخ ایمنی میتواند به سلول های عصبی و ترمیم عصب کمک کند (41). این تغییرات ممکن است در بهبود پردازش مرکزی درد مفید باشد. همچنین شواهدی وجود دارد که ورزش میتواند هر دو مسیر مهار کننده درد دوپامینرژیک و غیر دوپامینرژیک را فعال کند، که نشان میدهد که ورزش ممکن است به تعدیل حس درد در پارکینسون کمک کند. در حالی که داده های بالینی در مورد اثرات ورزش برای تسکین درد در مبتلایان به پارکینسون کم است، به طور محدود دستورالعملهای اولیه برای تجویز ورزش برای مدیریت درد در پارکینسون ارائه شده است و لذا از آنجا که درد در مبتلایان به پارکینسون با اختلال در خواب، افسردگی و کاهش کیفیت زندگی همراه است (42)، انجام تحقیقات بیشتر برای بهبود و درمان این عارضه احساس میشود. به طور کلی در مورد تفاوتهای دو مدل تمرینی نتایج این تحقیق نشان داد در دو متغیر بررسی شده در این تحقیق بین دو مدل تمرینی تفاوت معنیداری وجود ندارد این عدم تفاوت میتواند به علت استفاده از شدت یکسان در دو نوع تمرینات باشد.
نتیجهگیری
بهطور خلاصه نتایج پژوهش حاضر نشان میدهد که القای بیماری پارکینسون باعث افزایش سطوح نیتریک اکساید و حس درد در بیماران پارکینسونی میشود که نتایج تحقیق حاضر نشان داد انجام تمرینات هوازی تداومی و تناوبی باعث کاهش سطوح نیتریک اکساید و حس درد میشود که بین دو روش تمرین تداومی و تناوبی اختلاف معنیداری مشاهده نشد.
سپاسگزاری
بدین وسیله از تمامی همکاریهای دانشکده تربیت بدنی و دانشکده دامپزشکی دانشگاه شهید چمران اهواز که ما را در انجام این پژوهش یاری نمودند کمال تشکر و قدر دانی را دارم، این مطالعه حاصل پایاننامه کارشناسیارشد، مصوب دانشگاه شهید چمران اهواز با کد 9742611 می باشد.
حامی مالی: اداره ورزش و جوانان استان خوزستان.
تعارض در منافع: وجود ندارد.
References:
1-Dorsey ER, Constantinescu R, Thompson JP, Biglan KM, Holloway RG, Kieburtz K, et al. Tanner CM 2007 Projected Number of People with Parkinson Disease in the Most Populous Nations,Through 2030.Neurology 2005; 68(5): 384-6.
2-Braak H, Del Tredici K, Braak H, Del Tredici K. Cortico-Basal Ganglia-Cortical Circuitry in Parkinson’s Disease Reconsidered. Experim Neurology 2008; 212: 226-29.
3-Ahlskog JE. Does Vigorous Exercise have a Neuroprotective Effect in Parkinson Disease? Neurology 2011; 77(3): 288-94.
4-Fayyaz M, Jaffery SS, Anwer F, Zil-E-Ali A, Anjum I. The Effect of Physical Activity in Parkinson's disease: A Mini-Review. Cureus 2018; 10(7): e2995.
5-Manuel Encinas J, Manganas L. Enikolopov G. Nitric Oxide and Multiple Sclerosis. Current Neurology and Neuroscience Reports 2005; 5: 232-8.
6-Brenner TS, Brocke F, Szafer RA, SobelJF, Parkinson JH, Perez DH, Steinman L. Inhibition of Nitric Oxide Synthase for Treatment of Xperimental Autoimmune Encephalomyelitis. J Immunol 1997; 158(6): 294.
7-Al-Jarrah M, Obaidat H, Bataineh Z, Walton L, Al-Khateeb A. Endurance Exercise Training Protects against the Upregulation of Nitric Oxide in the Striatum of MPTP/Probenecid Mouse Model of Parkinson's disease Neurorehabilitation 2013; 32(1): 141-47.
8-Murray DK, Sacheli MA, Eng JJ, Stoessl AJ. The Effects of Exercise on Cognition in Parkinson’s disease: A Systematic Review. Translational Neurodegeneration 2014; 3(5): 1-13.
9-Harry GJ, Kraft AD. Neuroinflammationand Microglia:Considerations and Approaches for Neurotoxicity Assessment. Expert Opin Drug Metab Toxicol 2008; 4(10): 1265-77.
10-Juri MC, Rodriguez O, Obese JA. The Pathophysiological Basis of Sensory Disturbances in Parkinson's Disease. J NeurolSci 2010; 289(1-2): 60-5.
11-Obeso JA, Marin C, Rodriguez O, Blesa J, Benitez BT, Mena JS, et al. The Basal Ganglia inParkinson's Disease: Current Concepts and Unexplained Observations. Ann Neurol 2008; 64 Suppl 2: S30-46.
12-Defazio G, Gigante A, Mancino P, Tinazzi M. The Epidemiology of Pain in Parkinson's Disease. J Neural Transm(Vienna) 2013; 120(4): 583-6.
13-Fil A, Cano-de-la-Cuerda R, Munoz-Hellín E, Vela L, Ramiro-Gonzalez M, Fernandez-de-Las-Penas C. Pain in Parkinson Disease: A Review of the Literature. Parkinsonism Relat Disord 2013; 19(3): 285-94.
14-Hong JH, Kim MJ, Park MR, Kwag OG, Lee IS, Byun BH, et al. Effects of Vitamin E on Oxidative Stress and Membrane Fluidity in Brain of Streptozotocin-Induced Diabetic Rats. Clin Chim Acta 2014; 340(1-2): 107-15
15-Radak Z, KumagaiSh, Taylor AW, Naito H, Goto S. Effects of Exercise on Brain Function: Role of Freeradicals. Appl Physiol Nutr Metab 2007. 32(5): 942-6.
16-Singh A, Naidu PS, Kulkarni SK. FK506 as Effective Adjunct to L-Dopa in Reserpine-Induced Catalepsy in Rats. Indian J Exp Biol 2003; 41(11): 1264-8.
17-Hubrecht R, Kirkwood J. UFAW Handbook on the Care and Management of Laboratory and Other Research Animals. 8th Ed. John Wiley & Sons; 2010: 276-310.
18-Mallet PE, Beninger RJ, Flesher SN, Jhamandas K, Boegman RJ. Nucleus Basalis Lesions: Implication of Basoamygdaloid Cholinergic Pathways in Memory. Brain Res Bull 1995; 36(1): 51-6.
19-Fujita M, Nishino H, Kumazaki M, Shimada S,Tohyama M, Nishimura T. Expression of Dopamine Transporter Mrna and its Binding Site in Fetal Nigral Cells Transplanted into the Striatumof 6-OHDA Lesioned Rat. Mol Brain Res 1996; 39(1-2): 127-36.
20-Brooks GA, White TP. Determination of Metabolic and Heart Rate Responses of Rats in Treadmill Exercise. J Appl Physiol 1978; 45(6): 1009-15.
21-Ghadrdoost B,Vafaei AA, Rashidy-Pour A, Hajisoltani R, Bandegi AR, Motamedi F, et al. Protective Effects of Saffron Extract and its Active Constituent Crocin against Oxidative Stress and Spatial Learning and Memory Deficits Induced by Chronic Stress in Rats. Eur J Pharmacol 2011; 667(1): 222-9.
22-Wei XIG, Charles A, Smith J, Ure G, Feng F, Huang D, et al. Altered Immune Responses in Mice Lacking Inducible Nitric Oxide Synthase. Nature 1995; 375(6530): 408-11.
23-Hamilton F, Rochester L, Paul L, Rafferty D, O'Leary CP, Evans JJ. Walking and Talkingan Investigation of Cognitive-Motor Dual Tasking in Multiple Sclerosis. Mult Scler 2009; 15(10): 1215-27.
24-Sicotte N, Kern K, Giesser B, Arshanapalli A, Schultz A, Montag M, et al. Regional Hippocampal Atrophy in Multiple Sclerosis. Brain 2008; 131(4): 1134-41.
25-Mattson MP. Neuroprotective Signaling and the Aging Brain: Take away my Food and Let me Run. Brain Res 2000; 886(1-2): 47-53.
26-Hooshmandi Z, Nikseresht A, Koushkie Jahromi M, Ashjazade N, Salesi M. The Effect of Eight Weeks Aerobic Exercise Training on Nitric Oxide Level, Disability Status, and VO2 max in Women with Relapsing Remitting Multiple Sclerosis. Ebnesina 2015; 17(2): 19-27. [Persian]
27-Zaros PR, Pires CE, Bacci M Jr, Moraes C, Zanesco A. Effect of 6-Months of Physical Exercise on the Nitrate/Nitrite Levels in Hypertensive Postmenopausal Women. BMC Women's Health 2009; 9: 17.
28-White LJ, Castellano V. Exercise and Brain Health--Implications for Multiple Sclerosis: Part II--Immune Factors and Stress Hormones. Sports Med 2008; 38(3): 179-86.
29-Rozenfeld C, Martinez R, Seabra S, Sant'anna C, Goncalves JG, Bozza M, et al. Toxoplasma Gondii Prevents Neuron Degeneration by Interferon-Gamma-Activated Microglia in a Mechanism Involving Inhibition of Inducible Nitric Oxide Synthase and Transforming Growth Factor-Beta1 Production by Infected Microglia. Am J Pathol 2005; 167(4): 1021-31.
30-Gielen S, Adams V, Mobius-Winkler S, Linke A, Erbs S, Yu J, et al. Anti-Inflammatory Effects of Exercise Training in the Skeletal Muscle of Patients with Chronic Heart Failure. J Am Coll Cardio 2003; 42(5): 861-68.
31-Golzari Z, Shabkhiz F, Soudi S, Kordi MR, Hashemi SM. Combined Exercise Training Reduces IFN-Gamma and IL-17 Levels in the Plasma and the Supernatant of Peripheral Blood Mononuclear Cells in Women with Multiple Sclerosis. Int Immunopharmacol 2010; 11: 1415-19.
32-White LJ, Castellano V. Exercise and Brain Health--Implications for Multiple Sclerosis: Part 1--Neuronal Growth Factors. Sports Med 2008; 38(2): 91-100.
33-Miller E, Mrowicka M, Malinowska K, Zolynski K, Kedziora J. Effects of the Whole-Body Cryotherapy on a total Antioxidative Status and Activities of some Antioxidative Enzymes in Blood of Patients with Multiple Sclerosis-Preliminary Study. J Med Invest 2010; 57(1-2): 168-73.
34-Broen MPG, Braaksma MM, Patijn J. Weber WEJ 2012 Prevalence of Pain in Parkinson’s Disease: aSystematic Review using the Modified QUADAS Tool. Mov Disord 2012; 27: 480-84.
35-Del Sorbo F, Albanese A. Clinical Management of Pain and Fatigue in Parkinson's Disease. Parkinsonism Relat Disord 2012; 18 Suppl 1: S233-36.
36-Ford B. Pain in Parkinson ’s disease. Clinical Neuroscience 1998; 5(2): 63-72.
37-Petzinger GM, Fisher BE, McEwen S, Beeler JA, Walsh JP, Jakowec MW. Exercise-Enhanced Neuroplasticity Targeting Motor and Cognitive Circuitry in Parkinson’s disease. Lancet Neurol 2013; 12(7): 716-26.
38-Stephens B, Mueller AJ, Shering AF, Hood SH, Taggart P, Arbuthnott GW, Bell JE, Kilford L, Kingsbury AE, Daniel SE, Ingham CA. Evidence of a Breakdown of Corticostriatal Connections in Parkinson’s Disease. Neuroscience 2005; 132(3): 741-54.
39-Toy WA, Petzinger GM, Leyshon BJ, Akopian GK, Walsh JP, Hoffman MV, et al. Treadmill Exercise Reverses Dendritic Spine Loss in Direct and Indirect Striatal Medium Spiny Neurons in the 1-Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridine (MPTP) Mouse Model of Parkinson’s Disease. Neurobiol Dis 2014; 63: 201-9.
40-Sehm B, Taubert M, Conde V, Weise D, Classen J, Dukart J, et al. Structural Brain Plasticity in Parkinson’s Disease Induced by Balance Training. Neurobiol Aging 2014; 35(1): 232-9.
41-Allen NE, Moloney N, Van Vliet V, Canning CG. The Rationale for Exercise in the Management of Pain in Parkinson’s disease. J Parkinson's Disease 2015; 5(2): 229-39
42-Winter Y, von Campenhausen S, Arend M, Longo K, Boetzel K, Eggert K, et al. Health-Related Quality of Life and its Determinants in Parkinson’s disease: Results of an Italian Cohort Study Parkinsonism. Parkinsonism & Related Disorders 2011; 17(4): 265-69.
1-Dorsey ER, Constantinescu R, Thompson JP, Biglan KM, Holloway RG, Kieburtz K, et al. Tanner CM 2007 Projected Number of People with Parkinson Disease in the Most Populous Nations,Through 2030.Neurology 2005; 68(5): 384-6.
2-Braak H, Del Tredici K, Braak H, Del Tredici K. Cortico-Basal Ganglia-Cortical Circuitry in Parkinson’s Disease Reconsidered. Experim Neurology 2008; 212: 226-29.
3-Ahlskog JE. Does Vigorous Exercise have a Neuroprotective Effect in Parkinson Disease? Neurology 2011; 77(3): 288-94.
4-Fayyaz M, Jaffery SS, Anwer F, Zil-E-Ali A, Anjum I. The Effect of Physical Activity in Parkinson's disease: A Mini-Review. Cureus 2018; 10(7): e2995.
5-Manuel Encinas J, Manganas L. Enikolopov G. Nitric Oxide and Multiple Sclerosis. Current Neurology and Neuroscience Reports 2005; 5: 232-8.
6-Brenner TS, Brocke F, Szafer RA, SobelJF, Parkinson JH, Perez DH, Steinman L. Inhibition of Nitric Oxide Synthase for Treatment of Xperimental Autoimmune Encephalomyelitis. J Immunol 1997; 158(6): 294.
7-Al-Jarrah M, Obaidat H, Bataineh Z, Walton L, Al-Khateeb A. Endurance Exercise Training Protects against the Upregulation of Nitric Oxide in the Striatum of MPTP/Probenecid Mouse Model of Parkinson's disease Neurorehabilitation 2013; 32(1): 141-47.
8-Murray DK, Sacheli MA, Eng JJ, Stoessl AJ. The Effects of Exercise on Cognition in Parkinson’s disease: A Systematic Review. Translational Neurodegeneration 2014; 3(5): 1-13.
9-Harry GJ, Kraft AD. Neuroinflammationand Microglia:Considerations and Approaches for Neurotoxicity Assessment. Expert Opin Drug Metab Toxicol 2008; 4(10): 1265-77.
10-Juri MC, Rodriguez O, Obese JA. The Pathophysiological Basis of Sensory Disturbances in Parkinson's Disease. J NeurolSci 2010; 289(1-2): 60-5.
11-Obeso JA, Marin C, Rodriguez O, Blesa J, Benitez BT, Mena JS, et al. The Basal Ganglia inParkinson's Disease: Current Concepts and Unexplained Observations. Ann Neurol 2008; 64 Suppl 2: S30-46.
12-Defazio G, Gigante A, Mancino P, Tinazzi M. The Epidemiology of Pain in Parkinson's Disease. J Neural Transm(Vienna) 2013; 120(4): 583-6.
13-Fil A, Cano-de-la-Cuerda R, Munoz-Hellín E, Vela L, Ramiro-Gonzalez M, Fernandez-de-Las-Penas C. Pain in Parkinson Disease: A Review of the Literature. Parkinsonism Relat Disord 2013; 19(3): 285-94.
14-Hong JH, Kim MJ, Park MR, Kwag OG, Lee IS, Byun BH, et al. Effects of Vitamin E on Oxidative Stress and Membrane Fluidity in Brain of Streptozotocin-Induced Diabetic Rats. Clin Chim Acta 2014; 340(1-2): 107-15
15-Radak Z, KumagaiSh, Taylor AW, Naito H, Goto S. Effects of Exercise on Brain Function: Role of Freeradicals. Appl Physiol Nutr Metab 2007. 32(5): 942-6.
16-Singh A, Naidu PS, Kulkarni SK. FK506 as Effective Adjunct to L-Dopa in Reserpine-Induced Catalepsy in Rats. Indian J Exp Biol 2003; 41(11): 1264-8.
17-Hubrecht R, Kirkwood J. UFAW Handbook on the Care and Management of Laboratory and Other Research Animals. 8th Ed. John Wiley & Sons; 2010: 276-310.
18-Mallet PE, Beninger RJ, Flesher SN, Jhamandas K, Boegman RJ. Nucleus Basalis Lesions: Implication of Basoamygdaloid Cholinergic Pathways in Memory. Brain Res Bull 1995; 36(1): 51-6.
19-Fujita M, Nishino H, Kumazaki M, Shimada S,Tohyama M, Nishimura T. Expression of Dopamine Transporter Mrna and its Binding Site in Fetal Nigral Cells Transplanted into the Striatumof 6-OHDA Lesioned Rat. Mol Brain Res 1996; 39(1-2): 127-36.
20-Brooks GA, White TP. Determination of Metabolic and Heart Rate Responses of Rats in Treadmill Exercise. J Appl Physiol 1978; 45(6): 1009-15.
21-Ghadrdoost B,Vafaei AA, Rashidy-Pour A, Hajisoltani R, Bandegi AR, Motamedi F, et al. Protective Effects of Saffron Extract and its Active Constituent Crocin against Oxidative Stress and Spatial Learning and Memory Deficits Induced by Chronic Stress in Rats. Eur J Pharmacol 2011; 667(1): 222-9.
22-Wei XIG, Charles A, Smith J, Ure G, Feng F, Huang D, et al. Altered Immune Responses in Mice Lacking Inducible Nitric Oxide Synthase. Nature 1995; 375(6530): 408-11.
23-Hamilton F, Rochester L, Paul L, Rafferty D, O'Leary CP, Evans JJ. Walking and Talkingan Investigation of Cognitive-Motor Dual Tasking in Multiple Sclerosis. Mult Scler 2009; 15(10): 1215-27.
24-Sicotte N, Kern K, Giesser B, Arshanapalli A, Schultz A, Montag M, et al. Regional Hippocampal Atrophy in Multiple Sclerosis. Brain 2008; 131(4): 1134-41.
25-Mattson MP. Neuroprotective Signaling and the Aging Brain: Take away my Food and Let me Run. Brain Res 2000; 886(1-2): 47-53.
26-Hooshmandi Z, Nikseresht A, Koushkie Jahromi M, Ashjazade N, Salesi M. The Effect of Eight Weeks Aerobic Exercise Training on Nitric Oxide Level, Disability Status, and VO2 max in Women with Relapsing Remitting Multiple Sclerosis. Ebnesina 2015; 17(2): 19-27. [Persian]
27-Zaros PR, Pires CE, Bacci M Jr, Moraes C, Zanesco A. Effect of 6-Months of Physical Exercise on the Nitrate/Nitrite Levels in Hypertensive Postmenopausal Women. BMC Women's Health 2009; 9: 17.
28-White LJ, Castellano V. Exercise and Brain Health--Implications for Multiple Sclerosis: Part II--Immune Factors and Stress Hormones. Sports Med 2008; 38(3): 179-86.
29-Rozenfeld C, Martinez R, Seabra S, Sant'anna C, Goncalves JG, Bozza M, et al. Toxoplasma Gondii Prevents Neuron Degeneration by Interferon-Gamma-Activated Microglia in a Mechanism Involving Inhibition of Inducible Nitric Oxide Synthase and Transforming Growth Factor-Beta1 Production by Infected Microglia. Am J Pathol 2005; 167(4): 1021-31.
30-Gielen S, Adams V, Mobius-Winkler S, Linke A, Erbs S, Yu J, et al. Anti-Inflammatory Effects of Exercise Training in the Skeletal Muscle of Patients with Chronic Heart Failure. J Am Coll Cardio 2003; 42(5): 861-68.
31-Golzari Z, Shabkhiz F, Soudi S, Kordi MR, Hashemi SM. Combined Exercise Training Reduces IFN-Gamma and IL-17 Levels in the Plasma and the Supernatant of Peripheral Blood Mononuclear Cells in Women with Multiple Sclerosis. Int Immunopharmacol 2010; 11: 1415-19.
32-White LJ, Castellano V. Exercise and Brain Health--Implications for Multiple Sclerosis: Part 1--Neuronal Growth Factors. Sports Med 2008; 38(2): 91-100.
33-Miller E, Mrowicka M, Malinowska K, Zolynski K, Kedziora J. Effects of the Whole-Body Cryotherapy on a total Antioxidative Status and Activities of some Antioxidative Enzymes in Blood of Patients with Multiple Sclerosis-Preliminary Study. J Med Invest 2010; 57(1-2): 168-73.
34-Broen MPG, Braaksma MM, Patijn J. Weber WEJ 2012 Prevalence of Pain in Parkinson’s Disease: aSystematic Review using the Modified QUADAS Tool. Mov Disord 2012; 27: 480-84.
35-Del Sorbo F, Albanese A. Clinical Management of Pain and Fatigue in Parkinson's Disease. Parkinsonism Relat Disord 2012; 18 Suppl 1: S233-36.
36-Ford B. Pain in Parkinson ’s disease. Clinical Neuroscience 1998; 5(2): 63-72.
37-Petzinger GM, Fisher BE, McEwen S, Beeler JA, Walsh JP, Jakowec MW. Exercise-Enhanced Neuroplasticity Targeting Motor and Cognitive Circuitry in Parkinson’s disease. Lancet Neurol 2013; 12(7): 716-26.
38-Stephens B, Mueller AJ, Shering AF, Hood SH, Taggart P, Arbuthnott GW, Bell JE, Kilford L, Kingsbury AE, Daniel SE, Ingham CA. Evidence of a Breakdown of Corticostriatal Connections in Parkinson’s Disease. Neuroscience 2005; 132(3): 741-54.
39-Toy WA, Petzinger GM, Leyshon BJ, Akopian GK, Walsh JP, Hoffman MV, et al. Treadmill Exercise Reverses Dendritic Spine Loss in Direct and Indirect Striatal Medium Spiny Neurons in the 1-Methyl-4-Phenyl-1,2,3,6-Tetrahydropyridine (MPTP) Mouse Model of Parkinson’s Disease. Neurobiol Dis 2014; 63: 201-9.
40-Sehm B, Taubert M, Conde V, Weise D, Classen J, Dukart J, et al. Structural Brain Plasticity in Parkinson’s Disease Induced by Balance Training. Neurobiol Aging 2014; 35(1): 232-9.
41-Allen NE, Moloney N, Van Vliet V, Canning CG. The Rationale for Exercise in the Management of Pain in Parkinson’s disease. J Parkinson's Disease 2015; 5(2): 229-39
42-Winter Y, von Campenhausen S, Arend M, Longo K, Boetzel K, Eggert K, et al. Health-Related Quality of Life and its Determinants in Parkinson’s disease: Results of an Italian Cohort Study Parkinsonism. Parkinsonism & Related Disorders 2011; 17(4): 265-69.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1398/11/9 | پذیرش: 1399/4/24 | انتشار: 1399/4/24
دریافت: 1398/11/9 | پذیرش: 1399/4/24 | انتشار: 1399/4/24
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







