دوره 28، شماره 4 - ( تیر 1399 )
جلد 28 شماره 4 صفحات 2583-2574 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Davoodi M, Naeimi S, Moghanibashi M M. Investigation of IL-17Agene Polymorphism (Rs2275913) with Infertility in Southern Iranian Women. JSSU 2020; 28 (4) :2574-2583
URL: http://jssu.ssu.ac.ir/article-1-4966-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4966-fa.html
داودی محدثه، نعیمی سیروس، مغنی باشی محمدمهدی. بررسی پلیمورفیسم ژن( rs2275913G/A) IL-17A با ناباروری در زنان منطقه جنوب ایران. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (4) :2574-2583
متن کامل [PDF 866 kb]
(705 دریافت)
| چکیده (HTML) (1743 مشاهده)
References:
1-World Health Organization 2019. Health Topics: Infertility. Available from: http://www.who.int/ topics/infertility/ en/. Accessed November 5, 2019.
2-Fiori F, Francesca R, Elspeth G. Choosing to Remain Childless? A Comparative Study of Fertility Intentions among Women and Men in Italy and Britain. Eur J Popul 2017; 33(3): 319-50.
3-Romero R. Giants in Obstetrics and Gynecology Series: A profile of Leon Speroff, MD. American J Obstetrics and Gynecology 2017; 217(3): 263.
4-Brazdova A, Senechal H, Peltre G, Poncet P. Immune Aspects of Female Infertility. Int J Fertil Steril 2016; 10(1):1-10.
5-Kawaguchi M, Adachi M, Oda N. Kokubu F, Huang SK. IL-17 Cytokine Family. J Allergy Clinical Immunol 2004; 114(6): 1265-73.
6-Jadidi-Niaragh F, Mirshafiey A. Th17 Cell, the New Player of Neuroinflammatory Process in Multiple Sclerosis. Scand J Immunol 2011; 74(1): 1-13.
7-Moseley TA, Haudenschild DH, Rose L, Reddi AH. Interleukin-17 Family and IL-17 Receptors. Cytokine Growth Factor Rev 2003; 14(2): 155-74.
8-Sabbaghi M, Aram R, Roustaei H, Fadavi Islam M, Daneshvar M, Castaño AR, et al. Il-17a Concentration of Seminal Plasma and Follicular Fluid in Infertile Men and Women with Various Clinical Diagnoses. Immunol Invest 2014; 43(7): 617-26
9-Zhang X, Xu H, Lin J, Qian Y, Deng L. Peritoneal Fluid Concentrations of Interleukin-17 Correlate with the Severity of Endometriosis and Infertility of this Disorder. BJOG 2005; 112(8): 1153-5.
10-Wu X, Zeng Z, Chen B, Yu J, Xue L, Hao Y, et al. Association between Polymorphisms in Interleukin-17a and Interleukin 17-F Genes and Risks of Gastric Cancer. Int J Cancer 2010; 127(1): 86-92
11-Koraei A, Dasht Bozorgi Z, Zahery Abdh Vand S. The Effect of Coping Strategies on Coping with Infertility in Women: Mediator Role of Marital Quality. Avicenna J Nurs Midwifery Care 2018; 26(3): 191-202.
12-Silvestris E, D’Oronzo S, Cafforio P, D’Amato G, Loverro G. Perspective in Infertility: The Ovarian Stem Cells. J Ovarian Res 2015; 8(1): 1-9.
13-Sukhikh GT, Vanko LV. Interrelationships between Immune and Reproductive Systems in Human. Russ J Immunol 1999; 4(4): 312-4.
14-Espinoza JL, Takami A, Nakata K, Makoto Onizuka, Takakazu Kawase, Hideki Akiyama, et al. A Genetic Variant in the IL-17 Promoter is Functionally Associated with Acute Graft-Versus-Host Disease after Unrelated Bone Marrow Transplantation. Plos One 2011; 6(10): e26229.
15-Liu XK, Lin X, Gaffen SL. Crucial Role For Nuclear Factor of Activated T Cells in T Cell Receptor-Mediated Regulation of Human Interleukin-17. J Biol Chem 2004; 279(50): 52762-71.
16-Ohka S, Nishizawa D, Hasegawa J, Takahashi K, Nakayama K, Ebata Y, et al. Association Between Rs2275913 Single‐Nucleotide Polymorphism of the Interleukin‐17A Gene and Perioperative Analgesic Use in Cosmetic Orthognathic Surgery. Neuropsychopharmacol Rep 2018; 38(2): 67-74.
17-Wang L, Chen S, Xu K. IL-17 Expression is correlated with Hepatitis B-Related Liver Diseases and Fibrosis. Int J Mol Med 2010; 27(3): 385-92.
18-Witowski J, Ksiazek K, Jörres A. Interleukin- 17: A Mediator of Inflammatory Responses. Cell Mol Life Sci 2004; 61(5): 567-79.
19-Chabaud M, Durand JM, Buchs N, Fossiez F, Page G, Frappart L, et al. Human Interleukin-17: A Tcell-Derived Proinflammatory Cytokine Produced by the Rheumatoid Synovium. Arthritis Rheum 1999; 42(5): 963-70.
20-Ziolkowska M, Koc A, Luszczykiewicz G, Ksiezopolska-Pietrzak K, Klimczak E, Chwalinska- Sadowska H, et al. High Levels of IL-17 in Rheumatoid Arthritis Patients: IL-15 Triggers in Vitro IL-17 Production via Cyclosporin A-Sensitive Mechanism. J Immunol 2000; 164(5): 2832-8.
21-Dela F, Ploug T, Handberg A, Petersen, LN, Larsen JJ, Mikines KJ, Galbo H. Physical Training Increases Muscle GLUT4 Protein and Mrna in Patients with NIDDM . Diabetes 1994; (43): 862-65.
22-Kato T, Furumoto H, Ogura T, Onishi Y, Irahara M, Yamano S. Expression of IL-17 Mrna in Ovarian Cancer. Biochem Biophys Res Commun 2001; 282(3): 735-8.
23-Phielix E, Szendroedi J, Roden M. Mitochondrial Function and Insulin Resistance during Aging. Gerontol 2011; 57(5): 387-96.
24-Kunkel TA, Erie DA. DNA Mismatch Repair. Annu Rev Biochem 2005; 74: 681-710.
25-Iyer RR, Pluciennik A, Burdett V, Modrich PL. DNA Mismatch Repair: Functions and Mechanisms. Chem Rev 2006; 106(2): 302-23.
26-Jiricny J. The Multifacetedmismatch-Repair System. Nat Rev Mol Cell Biol 2006; 7(5): 335-46.
27-Lazaros LA, Xita NV, Chatzikyriakidou AL, Kaponis AI, Grigoriadis EG, Hatzi EG, et al. Association of Tnfα, TNFR1, and TNFR2 Polymorphisms with Sperm Concentration and Motility. J Androl 2012; 33(1): 74-80.
28-Tronchon V, Vialard F, El Sirkasi M, Dechaud H, Rollet J, Albert M,et al. Tumor Necrosis Factor-Alpha -308 Polymorphism in Infertile Men with Altered Sperm Production or Motility. Hum Reprod 2008; 23(12): 2858-66.
29-Zalata A, Atwa A, Badawy AEN, Aziz A, El-Baz R, Elhanbly S, et al. Tumor Necrosis Factor-α Gene Polymorphism Relationship to Seminal Variables in Infertile Men. Urology 2013; 81(5): 962-66.
متن کامل: (1481 مشاهده)
مقدمه
طبق گزارش سازمان جهانی بهداشت word Health organization (WHO)، ناتوانی در باردار شدن، حفظ بارداری، و یا حمل حاملگی ناباروری نامیده میشود (1). بررسیها نشان می دهد که در سراسر جهان از سه تا هفت درصد از تمامی زوج ها یا زنان، یک مشکل حل نشده ناباروری دارند. با این حال، بسیاری از زوجها، تجربه اجباری نداشتن فرزند را برای حداقل یک سال دارند، که محدوده آن از 12 تا 28 درصد برآورد میشود (2). برخی مطالعات نشان می دهد، شیوع واقعی ناباروری تحت تأثیر عوامل مختلف در حال تغییر است. طی سال های اخیر، تغییر نقش زنان در فعالیت های اجتماعی، تأخیر در سن ازدواج، تغییر در سن فرزندآوری، افزایش استفاده از روش های پیشگیری از بارداری و غیره از مهم ترین علل کاهش باروری در برخی کشورهای صنعتی از جمله ایالات متحده ذکر شده اند (3). اختلالات سیستم ایمنی بدن و بیماری های خود ایمنی ممکن است شانس افراد (مردان و زنان) را برای باردارشدن تحت تاثیر قرار دهد. کارشناسان نشان داده اند که 20 درصد از تمام موارد ناباروری با علت ناشناخته ممکن است به اختلالات سیستم ایمنی بدن مرتبط باشد. زنان بهطور طبیعی سیستم ایمنی قویتری از مردان بهدلیل نقش باروری خود از جمله، محافظت جنین دارند. سلولهای ایمنی خاصی که با پاسخ التهابی (و محصولات ترشحی آنها) در ارتباط قرار دارند یک بخش ضروری از فرایند تخمکگذاری میباشند. همچنین سایتوکاینها با آمادهسازی اندومتر (پوشش داخلی رحم) برای لانهگزینی تخمک بارور در ارتباط میباشند (4).
IL-17، یک سایتوکاین پیشالتهابی است، که باعث بیان بسیاری از واسطههای التهاب میشود. از میان خانواده اینترلوکین 17، اینترلوکینIL-17A و IL-17 F اهمیت بیشتری دارا میباشند. این سیتوکاینها دارای پلیمورفیسمهایی میباشند و این چند شکلی (Polymorphism) بر روی عملکرد ژن این سیتوکاینها تاثیرگذار است. اینترلوکین 17 (IL-17) توسط سلول های Th-17 ترشح می شود و از طریق القای فاکتورهای مختلف باعث ایجاد و تقویت التهاب می شود. همچنین این سایتوکاین توسط ماکروفاژها، نوتروفیل ها، مونوسیت¬ها و سلول¬های T CD8+ نیز بیان می¬شود (5). سلولهای Th 17 سایتوکاین های متنوعی از قبیل IL-1A، IL-17F، IL-6، IL-23 ،IL-22 ،IL-21 ، IL-9 ، IL-26، GM-CSF و TNF را تولید می¬کنند، اما IL-17(IL-17A) سایتوکاین اختصاصی این سلول ها می باشد. علاوه بر اثرات مستقیم پیشالتهابی، IL-17A باعث القای تولید سایر واسطه¬های محلول از جمله IL-6، IL-1، TNF، GM-CSF، MMP و CXCL8 در سلول های مختلف می گردد، که همگی ماهیت پیش التهابی سلول های Th17 را نشان می دهند (6). محصول ژن IL-17A انسان پروتئین 150 اسید آمینه با وزن مولکولی kDa 15 است و بهعنوان یک همودیمر kDa 35-30 گلیکوپروتئین ترشح می¬شود (7).
در مطالعه انجام شده توسط دانشگاه فردوسی مشهد، سطح IL-17A در پلاسمای سمینال، مایع فولیکولی و سرم خون بیماران نابارور با تشخیص های مختلف بالینی توسط ELISA آنالیز شد. نتایج نشان داد که سطح IL-17A در پلاسمای سمینال و سرم خون بیماران واریکوسل از گروه شاهد بالاتر بود. سطح این سایتوکاین در مایع فولیکولی بیماران اندومتریوز، PCOS و بیماران با علل لوله از گروه شاهد بالاتر بود (8). مطالعه آینده¬ نگر در چین با هدف تعیین اینکه آیا زنان مبتلا به اندومتریوز سطوح مختلفی از (IL-17) را در مایع صفاقی خود دارند، در مقایسه با زنان بدون بیماری اندومتریوز انجام شد. بیماران با حداقل اندومتریوز خفیف، سطح قابلتوجهی بالاتر از IL-17 را در مایع صفاقی خود در مقایسه با کسانی که با اندومتریوز متوسط / شدید یا بدون اندومتریوز بود داشتند. غلظت IL-17 در مایع صفاق زمانی که اندومتریوز و ناباروری توام بودند، بهطور قابلتوجهی بالاتر بود. با این حال، غلظت IL-17 در مایع صفاقی به فاز چرخه قاعدگی در بیماران با یا بدون اندومتریوز بستگی ندارد. مطالعه ژانگ و همکاران نشان داد که IL-17 ممکن است نقش مهمی در پاتوژنز اندومتریوز اولیه و اندومتریوز مرتبط با ناباروری داشته باشد (9). با توجه به نکات گفته شده، با عنایت به این موضوع که یکی از اهداف مطالعات جمعیتی و پلی مورفیسم، پیدا نمودن بیومارکرهای زیستی بهعنوان یک فاکتور پیش آگهی دهنده است، هدف از انجام این تحقیق، تعیین فراوانی پلیمورفیسمژن IL-17A در موقعیت rs2275913 در بیماران مبتلا به ناباروری و مقایسه آن با خانمهای بارور میباشد .
روش بررسی
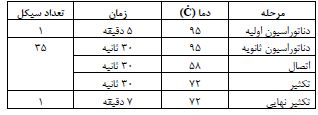
در این تحقیق موردی- شاهدی، نمونه خونی 200 خانم مبتلا به ناباروری به حجم 2CC که توسط پزشک متخصص تایید شده بود، و همچنین 2CC خون 200 خانم باردار سالم بهعنوان گروه شاهد، که از نظر سن با گروه بیمار مطابقت داشته از بیمارستان مادر و کودک شیراز جمعآوری گردید. میانگین سنی گروه بیمار و کنترل به ترتیب 5/99 ± 32/23 و 6/23 ± 32/65 میباشد، و تفاوت معناداری بین دو گروه مشاهده نمیشود. دامنه سنی افراد شرکت کننده در گروه بیمار 45-20 و در گروه کنترل 47-20 میباشد. حجم نمونه با استفاده از نرم افزار GPower 3.1.9.2 محاسبه گردید. حجم نمونه لازم برای آزمون تفاوت نسبت وجود پلیمورفیسم مورد نظر (AA) در دو گروه مستقل (گروههای مورد و شاهد) محاسبه گردید. شیوع پلیمورفیسم مورد نظر در جمعیت گروه کنترل 10درصد در نظر گرفته شد. میزان خطای آلفا و بتا به ترتیب 0/05 و 0/20 در نظر گرفته شد. حجم نمونه مورد نظر برای تعیین تفاوتی برابر 10درصد در دو جمعیت مورد و شاهد حدود 200نفر در هر گروه محاسبه گردید. نمونهگیری بیماران از نوع آسان (convenience) بوده و لازمه ورود بهمطالعه برای بیماران (inclusion criteria) تشخیص اولیه بر اساس علائم کلینیکی و تشخیص قطعی بر اساس آزمایشات پاراکلینیکی و بررسی سابقه بیمار میباشد. عدم تمایل جهت شرکت در مطالعه، وجود همزمان بیماریهای دیگر یا بیماریهایی با زمینه ایمونولوژیک و ژنتیک، دیابت، بارداری، مصرف داروهای ضدبارداری، مصرف آنتیبیوتیکهای وسیعالطیف و نیز اعتیاد به انواع مواد مخدر یا الکل در بیماران باعث حذف بیمار از مطالعه میگردد (exclusion criteria). افراد کنترل از میان مراجعین بهمطب متخصصین زنان و درمانگاههای آموزشی دانشگاه انتخاب و وارد مطالعه میشوند. لازمه ورود به مطالعه (inclusion criteria) برای افراد گروه کنترل شامل سلامت جسمانی و مطابقت با بیماران از نظر سن انجام میشود. وجود هرگونه سابقه این بیماری و بیماریهای خودایمنی و ژنتیک در خود و بستگان در جه اول باعث حذف داوطلب از ورود به مطالعه میشود (exclusion criteria). تمامی بیماران درباره تحقیق توجیه شده و تمامی ملاحظات اخلاق پزشکی، رعایت گردید. از هریک از افراد حدود 2 CC خون گرفته شد و نمونههای خون به لوله های حاوی ماده ضدانعقاد EDTA منتقل شد. نمونهها تا زمان استخراج DNA در دمای 20- Ċ نگهداری شدند. DNA ژنومی افراد مورد مطالعه به روش Salting Out با استفاده از کیت GENE ALL ساخته شده توسط کشور کره جنوبی استخراج گردید و لولههای حاوی DNA تا زمان انجام واکنش PCR در دمای -20 Ċ نگهداری شدند. در این مطالعه جهت تعیین ژنوتیپ افراد مورد مطالعه، از تکنیک PCR-RFLP استفاده شد. جهت انجام PCR و تشخیص جهش جایگاه rs2275913 در ژن IL-17A از یک جفت پرایمر اختصاصی استفاده شد (10)(جدول1). این پرایمر ها می توانند یک توالی نوکلئوتیدی بهطول 102 bp را تکثیر کنند. مواد و مقادیر مورد نیاز جهت تکثیر پلیمورفیسمrs2275913 شامل: 12/5 میکرولیترMaterMix، میکرولیتPrimer Forward1میکرولیترPrimer Revese1 میکرولیتر4/5 H2O میکرولیترDNA1 که نهایتاً حجم نهایی به 20 میکرولیتر میرسد. برنامه PCR جهت انجام تکنیک PCR-RFLP در جدول 2 آورده شده است. محصولات حاصل از PCR در حضور آنزیم XagI تحت هضم قرار گرفتند. مواد مورد نیاز جهت بررسی پلیمورفیسم-33C/T شامل: یک میکرولیتر آنزیم XagI، دو میکرولیتر بافر با غلظت ده برابر، دو میکرولیتر آب مقطر تزریقی استریل و ده میکرولیتر محصول PCR بود که نهایتاً حجم نهایی به 15 میکرولیتر میرسد. این پروتوکل پس از چند بار کم و زیاد کردن حجم مواد بهدست آمد. در نهایت توسط ژل آگارز 2%، الکتروفورز گردید. بر این اساس ژنوتیپ AA به طول 102 جفت باز، ژنوتیپ AG به طول های 34 ، 68 و 102 جفت باز و همچنین ژنوتیپ GG به طول های 34 و 68 جفت بازمیباشد. ( شکل 1)
تجزیه و تحلیل آماری
بهمنظور آنالیز دادهها و انجام تستهای آماری از نرمافزار SPSS ویرایش 24 استفاده شد. برای بیان پراکندگی، مقدارها بهصورت Mean SEM استفاده شد. جهت بررسی اختلاف توزیع ژنوتیپ ها بین دو گروه بیمار و کنترل از آزمون رگرسیون لوجستیک استفاده گردید. همچنین از آزمون آماری مربع کای و هاردی- واینبرگ استفاده شد. در تحلیل نتایج
P < 0/05 سطح معنادار در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد کازرون تایید شده است
(کد اخلاقIR.IAU.KAU.REC.1398.065 ).
جدول1: پرایمر Forward و Reverse مربوط به ژن IL-17A

جدول2: برنامه PCR جهت تکثیر پلیمورفیسم rs2275913
.jpg)
شکل1: انواع ژنوتیپ های قابل مشاهده برای پلی مورفسیم rs2275913 در ژن IL-17A با کمک تکنیک PCR-RFLP پس از هضم آنزیمی XagI بر روی ژل آگارز
نتایج
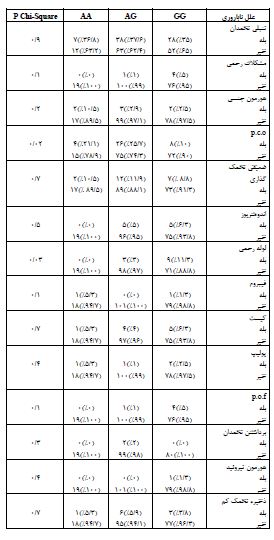
در این مطالعه، میانگین سنی گروه بیمار و کنترل به ترتیب 5/99 ± 32/23 و 6/23 ± 32/65 میباشد، و تفاوت معناداری بین دو گروه مشاهده نمیشود. دامنه سنی افراد شرکتکننده در گروه بیمار 45-20 و در گروه کنترل 47-20 میباشد. همچنین نتایج حاصل از بررسی توزیع ژنوتیپ ها در دو گروه بیمار (X2 = 2.58‚ P > 0.05 ‚ HWE P-Value = 0.1) و در گروه کنترل (X2 = 2.65‚ P > 0.05 ‚ HWE P-Value = 0.1) نشان داد که جمعیت مورد مطالعه در تعادل هاردی- واینبرگ قرار دارد. در این مطالعه برای بررسی ارتباط بین این پلیمورفیسم با ناباروری، با استفاده از آزمون آماری رگرسیون لوجستیک، فراوانی ژنوتیپی و فراوانی آللی پلیمورفیسمrs2275913 در ژن IL-17A بین دو گروه بیمار و کنترل مقایسه شد. تجزیه و تحلیل دادهها نشان داد که ژنوتیپ AG ارتباط معناداری با بیماری ناباروری دارد (P = 0.001). همچنین آلل A (Wild Allele) نیز، ارتباط معناداری با بیماری ناباروری دارد (P = 0.000) (جدول3). علاوه بر این مشخص گردید که مشکلات زمینهای بیماران از قبیل P.C.O (سندروم تخمدان پلی کیستیک) ( P = 0.02) و مشکلات لوله رحمی ( P = 0.03) ، ارتباط معناداری با پلیمورفیسمrs2275913 دارا میباشند (جدول 4).
جدول3:بررسی ارتباط پلیمورفیسمrs2275913 با ناباروری

جدول4: بررسی ارتباط بین علل ناباروری با پلیمورفیسمrs2275913 در ژن IL-17A در جمعیت بیمار
بحث
هر زوجی بنا بر سرشت ذاتی، مسائل فرهنگی، اجتماعی و خانوادگی تمایل به داشتن فرزند دارد. طبق آمار کلی، از هر هفت زوج، یک زوج بارور نمیشوند (11 و 12). هنگامی اصطلاح زوج نابارور به کار میرود که، با گذشت یک سال، بدون استفاده از روشهای پیشگیری از بارداری، بارداری رخ ندهد و اگر سن خانم بیش از 35 سال باشد، این مدت به شش ماه کاهش مییابد (12). مشکلات متفاوتی سبب ناباروری می شود. این مشکلات ممکن است مربوط به مرد، زن یا هر دو باشد، به طوریکه حدود 40درصد موارد ناباروری مربوط به مردان، 40درصد مربوط به زنان و حدود 10درصد مربوط به هر دو است و در 10درصد از زوج ها نیز عامل ناباروری مشخص نیست (12). مهمترین علل ناباروری در زنان عبارتند از: اختلالات کار تخمدان، شامل عدم تخمک گذاری، تخمدان نواری، و دیسژنزی تخمدان که علت 39درصد موارد ناباروری زنان را تشکیل میدهد (12). اشکالات لولههای رحمی که در ورود اسپرماتوزوئید و عمل گشنگیری و خروج زیگوت به داخل رحم برای لانه گزینی دخیل هستند. آندومتریوز و عفونت از عوامل مهم این گروه هستند. اختلالات در گردن رحم که مانع دخول اسپرماتوزوئید بهحفره رحم میشود. اشکالات ساختاری رحم. ناسازگاری دستگاه ایمنی بدن مادر با جنین. ناهنجاریهای کروموزومی، شامل: مونوزومی X، پلیزومی X و غیره (12 و 13). تاکنون مطالعات بسیاری در زمینه ناباروری انجام شده است. مطالعه Sukhikh و Vanko (1999) نشان داد که بین سیستم ایمنی و دستگاه تولید مثل ارتباط وجود دارد و اینترلوکین یک آلفا، اینترلوکین 6 و اینترفرون در پیشرفت باروری، لانه گزینی تخم بارور شده در رحم نقش داشته، لذا اختلال آن میتواند دلیلی بر سقط جنین و نازایی باشد (14). در این مطالعه، با استفاده از آزمون آماری رگرسیون لوجستیک، اثر پلیمورفیسمrs2275913 در ژن IL-17A مورد بررسی قرار گرفت. در این جایگاه، مقایسه فراوانی آللی نشان داد که، آلل A با احتمال دو برابری میتواند در احتمال ابتلا به ناباروری نقش داشته باشد (P < 0.05 ‚ P = 0.000‚ OR = 2.003 ‚ %95 CI = 1.460 – 2.750). همراستا با نتایج ما، تحقیقات دیگر نشان داده که پلیمورفیسم rs2275913 در ناحیه پروموتر ژن IL-17A واقع شده است. گزارش شده است که آلل A در پلیمورفیسمrs2275913 باعث افزایش بیان ژن ایترلوکین 17 در انسان میگردد (15). موقعیت rs2275913 ، به عنوان G-197A نیز شناخته میشود. این جایگاه، یک پلیمورفیسمتک نوکلئوتیدی (SNP) واقع در منطقه بالادست از ژن IL-17A در داخل موتیف اتصالی برای فاکتور هستهای فعال شده T سلول (NFAT) است که یک تنظیم کننده ضروری برای بیان IL-17 میباشد. بنابراین این پلیمورفیسم ممکن است بر تنظیمات رونویسی IL-17 تاثیر بگذارد (16). در مطالعه انجام شده، در پلیمورفیسمrs2275913 ، درصد فراوانی ژنوتیپی GG، AG و AA برای گروه بیمار بهترتیب 40درصد، 50/5 درصد و 9/5 درصد و برای گروه کنترل 60/5 درصد، 37 درصد و 2/5 درصد بود. بررسی فراوانی ژنوتیپی در پلیمورفیسم rs2275913 ژن IL-17A (P = 0.001) نشان داد که احتمال ابتلای خانمهای دارای ژنوتیپ AG و GG به ناباروری به ترتیب 2 و 5 برابر بیشتر از خانمهای دیگر میباشد. نتایج تحقیق Ohka و همکاران (2017) نشان میدهد که ژنوتیپ AA در پلیمورفیسم rs2275913، فنوتیپ مربوط به درد را افزایش میدهد که احتمالاً از طریق افزایش بیان ژن IL-17A میباشد (17). همچنین مشخص شده است که میزان بیان ژن IL-17 با بیماری های کبدی و سطح فیبروز در ارتباط است (18). سطوح افزایش یافته IL-17 با شرایط متعددی از جمله التهاب راه¬های هوایی، آرتریت روماتوئید، آبسه¬های داخل صفاق، چسبندگی ها، بیماری های التهابی روده، پس زدن پیوند آلوگرافت، پسوریازیس، سرطان و مولتیپل اسکلروزیس در ارتباط است (18). مطالعات نشان می¬دهند IL-17 در پاتوژنز آرتریت روماتویید نقش دارد (19 و 20). اینترلوکین 17 سایتوکاینی التهابی است و در افراد چاق با نشانههای زیادی از التهاب مزمن درجه خفیف در ارتباط است. سطح افزایش یافته پروتئین¬های مرحله حاد و میانجی های التهابی در سرم افراد چاق نسبت به افراد لاغر گواه بر این ادعاست (21). همچنین، نشان داده شده است که اینترلوکین 17 رگزایی را در سلول¬های سرطانی افزایش می دهد و همبستگی بالایی با تعداد عروق خونی در سرطان تخمدان در انسان دارد (22). البته در نمونه¬های انسانی نقش¬های دیگری نیز پیشنهاد شده است، از جمله نقش اینترلوکین 17 در پوکی استخوان (23). در تحقیقی که توسط دانشگاه علوم پزشکی یزد صورت گرفت مشاهده شد یک همراهی بین واریانت C2531T (P844L) در ژن MLH3 و ناباروری در مردان به علت آزواسپرمی یا الیگواسپرمی شدید و بدون علت در نمونه خون محیطی وجود دارد که این یافته¬ها پیشنهادکننده این مطلب است که این جهش ممکن است یک عامل خطر ژنتیکی برای ناباروری در مردان در ایران باشد (67-24).Lazaros و همکاران (27) TNFR1 را بهعنوان یک فاکتور خطر در استعداد ابتلا به ناباروری معرفی کردند.Tronchon و همکاران (28) در کشور فرانسه دریافتند پلیمورفیسمژن TNF-α با کاهش مقدار اسپرم ارتباط دارد. همچنین Zalata و همکاران (29) طی تحقیقاتی که روی پلیمورفیسم ژن TNF-α انجام دادند دریافتند که موجب ناباروری در مردان میشود.
نتیجهگیری
در مطالعه حاضر بر اساس نتایج حاصل از آنالیز ژنتیکی و آماری نیز ارتباط معنیداری بین پلیمورفیسمrs2275913 و بیماری ناباروری مشاهده شد. در نتیجه، مطالعه حاضر نقش آلل A در پلیمورفیسمrs2275913 ژن IL-17A را با افزایش خطر ابتلا به ناباروری نشان داد.
سپاسگزاری
این مقاله از پایاننامه دوره کارشناسی ارشد مصوب و دفاع شده در دانشگاه آزاد واحد کازرون استخراج شده است. نویسندگان بر خود لازم می دانند مراتب تشکر صمیمانه خود را از معاونت محترم پژوهش و فناوری دانشگاه آزاد اسلامی واحد کازرون که ما را در انجام و ارتقاء کیفی این پژوهش یاری دادند، اعلام نمایند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
طبق گزارش سازمان جهانی بهداشت word Health organization (WHO)، ناتوانی در باردار شدن، حفظ بارداری، و یا حمل حاملگی ناباروری نامیده میشود (1). بررسیها نشان می دهد که در سراسر جهان از سه تا هفت درصد از تمامی زوج ها یا زنان، یک مشکل حل نشده ناباروری دارند. با این حال، بسیاری از زوجها، تجربه اجباری نداشتن فرزند را برای حداقل یک سال دارند، که محدوده آن از 12 تا 28 درصد برآورد میشود (2). برخی مطالعات نشان می دهد، شیوع واقعی ناباروری تحت تأثیر عوامل مختلف در حال تغییر است. طی سال های اخیر، تغییر نقش زنان در فعالیت های اجتماعی، تأخیر در سن ازدواج، تغییر در سن فرزندآوری، افزایش استفاده از روش های پیشگیری از بارداری و غیره از مهم ترین علل کاهش باروری در برخی کشورهای صنعتی از جمله ایالات متحده ذکر شده اند (3). اختلالات سیستم ایمنی بدن و بیماری های خود ایمنی ممکن است شانس افراد (مردان و زنان) را برای باردارشدن تحت تاثیر قرار دهد. کارشناسان نشان داده اند که 20 درصد از تمام موارد ناباروری با علت ناشناخته ممکن است به اختلالات سیستم ایمنی بدن مرتبط باشد. زنان بهطور طبیعی سیستم ایمنی قویتری از مردان بهدلیل نقش باروری خود از جمله، محافظت جنین دارند. سلولهای ایمنی خاصی که با پاسخ التهابی (و محصولات ترشحی آنها) در ارتباط قرار دارند یک بخش ضروری از فرایند تخمکگذاری میباشند. همچنین سایتوکاینها با آمادهسازی اندومتر (پوشش داخلی رحم) برای لانهگزینی تخمک بارور در ارتباط میباشند (4).
IL-17، یک سایتوکاین پیشالتهابی است، که باعث بیان بسیاری از واسطههای التهاب میشود. از میان خانواده اینترلوکین 17، اینترلوکینIL-17A و IL-17 F اهمیت بیشتری دارا میباشند. این سیتوکاینها دارای پلیمورفیسمهایی میباشند و این چند شکلی (Polymorphism) بر روی عملکرد ژن این سیتوکاینها تاثیرگذار است. اینترلوکین 17 (IL-17) توسط سلول های Th-17 ترشح می شود و از طریق القای فاکتورهای مختلف باعث ایجاد و تقویت التهاب می شود. همچنین این سایتوکاین توسط ماکروفاژها، نوتروفیل ها، مونوسیت¬ها و سلول¬های T CD8+ نیز بیان می¬شود (5). سلولهای Th 17 سایتوکاین های متنوعی از قبیل IL-1A، IL-17F، IL-6، IL-23 ،IL-22 ،IL-21 ، IL-9 ، IL-26، GM-CSF و TNF را تولید می¬کنند، اما IL-17(IL-17A) سایتوکاین اختصاصی این سلول ها می باشد. علاوه بر اثرات مستقیم پیشالتهابی، IL-17A باعث القای تولید سایر واسطه¬های محلول از جمله IL-6، IL-1، TNF، GM-CSF، MMP و CXCL8 در سلول های مختلف می گردد، که همگی ماهیت پیش التهابی سلول های Th17 را نشان می دهند (6). محصول ژن IL-17A انسان پروتئین 150 اسید آمینه با وزن مولکولی kDa 15 است و بهعنوان یک همودیمر kDa 35-30 گلیکوپروتئین ترشح می¬شود (7).
در مطالعه انجام شده توسط دانشگاه فردوسی مشهد، سطح IL-17A در پلاسمای سمینال، مایع فولیکولی و سرم خون بیماران نابارور با تشخیص های مختلف بالینی توسط ELISA آنالیز شد. نتایج نشان داد که سطح IL-17A در پلاسمای سمینال و سرم خون بیماران واریکوسل از گروه شاهد بالاتر بود. سطح این سایتوکاین در مایع فولیکولی بیماران اندومتریوز، PCOS و بیماران با علل لوله از گروه شاهد بالاتر بود (8). مطالعه آینده¬ نگر در چین با هدف تعیین اینکه آیا زنان مبتلا به اندومتریوز سطوح مختلفی از (IL-17) را در مایع صفاقی خود دارند، در مقایسه با زنان بدون بیماری اندومتریوز انجام شد. بیماران با حداقل اندومتریوز خفیف، سطح قابلتوجهی بالاتر از IL-17 را در مایع صفاقی خود در مقایسه با کسانی که با اندومتریوز متوسط / شدید یا بدون اندومتریوز بود داشتند. غلظت IL-17 در مایع صفاق زمانی که اندومتریوز و ناباروری توام بودند، بهطور قابلتوجهی بالاتر بود. با این حال، غلظت IL-17 در مایع صفاقی به فاز چرخه قاعدگی در بیماران با یا بدون اندومتریوز بستگی ندارد. مطالعه ژانگ و همکاران نشان داد که IL-17 ممکن است نقش مهمی در پاتوژنز اندومتریوز اولیه و اندومتریوز مرتبط با ناباروری داشته باشد (9). با توجه به نکات گفته شده، با عنایت به این موضوع که یکی از اهداف مطالعات جمعیتی و پلی مورفیسم، پیدا نمودن بیومارکرهای زیستی بهعنوان یک فاکتور پیش آگهی دهنده است، هدف از انجام این تحقیق، تعیین فراوانی پلیمورفیسمژن IL-17A در موقعیت rs2275913 در بیماران مبتلا به ناباروری و مقایسه آن با خانمهای بارور میباشد .
روش بررسی
در این تحقیق موردی- شاهدی، نمونه خونی 200 خانم مبتلا به ناباروری به حجم 2CC که توسط پزشک متخصص تایید شده بود، و همچنین 2CC خون 200 خانم باردار سالم بهعنوان گروه شاهد، که از نظر سن با گروه بیمار مطابقت داشته از بیمارستان مادر و کودک شیراز جمعآوری گردید. میانگین سنی گروه بیمار و کنترل به ترتیب 5/99 ± 32/23 و 6/23 ± 32/65 میباشد، و تفاوت معناداری بین دو گروه مشاهده نمیشود. دامنه سنی افراد شرکت کننده در گروه بیمار 45-20 و در گروه کنترل 47-20 میباشد. حجم نمونه با استفاده از نرم افزار GPower 3.1.9.2 محاسبه گردید. حجم نمونه لازم برای آزمون تفاوت نسبت وجود پلیمورفیسم مورد نظر (AA) در دو گروه مستقل (گروههای مورد و شاهد) محاسبه گردید. شیوع پلیمورفیسم مورد نظر در جمعیت گروه کنترل 10درصد در نظر گرفته شد. میزان خطای آلفا و بتا به ترتیب 0/05 و 0/20 در نظر گرفته شد. حجم نمونه مورد نظر برای تعیین تفاوتی برابر 10درصد در دو جمعیت مورد و شاهد حدود 200نفر در هر گروه محاسبه گردید. نمونهگیری بیماران از نوع آسان (convenience) بوده و لازمه ورود بهمطالعه برای بیماران (inclusion criteria) تشخیص اولیه بر اساس علائم کلینیکی و تشخیص قطعی بر اساس آزمایشات پاراکلینیکی و بررسی سابقه بیمار میباشد. عدم تمایل جهت شرکت در مطالعه، وجود همزمان بیماریهای دیگر یا بیماریهایی با زمینه ایمونولوژیک و ژنتیک، دیابت، بارداری، مصرف داروهای ضدبارداری، مصرف آنتیبیوتیکهای وسیعالطیف و نیز اعتیاد به انواع مواد مخدر یا الکل در بیماران باعث حذف بیمار از مطالعه میگردد (exclusion criteria). افراد کنترل از میان مراجعین بهمطب متخصصین زنان و درمانگاههای آموزشی دانشگاه انتخاب و وارد مطالعه میشوند. لازمه ورود به مطالعه (inclusion criteria) برای افراد گروه کنترل شامل سلامت جسمانی و مطابقت با بیماران از نظر سن انجام میشود. وجود هرگونه سابقه این بیماری و بیماریهای خودایمنی و ژنتیک در خود و بستگان در جه اول باعث حذف داوطلب از ورود به مطالعه میشود (exclusion criteria). تمامی بیماران درباره تحقیق توجیه شده و تمامی ملاحظات اخلاق پزشکی، رعایت گردید. از هریک از افراد حدود 2 CC خون گرفته شد و نمونههای خون به لوله های حاوی ماده ضدانعقاد EDTA منتقل شد. نمونهها تا زمان استخراج DNA در دمای 20- Ċ نگهداری شدند. DNA ژنومی افراد مورد مطالعه به روش Salting Out با استفاده از کیت GENE ALL ساخته شده توسط کشور کره جنوبی استخراج گردید و لولههای حاوی DNA تا زمان انجام واکنش PCR در دمای -20 Ċ نگهداری شدند. در این مطالعه جهت تعیین ژنوتیپ افراد مورد مطالعه، از تکنیک PCR-RFLP استفاده شد. جهت انجام PCR و تشخیص جهش جایگاه rs2275913 در ژن IL-17A از یک جفت پرایمر اختصاصی استفاده شد (10)(جدول1). این پرایمر ها می توانند یک توالی نوکلئوتیدی بهطول 102 bp را تکثیر کنند. مواد و مقادیر مورد نیاز جهت تکثیر پلیمورفیسمrs2275913 شامل: 12/5 میکرولیترMaterMix، میکرولیتPrimer Forward1میکرولیترPrimer Revese1 میکرولیتر4/5 H2O میکرولیترDNA1 که نهایتاً حجم نهایی به 20 میکرولیتر میرسد. برنامه PCR جهت انجام تکنیک PCR-RFLP در جدول 2 آورده شده است. محصولات حاصل از PCR در حضور آنزیم XagI تحت هضم قرار گرفتند. مواد مورد نیاز جهت بررسی پلیمورفیسم-33C/T شامل: یک میکرولیتر آنزیم XagI، دو میکرولیتر بافر با غلظت ده برابر، دو میکرولیتر آب مقطر تزریقی استریل و ده میکرولیتر محصول PCR بود که نهایتاً حجم نهایی به 15 میکرولیتر میرسد. این پروتوکل پس از چند بار کم و زیاد کردن حجم مواد بهدست آمد. در نهایت توسط ژل آگارز 2%، الکتروفورز گردید. بر این اساس ژنوتیپ AA به طول 102 جفت باز، ژنوتیپ AG به طول های 34 ، 68 و 102 جفت باز و همچنین ژنوتیپ GG به طول های 34 و 68 جفت بازمیباشد. ( شکل 1)
تجزیه و تحلیل آماری
بهمنظور آنالیز دادهها و انجام تستهای آماری از نرمافزار SPSS ویرایش 24 استفاده شد. برای بیان پراکندگی، مقدارها بهصورت Mean SEM استفاده شد. جهت بررسی اختلاف توزیع ژنوتیپ ها بین دو گروه بیمار و کنترل از آزمون رگرسیون لوجستیک استفاده گردید. همچنین از آزمون آماری مربع کای و هاردی- واینبرگ استفاده شد. در تحلیل نتایج
P < 0/05 سطح معنادار در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد کازرون تایید شده است
(کد اخلاقIR.IAU.KAU.REC.1398.065 ).
جدول1: پرایمر Forward و Reverse مربوط به ژن IL-17A

جدول2: برنامه PCR جهت تکثیر پلیمورفیسم rs2275913

.jpg)
شکل1: انواع ژنوتیپ های قابل مشاهده برای پلی مورفسیم rs2275913 در ژن IL-17A با کمک تکنیک PCR-RFLP پس از هضم آنزیمی XagI بر روی ژل آگارز
نتایج
در این مطالعه، میانگین سنی گروه بیمار و کنترل به ترتیب 5/99 ± 32/23 و 6/23 ± 32/65 میباشد، و تفاوت معناداری بین دو گروه مشاهده نمیشود. دامنه سنی افراد شرکتکننده در گروه بیمار 45-20 و در گروه کنترل 47-20 میباشد. همچنین نتایج حاصل از بررسی توزیع ژنوتیپ ها در دو گروه بیمار (X2 = 2.58‚ P > 0.05 ‚ HWE P-Value = 0.1) و در گروه کنترل (X2 = 2.65‚ P > 0.05 ‚ HWE P-Value = 0.1) نشان داد که جمعیت مورد مطالعه در تعادل هاردی- واینبرگ قرار دارد. در این مطالعه برای بررسی ارتباط بین این پلیمورفیسم با ناباروری، با استفاده از آزمون آماری رگرسیون لوجستیک، فراوانی ژنوتیپی و فراوانی آللی پلیمورفیسمrs2275913 در ژن IL-17A بین دو گروه بیمار و کنترل مقایسه شد. تجزیه و تحلیل دادهها نشان داد که ژنوتیپ AG ارتباط معناداری با بیماری ناباروری دارد (P = 0.001). همچنین آلل A (Wild Allele) نیز، ارتباط معناداری با بیماری ناباروری دارد (P = 0.000) (جدول3). علاوه بر این مشخص گردید که مشکلات زمینهای بیماران از قبیل P.C.O (سندروم تخمدان پلی کیستیک) ( P = 0.02) و مشکلات لوله رحمی ( P = 0.03) ، ارتباط معناداری با پلیمورفیسمrs2275913 دارا میباشند (جدول 4).
جدول3:بررسی ارتباط پلیمورفیسمrs2275913 با ناباروری

جدول4: بررسی ارتباط بین علل ناباروری با پلیمورفیسمrs2275913 در ژن IL-17A در جمعیت بیمار

بحث
هر زوجی بنا بر سرشت ذاتی، مسائل فرهنگی، اجتماعی و خانوادگی تمایل به داشتن فرزند دارد. طبق آمار کلی، از هر هفت زوج، یک زوج بارور نمیشوند (11 و 12). هنگامی اصطلاح زوج نابارور به کار میرود که، با گذشت یک سال، بدون استفاده از روشهای پیشگیری از بارداری، بارداری رخ ندهد و اگر سن خانم بیش از 35 سال باشد، این مدت به شش ماه کاهش مییابد (12). مشکلات متفاوتی سبب ناباروری می شود. این مشکلات ممکن است مربوط به مرد، زن یا هر دو باشد، به طوریکه حدود 40درصد موارد ناباروری مربوط به مردان، 40درصد مربوط به زنان و حدود 10درصد مربوط به هر دو است و در 10درصد از زوج ها نیز عامل ناباروری مشخص نیست (12). مهمترین علل ناباروری در زنان عبارتند از: اختلالات کار تخمدان، شامل عدم تخمک گذاری، تخمدان نواری، و دیسژنزی تخمدان که علت 39درصد موارد ناباروری زنان را تشکیل میدهد (12). اشکالات لولههای رحمی که در ورود اسپرماتوزوئید و عمل گشنگیری و خروج زیگوت به داخل رحم برای لانه گزینی دخیل هستند. آندومتریوز و عفونت از عوامل مهم این گروه هستند. اختلالات در گردن رحم که مانع دخول اسپرماتوزوئید بهحفره رحم میشود. اشکالات ساختاری رحم. ناسازگاری دستگاه ایمنی بدن مادر با جنین. ناهنجاریهای کروموزومی، شامل: مونوزومی X، پلیزومی X و غیره (12 و 13). تاکنون مطالعات بسیاری در زمینه ناباروری انجام شده است. مطالعه Sukhikh و Vanko (1999) نشان داد که بین سیستم ایمنی و دستگاه تولید مثل ارتباط وجود دارد و اینترلوکین یک آلفا، اینترلوکین 6 و اینترفرون در پیشرفت باروری، لانه گزینی تخم بارور شده در رحم نقش داشته، لذا اختلال آن میتواند دلیلی بر سقط جنین و نازایی باشد (14). در این مطالعه، با استفاده از آزمون آماری رگرسیون لوجستیک، اثر پلیمورفیسمrs2275913 در ژن IL-17A مورد بررسی قرار گرفت. در این جایگاه، مقایسه فراوانی آللی نشان داد که، آلل A با احتمال دو برابری میتواند در احتمال ابتلا به ناباروری نقش داشته باشد (P < 0.05 ‚ P = 0.000‚ OR = 2.003 ‚ %95 CI = 1.460 – 2.750). همراستا با نتایج ما، تحقیقات دیگر نشان داده که پلیمورفیسم rs2275913 در ناحیه پروموتر ژن IL-17A واقع شده است. گزارش شده است که آلل A در پلیمورفیسمrs2275913 باعث افزایش بیان ژن ایترلوکین 17 در انسان میگردد (15). موقعیت rs2275913 ، به عنوان G-197A نیز شناخته میشود. این جایگاه، یک پلیمورفیسمتک نوکلئوتیدی (SNP) واقع در منطقه بالادست از ژن IL-17A در داخل موتیف اتصالی برای فاکتور هستهای فعال شده T سلول (NFAT) است که یک تنظیم کننده ضروری برای بیان IL-17 میباشد. بنابراین این پلیمورفیسم ممکن است بر تنظیمات رونویسی IL-17 تاثیر بگذارد (16). در مطالعه انجام شده، در پلیمورفیسمrs2275913 ، درصد فراوانی ژنوتیپی GG، AG و AA برای گروه بیمار بهترتیب 40درصد، 50/5 درصد و 9/5 درصد و برای گروه کنترل 60/5 درصد، 37 درصد و 2/5 درصد بود. بررسی فراوانی ژنوتیپی در پلیمورفیسم rs2275913 ژن IL-17A (P = 0.001) نشان داد که احتمال ابتلای خانمهای دارای ژنوتیپ AG و GG به ناباروری به ترتیب 2 و 5 برابر بیشتر از خانمهای دیگر میباشد. نتایج تحقیق Ohka و همکاران (2017) نشان میدهد که ژنوتیپ AA در پلیمورفیسم rs2275913، فنوتیپ مربوط به درد را افزایش میدهد که احتمالاً از طریق افزایش بیان ژن IL-17A میباشد (17). همچنین مشخص شده است که میزان بیان ژن IL-17 با بیماری های کبدی و سطح فیبروز در ارتباط است (18). سطوح افزایش یافته IL-17 با شرایط متعددی از جمله التهاب راه¬های هوایی، آرتریت روماتوئید، آبسه¬های داخل صفاق، چسبندگی ها، بیماری های التهابی روده، پس زدن پیوند آلوگرافت، پسوریازیس، سرطان و مولتیپل اسکلروزیس در ارتباط است (18). مطالعات نشان می¬دهند IL-17 در پاتوژنز آرتریت روماتویید نقش دارد (19 و 20). اینترلوکین 17 سایتوکاینی التهابی است و در افراد چاق با نشانههای زیادی از التهاب مزمن درجه خفیف در ارتباط است. سطح افزایش یافته پروتئین¬های مرحله حاد و میانجی های التهابی در سرم افراد چاق نسبت به افراد لاغر گواه بر این ادعاست (21). همچنین، نشان داده شده است که اینترلوکین 17 رگزایی را در سلول¬های سرطانی افزایش می دهد و همبستگی بالایی با تعداد عروق خونی در سرطان تخمدان در انسان دارد (22). البته در نمونه¬های انسانی نقش¬های دیگری نیز پیشنهاد شده است، از جمله نقش اینترلوکین 17 در پوکی استخوان (23). در تحقیقی که توسط دانشگاه علوم پزشکی یزد صورت گرفت مشاهده شد یک همراهی بین واریانت C2531T (P844L) در ژن MLH3 و ناباروری در مردان به علت آزواسپرمی یا الیگواسپرمی شدید و بدون علت در نمونه خون محیطی وجود دارد که این یافته¬ها پیشنهادکننده این مطلب است که این جهش ممکن است یک عامل خطر ژنتیکی برای ناباروری در مردان در ایران باشد (67-24).Lazaros و همکاران (27) TNFR1 را بهعنوان یک فاکتور خطر در استعداد ابتلا به ناباروری معرفی کردند.Tronchon و همکاران (28) در کشور فرانسه دریافتند پلیمورفیسمژن TNF-α با کاهش مقدار اسپرم ارتباط دارد. همچنین Zalata و همکاران (29) طی تحقیقاتی که روی پلیمورفیسم ژن TNF-α انجام دادند دریافتند که موجب ناباروری در مردان میشود.
نتیجهگیری
در مطالعه حاضر بر اساس نتایج حاصل از آنالیز ژنتیکی و آماری نیز ارتباط معنیداری بین پلیمورفیسمrs2275913 و بیماری ناباروری مشاهده شد. در نتیجه، مطالعه حاضر نقش آلل A در پلیمورفیسمrs2275913 ژن IL-17A را با افزایش خطر ابتلا به ناباروری نشان داد.
سپاسگزاری
این مقاله از پایاننامه دوره کارشناسی ارشد مصوب و دفاع شده در دانشگاه آزاد واحد کازرون استخراج شده است. نویسندگان بر خود لازم می دانند مراتب تشکر صمیمانه خود را از معاونت محترم پژوهش و فناوری دانشگاه آزاد اسلامی واحد کازرون که ما را در انجام و ارتقاء کیفی این پژوهش یاری دادند، اعلام نمایند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1-World Health Organization 2019. Health Topics: Infertility. Available from: http://www.who.int/ topics/infertility/ en/. Accessed November 5, 2019.
2-Fiori F, Francesca R, Elspeth G. Choosing to Remain Childless? A Comparative Study of Fertility Intentions among Women and Men in Italy and Britain. Eur J Popul 2017; 33(3): 319-50.
3-Romero R. Giants in Obstetrics and Gynecology Series: A profile of Leon Speroff, MD. American J Obstetrics and Gynecology 2017; 217(3): 263.
4-Brazdova A, Senechal H, Peltre G, Poncet P. Immune Aspects of Female Infertility. Int J Fertil Steril 2016; 10(1):1-10.
5-Kawaguchi M, Adachi M, Oda N. Kokubu F, Huang SK. IL-17 Cytokine Family. J Allergy Clinical Immunol 2004; 114(6): 1265-73.
6-Jadidi-Niaragh F, Mirshafiey A. Th17 Cell, the New Player of Neuroinflammatory Process in Multiple Sclerosis. Scand J Immunol 2011; 74(1): 1-13.
7-Moseley TA, Haudenschild DH, Rose L, Reddi AH. Interleukin-17 Family and IL-17 Receptors. Cytokine Growth Factor Rev 2003; 14(2): 155-74.
8-Sabbaghi M, Aram R, Roustaei H, Fadavi Islam M, Daneshvar M, Castaño AR, et al. Il-17a Concentration of Seminal Plasma and Follicular Fluid in Infertile Men and Women with Various Clinical Diagnoses. Immunol Invest 2014; 43(7): 617-26
9-Zhang X, Xu H, Lin J, Qian Y, Deng L. Peritoneal Fluid Concentrations of Interleukin-17 Correlate with the Severity of Endometriosis and Infertility of this Disorder. BJOG 2005; 112(8): 1153-5.
10-Wu X, Zeng Z, Chen B, Yu J, Xue L, Hao Y, et al. Association between Polymorphisms in Interleukin-17a and Interleukin 17-F Genes and Risks of Gastric Cancer. Int J Cancer 2010; 127(1): 86-92
11-Koraei A, Dasht Bozorgi Z, Zahery Abdh Vand S. The Effect of Coping Strategies on Coping with Infertility in Women: Mediator Role of Marital Quality. Avicenna J Nurs Midwifery Care 2018; 26(3): 191-202.
12-Silvestris E, D’Oronzo S, Cafforio P, D’Amato G, Loverro G. Perspective in Infertility: The Ovarian Stem Cells. J Ovarian Res 2015; 8(1): 1-9.
13-Sukhikh GT, Vanko LV. Interrelationships between Immune and Reproductive Systems in Human. Russ J Immunol 1999; 4(4): 312-4.
14-Espinoza JL, Takami A, Nakata K, Makoto Onizuka, Takakazu Kawase, Hideki Akiyama, et al. A Genetic Variant in the IL-17 Promoter is Functionally Associated with Acute Graft-Versus-Host Disease after Unrelated Bone Marrow Transplantation. Plos One 2011; 6(10): e26229.
15-Liu XK, Lin X, Gaffen SL. Crucial Role For Nuclear Factor of Activated T Cells in T Cell Receptor-Mediated Regulation of Human Interleukin-17. J Biol Chem 2004; 279(50): 52762-71.
16-Ohka S, Nishizawa D, Hasegawa J, Takahashi K, Nakayama K, Ebata Y, et al. Association Between Rs2275913 Single‐Nucleotide Polymorphism of the Interleukin‐17A Gene and Perioperative Analgesic Use in Cosmetic Orthognathic Surgery. Neuropsychopharmacol Rep 2018; 38(2): 67-74.
17-Wang L, Chen S, Xu K. IL-17 Expression is correlated with Hepatitis B-Related Liver Diseases and Fibrosis. Int J Mol Med 2010; 27(3): 385-92.
18-Witowski J, Ksiazek K, Jörres A. Interleukin- 17: A Mediator of Inflammatory Responses. Cell Mol Life Sci 2004; 61(5): 567-79.
19-Chabaud M, Durand JM, Buchs N, Fossiez F, Page G, Frappart L, et al. Human Interleukin-17: A Tcell-Derived Proinflammatory Cytokine Produced by the Rheumatoid Synovium. Arthritis Rheum 1999; 42(5): 963-70.
20-Ziolkowska M, Koc A, Luszczykiewicz G, Ksiezopolska-Pietrzak K, Klimczak E, Chwalinska- Sadowska H, et al. High Levels of IL-17 in Rheumatoid Arthritis Patients: IL-15 Triggers in Vitro IL-17 Production via Cyclosporin A-Sensitive Mechanism. J Immunol 2000; 164(5): 2832-8.
21-Dela F, Ploug T, Handberg A, Petersen, LN, Larsen JJ, Mikines KJ, Galbo H. Physical Training Increases Muscle GLUT4 Protein and Mrna in Patients with NIDDM . Diabetes 1994; (43): 862-65.
22-Kato T, Furumoto H, Ogura T, Onishi Y, Irahara M, Yamano S. Expression of IL-17 Mrna in Ovarian Cancer. Biochem Biophys Res Commun 2001; 282(3): 735-8.
23-Phielix E, Szendroedi J, Roden M. Mitochondrial Function and Insulin Resistance during Aging. Gerontol 2011; 57(5): 387-96.
24-Kunkel TA, Erie DA. DNA Mismatch Repair. Annu Rev Biochem 2005; 74: 681-710.
25-Iyer RR, Pluciennik A, Burdett V, Modrich PL. DNA Mismatch Repair: Functions and Mechanisms. Chem Rev 2006; 106(2): 302-23.
26-Jiricny J. The Multifacetedmismatch-Repair System. Nat Rev Mol Cell Biol 2006; 7(5): 335-46.
27-Lazaros LA, Xita NV, Chatzikyriakidou AL, Kaponis AI, Grigoriadis EG, Hatzi EG, et al. Association of Tnfα, TNFR1, and TNFR2 Polymorphisms with Sperm Concentration and Motility. J Androl 2012; 33(1): 74-80.
28-Tronchon V, Vialard F, El Sirkasi M, Dechaud H, Rollet J, Albert M,et al. Tumor Necrosis Factor-Alpha -308 Polymorphism in Infertile Men with Altered Sperm Production or Motility. Hum Reprod 2008; 23(12): 2858-66.
29-Zalata A, Atwa A, Badawy AEN, Aziz A, El-Baz R, Elhanbly S, et al. Tumor Necrosis Factor-α Gene Polymorphism Relationship to Seminal Variables in Infertile Men. Urology 2013; 81(5): 962-66.
نوع مطالعه: پژوهشي |
موضوع مقاله:
زنان و زایمان
دریافت: 1398/6/7 | پذیرش: 1399/4/10 | انتشار: 1399/4/10
دریافت: 1398/6/7 | پذیرش: 1399/4/10 | انتشار: 1399/4/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







