دوره 29، شماره 3 - ( خرداد 1400 )
جلد 29 شماره 3 صفحات 3565-3556 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Abdolahzadeh Z, Astani A, Mosadegh A, Hosseini Mohammad Abadi S S, Vakili M. Frequency of fimH, papC, and aer in E. coli Strains Isolated from Patients with Urinary Tract Infection, and their Antibiotic Resistance Pattern. JSSU 2021; 29 (3) :3556-3565
URL: http://jssu.ssu.ac.ir/article-1-4948-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4948-fa.html
عبدالهزاده زهرا، آستانی اکرم، مصدق احمد، حسینی محمدآبادی سعیده السادات، وکیلی محمود. فراوانی ژنهای fimH،papC وaer در ایزوله های اشرشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری یزد و بررسی الگوی مقاومت آنتیبیوتیکی آنها. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (3) :3556-3565
متن کامل [PDF 809 kb]
(924 دریافت)
| چکیده (HTML) (2109 مشاهده)
متن کامل: (1533 مشاهده)
مقدمه
عفونت مجاری ادراری (UTI: UrinaryTractInfection) از شایعترین بیماریهای عفونی خارج روده¬ای انسان است که در همه سنین اتفاق میافتد (1،2) و براساس جایگاه عفونت به سه دسته تقسیم میشوند: سیستیت، پیلونفریت، باکتری وری (3). براساس مطالعات قبلی شیوع سالانه عفونت ادراری حدود 150 تا 250 میلیون مورد در جهان می¬باشد (4-6). هشتاد تا نود درصد موارد عفونت ادراری توسط اشریشیاکلی اتفاق میافتد (7). سروتیپهایی از اشریشیاکلی که با عفونت ادراری مرتبط هستند تحت عنوان اشرشیاکلی یوروپاتوژن (UPEC:Uropathogenic Escherichia coli) شناخته میشوند (8). ایزولههای UPECبه منظور پایداری در مجرای ادراری و ایجاد بیماری دارای چندین فاکتورهای ویرولانس ضروری میباشند (3،4). این فاکتورهای ویرولانس که بهطور بالقوه باعث انتشار عفونت میشوند، به دو گروه تقسیم میشوند؛ فاکتورهای ویرولانس سطحی که باعث اتصال باکتری به بافت میزبان میشوند و فاکتورهای ویرولانس ترشحی که به سمت محل عفونت می¬روند (3،9). از نخستین ویرولانس فاکتورهای سطحی که باعث انتشار عفونت می¬شوند میتوان به ادهزینها اشاره کرد که علاوه بر نقش چسبندگی، با تشکیل بیوفیلم و انتقال سیگنالهایی به سلولهای اپیتلیال، باعث التهاب میشوند (9). فیمبریه تیپ یک و فیمبریه Pاز معمولترین و شایعترین فیمبریه ایزولههای UPEC هستند که باعث افزایش ویرولانس باکتری و مشارکت در کلونیزاسیون اولیه در مجرا میشوند (9،10). فیمبریه تیپ یک به وسیله ژن fim H کد میشود. fim H واسطه اتصال باکتری به رسپتورهای گلیکوپروتیینی حاوی مانوز میباشد که بر سطح لومینال سلولهای اپی تلیال مثانه قرار دارد (3،10). فیمبریه P به وسیله ژن (pap : Pyelonephritis associated pili) کد میشود که برای عفونت قسمت فوقانی مجاری ادراری ضروری است و با القا سیگنالهای التهابی باعث پیلونفریت حاد میشود (11). ژن papC غشای خارجی پروتئین آشر را رمزدهی می-کند که برای گردهمایی فیمبریه P مورد نیاز میباشد. تخمین زده شده است هشتاد درصد ایزولههای UPEC مرتبط با بیماران پیلونفریت، فیمبریه P دارند (9). آئروباکتین سیدروفور باکتریایی است که توسط ژن aer کد میشود و در ایزولههای مرتبط با پیلونفریت و سیستیت یافت شده است. این سیدروفور تجزیه کننده آهن بوده و سیستم انتقالی است که اشریشیاکلی به واسطه آن قادر به رشد در محیط فقیر از آهن، مثل ادرار رقیق می¬باشد. در طی چندین دهه گذشته، فراوانی عفونتهای ادراری مقاوم به آنتیبیوتیکها در سراسر دنیا افزایش یافته است. افزایش مقاومت ضدمیکروبی به طور آشکاری باعث کاهش اثرات درمانی و افزایش هزینههای درمانی و مرگ و میر میشود (12). باتوجه به شیوع عفونت ادراری در جامعه، ضرورت انجام غربالگری، تشخیص ودرمان به موقع بیماران از اهمیت بالایی برخوردار می¬باشد. به دلیل اینکه با سهلانگاری دردرمان این عفونت، مشکلات جبرانناپذیری در آینده برای بیمار رخ خواهد داد، بنابراین تحقیق حاضر با هدف بررسی میزان فراوانی ژنهای ویرولانس papC، fimH و aer در ایزولههای UPEC جدا شده از ادرار بیماران مبتلا به عفونت ادراری یزد و تعیین الگوی مقاومت آنتیبیوتیکی آنها به داروهای ضدمیکروبی بر اساس CLSI صورت پذیرفته است. آگاهی بهتر از مقاومت آنتیبیوتیکی آنها بهپزشک این امکان را میدهد که روند پیشرفت عفونت در میزبان و درمان مناسب آن را پیشبینی کند. همچنین محققین با آگاهی از شیوع ژنهای ویرولانس میتوانند کاندید مناسب واکسن را شناسایی کنند.
روش بررسی
در این مطالعه توصیفی-مقطعی، در مجموع 146 ایزوله اشریشیاکلی از نمونه¬های ادرار بیماران مراجعهکننده به بیمارستانهای شهیدصدوقی و شهدای کارگر یزد طی سال 1394 تا 1395جمع¬آوری شد. باکتری¬ها در محیط TSB/ گلیسرول در70- درجه سانتیگراد نگهداری شدند. این نمونه-ها برروی EMB(Merck آلمان) کشت داده شدند و به مدت 24 ساعت در 37 درجه سانتیگراد نگهداری شدند. پرگنههای لاکتوز مثبت با استفاده از محیط¬های افتراقی (Merck آلمان) TSI، SIM، سیمون سیترات، اوره آگار و MR-VP تعیین هویت شدند. جهت تایید مولکولی ایزولهها ازتکثیر ژن 16SRrna استفاده شد که در بخش مولکولی به آن اشاره میگردد. برای تعیین الگوی مقاومت آنتیبیوتیکی ایزوله¬ها از روش دیسک دیفیوژن بر اساس پروتکل CLSI 2015 (Clinical and Laboratory Standards Institute) استفاده شد (13). در این روش از محیط مولر هینتون آگار (Merck آلمان) و سوسپانسیون باکتریایی معادل کدورت نیم مک فارلند ودیسکهای کوتریموکسازول، سفازولین، جنتامیسین، آمیکاسین، نیتروفورانتوئین، نوروفلوکساسین، آفلوکساسین، سفکسیم، سفالکسین، سفالوتین (پادتن طب، ایران)، سیپروفلوکساسین، نالیدیکسیک اسید، فسفومایسین (MAST، انگلستان) استفاده شد. از سویه استاندارد اشریشیاکلی ATCC 25922 جهت کنترل استفاده شد. جهت استخراجDNA از روش Salting Out استفاده شد (14). کیفیتDNA استخراج شده به وسیله ژل آگارز الکتروفورز (ژل آگارز7/0%) (پدیده نوژن پارس، ایران) بررسی و غلظت DNA استخراج شده به وسیله نسبت A260/A280با استفاده از اسپکتروفتومتر (BioTekinstruments، آمریکا) اندازهگیری شد. غلظت نهایی برای هریک از مواد در واکنش PCR برای ژن 16S rRNA عبارت بود از: μl5 آب مقطر تزریقی استریل، μ l1 از هر کدام از پرایمرهای UNI_OL -Fو UNI_OL -R با غلظت 4پیکومول، μl10 از مستر میکس (Amplicon، دانمارک) و μl3 از DNA استخراج شده از پرایمرهای یونیورسال UNI_OL-F 5’-GTGTAGCGGTGAAATGCG-3’و ACGGGCGGTGTGTACAA-3’) UNI_OL–R 5’-bp709) جهت تکثیر ژن 16S rRNA استفاده شد (15). از روشPCR با استفاده از پرایمرهای اختصاصی برای شناسایی ژنهای ویرولانس papC، fim H، aer استفاده شد (جدول 1). واکنش PCR برای هرکدام از ژن¬ها در حجم 20 میکرولیتر انجام شد. حجم مواد لازم برای واکنش PCR تمامی ژنها به صورت زیر میباشد: μl10 مسترمیکسAmplicon) ، دانمارک)، μl5 آب مقطر استریل، μl25/1 از هرکدام از پرایمرهای Forward و Reverse با غلظت 4 پیکومول، μl5/2 DNA استخراج شده. تکثیر ژن 16SrRNA در دستگاه ترموسایکلر (Quantabiotech، انگلستان) شامل واسرشت اولیه در دمای °C94 به مدت 5 دقیقه و بهدنبال آن 20 چرخه شامل واسرشتگی در دمای °C94، اتصال در دمای °C53 و گسترش در دمای °C72 به مدت 30 ثانیه برای هر مرحله و یک مرحله 5 دقیقه¬ای به عنوان گسترش نهایی در °C72 بود. تکثیر ژنهای papC، fim H،aer با استفاده از دستگاه ترموسیکلر (Quantabiotech، انگلستان) و به صورت زیر انجام شد: واسرشت اولیه به مدت 5 دقیقه در °C94، 30 سیکل حرارتی شامل واسرشتگی در °C94 به مدت 30 ثانیه، دمای اتصال پرایمر در °C61 به مدت 30 ثانیه برای ژن fim H، °C5/60 برای ژن papC به مدت 30 ثانیه و °C57 برای ژنaer به مدت 30 ثانیه. دمای گسترش °C72 به مدت 30 ثانیه و یک مرحله نهایی 5 دقیقهای در °C72 به عنوان گسترش نهایی. قطعات ژن تکثیر شده با این تکنیک به وسیله الکتروفورز با استفاده از ژل 1% در کنار Ladder 50bp و با استفاده از DNA Green viewer نمایان (تصویر1، 2 ،3) و برای تایید قطعات تکثیر شده از نظر وجود ژنهای مورد نظر، از ژنهای تکثیر یافته نمونههایی جهت تعیین توالی ارسال شد.
تجزیه و تحلیل آماری
بررسی دادهها با استفاده ازSPSS version 16 و با استفاده از آزمون آماری Chi-square انجام شد.
ملاحظات اخلاقی
در مطالعه حاضر تمامی موارد مربوط به اصول اخلاق پزشکی رعایت شده است. (کد اخلاق پزشکی IR.SSU.MEDICINE.REC1396.99).
نتایج
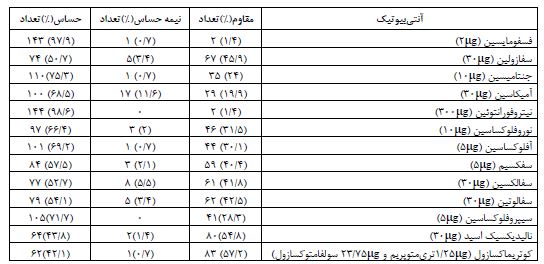
146 نمونه جمعآوری شده با روش مولکولی با استفاده ازروش PCR و ژن 16SrRNAتایید شد (شکل4). در این بررسی 17/8% ایزولهها از افراد مذکر و 82/2% ایزولهها از افراد مونث به دست آمد. 43/2% ایزولهها از مراجعهکنندگان سرپایی و 56/8%، مربوط به افراد بستری بود. از بین افراد بستری در بیمارستان، به ترتیب بیشترین (22/6%) و کمترین (0/7%) ایزولهها از بخشهای داخلی و NICU بود. در این بررسی بیشترین مقاومت نسبت به کوتریماکسازول و کمترین مقاومت نسبت به نیتروفورانتوئین و فسفومایسین وجود داشت (جدول 2).
جدول 1: مشخصات پرایمرهای اختصاصی جهت شناسایی ژنهای ویرولانس اشریشیاکلی

جدول 2: الگوی مقاومت آنتیبیوتیکی ایزولههای اشریشیاکلی (n=146)
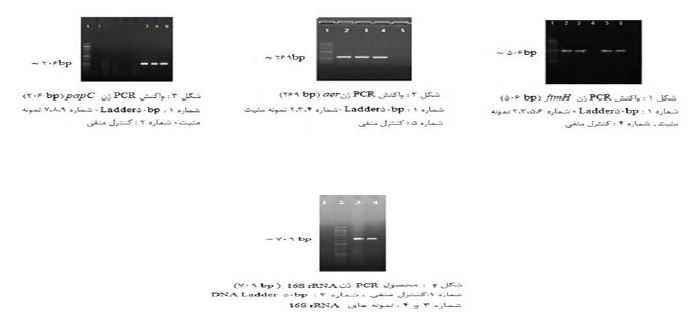
درصد فراوانی ژنهای مورد بررسی در مطالعه حاضر به ترتیب (87%) fimH، (6/85%)aerو (26%)papC بود (شکل 1،2،3).
بحث
عفونت ادراری در بین عفونتهای کسب شده از جامعه و بیمارستانی اهمیت ویژهای دارد. اشریشیاکلی عامل UTI و یکی از مهمترین عوامل عفونتهای باکتریال میباشد (4). عفونت ادراری ایجاد شده به وسیله ایزولههای اشریشیاکلی یوروپاتوژن از شایعترین عوامل ایجادکننده نارسایی کلیه میباشد و به نظر میرسد که پتانسیل بیماریزایی ایزولههای اشرشیاکلی به حضور فاکتورهای ویرولانس وابسته میباشد یافتن ارتباط بین فاکتورهای ویرولانس ایزولههای اشریشیاکلی و نوع عفونت در درمان عفونت ادراری اثر میگذارد. ادهزینها، توکسینها و فاکتورهای شلاته کننده آهن (سیدروفور) به عنوان اصلیترین فاکتورهای ویرولانس اشریشیاکلی شناخته شدهاند (18). در مطالعه حاضر 146 ایزوله اشریشیاکلی عامل عفونت ادراری طی سال 1394 تا 1395 از بیمارستان شهیدصدوقی و شهدای کارگر شهر یزد جمعآوری شد و بعد از تایید به روش مولکولی با استفاده از 16S rRNA، حضور ژنهای ویرولانس papC، fim H، aerبا استفاده از روش PCR بررسی شد. درصد فراوانی ژنهای مورد بررسی در مطالعه حاضر به ترتیب (87%) fimH، (85/6%) aer و (%26) papC بود. درمان با آنتیبیوتیک اولین و مهمترین اقدام به منظور کنترل عامل مهاجم میباشد. مصرف بیش از اندازه و ناآگاهانه داروهای ضدمیکروبی باعث نارسایی در درمان و نگرانیهای پیرامون آن میشود (19). بدین منظور الگوی مقاومت آنتیبیوتیکی ایزولهها براساس جدول CLSI2015 مورد بررسی قرار گرفت (جدول 2). چندین مطالعه ارتباط بین مقاومت آنتیبیوتیکی و ویرولانس فاکتورها را در ایزولههای UPEC گزارش کردهاند. حضور ژن های ویرولانس معین ممکن است به مکانیسم عمل آنتیبیوتیکها یا واکنشهای ناشناخته بین فاکتورهای ویرولانس و آنتیبیوتیکها مربوط باشد (20). در مطالعه حاضر ارتباط آماری معنیداری بین ژنهای ویرولانس مورد بررسی و مقاومت آنتیبیوتیکی ایزولههای UPEC یافت نشد (P>0/05). در مطالعه حاضر (87%) fimH، بیشترین فراوانی را داشت. بالا بودن درصد ژن fim H در این مطالعه احتمالاً به بیماریزایی ایزولهها مربوط است، زیرا چسبندگی و اتصال باکتری به سطوح اورواپیتلیال مهمترین عامل جهت آغاز بیماریزایی است. fim H در ایزولههای UPEC به شدت حفظ شده است که تعیین کننده نقش آن در کلونیزاسیون باکتری در مجاری ادراری است و با مطالعات دیگر همخوانی دارد (18). در مطالعه نعمتی و همکاران در سال 2013 تا 2012 در کاشان از بین 150 ایزوله اشریشیاکلی جدا شده از عفونت ادراری بیمارستان شهید بهشتی کاشان شیوع ژنهای (30/6%)aer و (16/6%) papC گزارش شده است (12). در مطالعهای دیگر که به وسیله تیبا و همکاران در سال 2008 در برزیل انجام شد، از بین 162 ایزوله اشرشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری شیوع ژنهای (97/5%) fimH و (32/7%)papC گزارش شده است (1) که نزدیک به نتایج مطالعه حاضر میباشد و بالا بودن درصد fimH نشاندهنده این است که فیمبریه نوع یک، یک ویرولانس فاکتور مهم است و چسبندگی به واسطه آن نقش مهمی در آغاز التهاب دارد که باعث افزایش ویرولانس اشریشیاکلی در مجرای ادراری میشود. در مطالعه اسدی و همکاران، 2011 تا2010، در بیمارستان پیمانیه جهرم از بین 60 ایزوله اشرشیاکلی جدا شده از عفونت ادراری، فراوانی ژنهای (56/7%) fim Hو (53/3%)papC گزارش شده است. همچنین 45% ایزولهها به کوتریماکسازول، 41/7% به نالیدیکسیکاسید، 21/7% به سیپروفلوکساسین،20% به سفکسیم، 16/7% به سفالکسین، 13/3% به آمیکاسین، 11/7% به جنتامیسین و 3/3% به نیتروفورانتوئین مقاوم بودند، (4) که با نتایج الگوی مقاومت آنتیبیوتیکی مطالعه حاضر مغایرت دارد که این تفاوت میتواند به دلیل تفاوت مناطق جغرافیایی باشد. در مطالعهSANTO و همکاران در سال2000 در کشور برزیل فراوانی ژنهای (%11) papC و (76 %) aer گزارش شده است (11) که به مطالعه حاضر نزدیک میباشد. آئروباکتین (عامل شلاته کننده آهن)، باعث کلونیزاسیون باکتری در محیطهای فقیر از آهن مثل ادرار رقیق میشود اپرون ژن aer در شرایط فقر آهن فعال میشود تا باکتری بتواند در این شرایط زنده بماند در واقع آئروباکتین باعث ترشح Fe+3 از سلول میزبان میشود (10) که در مطالعه حاضر فراوانی بالای این ژن نشاندهنده نقش مهم این ژن در کلونیزاسیون باکتری در مجاری ادراری میباشد و با مطالعه رئیسپور و همکارانش همخوانی دارد (21). در مطالعه Tarchouna و همکاران در 2009 تا 2008 در تونس، از بین 90 ایزوله اشریشیاکلی جدا شده از بیماران با عفونت ادراری شیوع (68%) fim H، (41%) papC، (52%) aer گزارش شده است (2). در مطالعه LOPEZ و همکاران در 2014 در مکزیک، از بین 108 ایزوله اشریشیاکلی جدا شده از زنان مبتلا به عفونت ادراری درصد فراوانی ژنهای (86%) fim Hو (62%) papCبوده است. 75/9% ایزولهها به آمپیسیلین/ سولباکتام، 62/3% به سیپروفلوکساسین، 60/2% به لووفلوکساسین، 56/1% به کوتریماکسازول، 55/2% به آمپیسیلین، 52/6% به موکسیفلوکساسین، 51/1% به پیپراسیلین، 34/1% به سفازولین، 28/9% به سفکسیم، 27/8% به جنتامیسین، 22/1% به سفتازیدیم، 21/9% به سفتریاکسون، 21/9% به سفپیم، 21/1% به سفوتاکسیم، 6/5% به آمیکاسین، 0/9% به سفوکسیتین، 0/6% به سفوتتان مقاوم بودند (5). در مطالعه Hassan و همکاران در مصر از بین 111 نمونه جمع آوری شده از بیماران مبتلا به عفونت ادراری،40 ایزوله اشریشیاکلی یافت شد که (31%) fim Hو (69%) pap C گزارش شده است که با نتایج مطالعه حاضر مغایرت دارد. حضور ژن pap با پیلونفریت مرتبط است، بنابراین پایین بودن درصد ژن pap در مطالعه حاضر ممکن است بیانگر توانایی کمتر ایزولهها در کلونیزاسیون کلیه و ایجاد پیلونفریت باشد. همچنین در مطالعه Hassan 100% ایزولهها به آمیکاسین، 67% به نیتروفورانتوئین، 62% به جنتامیسین، 32% به نوروفلوکساسین، 32% به آفلوکساسین، 27% به سیپروفلوکساسین، 25% به کوتریماکسازول و 5% به آمپیسیلین، حساس بودند (17). در مطالعه پیمانی و همکاران طی سال 1393تا 1392 در بخش مراقبتهای ویژه کرج و قزوین، از بین 120 ایزوله اشریشیاکلی جدا شده از ادرار بیماران مبتلا به عفونت دستگاه ادراری (88/3%) fim H و (59/2%) papC گزارش شده است (22). در مطالعه کریمیان و همکاران در بیمارستان بقیهالله تهران طی سال 2012 از بین 123 ایزوله اشریشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری (69/67%) fim Hو (50/4%) papC گزارش شده است (7). در مطالعهای از رومانی طی 2007 تا 2006 از بین 60 ایزوله اشریشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری (53/3%) aerو (80%)fim H گزارش شده است (23). در مطالعه بهالو و همکاران در 2011 در شهرکرد از بین 100 ایزوله اشریشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری (30%) fimH، (40%papC ( و (12%) aer گزارش شده است که با نتایج مطالعه حاضر همخوانی ندارد و ممکن است ایزولههای مورد بررسی در مطالعه بهالو از فاکتورهای ویرولانس دیگری استفاده کنند (24). Zhao در سال 2009 شیوع ویرولانس فاکتورها و مقاومت آنتیبیوتیکی رادر ایزولههای اشریشیاکلی جدا شده از افراد مبتلا به عفونت ادراری در Jiangsu چین مورد بررسی قرار داد. فراوانی fimH و papC به ترتیب 92%، 54% بود. 93% ایزولهها به نالیدیکسیکاسید.90% به آمپیسیلین،90% به مزلوسیلین، 86% به تتراسیکلین، 74% به سیپروفلوکساسین، 73% به تریمتوپریمسولفامتوکسازول، 71% به لووفلوکساسین، 68% به کانامایسین، 63% به جنتامیسین، 51% به سفوتاکسیم، 36% به کلرامفنیکل، 23% به نیتروفورا نتوئین،22% به سفوکسیتین و 4% به ایمیپنم مقاوم بودند (25). از کاستیهای مطالعه حاضر میتوان به محدودیت جمعیت مورد مطالعه و عدم بررسی تمامی ژنهای ویرولانس اشریشیاکلی اشاره کرد. اشریشیاکلی فاکتورهای ویرولانس متعددی دارد. آنچه در مطالعه حاضر مهم و بارز به نظر میرسد وجود شاخصتر ژن fim H نسبت به ادهزین papC میباشد. در واقع نقش این ژن در ظهور باکتری اوری ناشی از اشرشیاکلی در بیماران چشمگیر است (26). از آنجا که پروتئین fim H فاقد تنوع ژنتیکی میباشد، از اینرو در بیشتر مطالعات انجام شده در مورد تهیه واکسن علیه عفونت ادراری این پروتئین مدنظر بوده است همچنین در مطالعه حاضر درصد فراوانی ژن aer نسبت به مطالعات قبلی بیشتر می¬باشد که شاید یکی از علل آن، نقش مهم این ژن در پایداری باکتری و مقاومت آن در برابر سیستم ایمنی بدن است. افزایش مقاومت آنتیبیوتیکی در جامعه ممکن است ناشی از استفاده نامناسب از آنتیبیوتیک، استفاده مداوم از آنتیبیوتیک در کشاورزی و حیوانات و برنامههای غیر موثر کنترل عفونت باشد. تخمین زده میشود که 80 تا 90 درصد داروهای ضدمیکروبی توسط افراد عادی و 10 تا 20 درصد باقیمانده توسط افراد بستری در بیمارستان مصرف میشود (20). براساس یافته¬های مطالعه حاضر، ایزولههای جدا شده از بیماران مقاومت کمی به فسفومایسین و نیتروفورانتوئین دارند. همچنین ایزوله¬ها مقاومت نسبتاً بالایی به نالیدیکسیک اسید وکوتریماکسازول دارند که احتمالاً ناشی از استفاده زیاد از این آنتیبیوتیکها در درمان عفونت ادراری می¬باشد.
نتیجهگیری
مطالعه حاضر، اولین مطالعه انجام شده از فراوانی ژنهای fim H، papC،aer اشریشیاکلی در شهر یزد میباشد. نتایج مطالعه حاضر نشان میدهد فراوانی ژن fim H بیشتر از دو ژن دیگر میباشد و از آنجا که اولین مرحله برای ایجاد عفونت اتصال باکتری است و فیمبریه نقش مهم و کلیدی را برای اتصال فراهم میکند، این موضوع میتواند نقطه عطفی باشد تا در مطالعات بعدی به فکر طراحی واکسن علیه این فاکتور ویرولانس باشیم تا بدین طریق بتوانیم از ایجاد این عفونت در جامعه جلوگیری کنیم. مطالعات قبلی روی fim Hنشان داده است که واکسن حاصل از fim H توانسته است موشهای ایمن شده را به صورت فعال و غیرفعال در برابر اشریشیاکلی یوروپاتوژن محافظت کند. همچنین مطالعه روی سرم حیوانات واکسینه شده با fim H نشان داده که این واکسن میتواند از اتصال باکتری یوروپاتوژن به سلولهای مثانه انسان در شرایط آزمایشگاهی جلوگیری کند (27). برای ارزیابی دقیقتر پیشنهاد میشود تا در مطالعات دیگر حضور دیگر عوامل ویرولانس نیز مورد بررسی قرار گیرد تا بتوان مقایسهای بین این فاکتورها انجام داد. در نتیجه به دلیل شیوع فراوان عفونت ادراری در حضور این ژنها تشخیص سریع آنها در نمونهها میتواند به درمان و مدیریت سریع بیماری کمک کند و از هزینههای زیادی که هر ساله برای درمان عفونت ادراری بر جامعه و خانواده بیمار تحمیل میشود جلوگیری کرد. همچنین براساس نتایج این مطالعه، پیشنهاد میشود استفاده منطقی از داروهای موثر و به کارگیری ابزارهای مناسب کنترل در محیطهای بیمارستانی مورد توجه پزشکان و متخصصین کنترل عفونت قرار بگیرد. همچنین پیشنهاد میشود که با آموزش راهکارهای مناسب کنترل عفونت، به پرسنل پزشکی بخشهای بیمارستانی از بروز و گسترش عفونتهای ادراری در جامعه و مراکز درمانی جلوگیری کرد و سایر فاکتورهای بیماریزایی این ارگانیسم در سایر مناطق جغرافیایی کشور مورد بررسی قرار بگیرد تا اطلاعات جامعتری در بحث پیشگیری، درمان و نحوه مدیریت عفونتهای ناشی از این ارگانیسم در اختیار محققین قرار بگیرد.
سپاسگزاری
این مقاله برگرفته از پایاننامه دوره کارشناسی ارشد میکروب شناسی پزشکی دانشگاه علوم پزشکی شهید صدوقی یزد میباشد. نویسندگان این مقاله لازم میدانند از کارکنان آزمایشگاه میکروب شناسی دانشگاه علوم پزشکی شهید صدوقی یزد، بیمارستان شهیدصدوقی و شهدای کارگر یزد برای زحمات بیدریغشان قدردانی نمایند.
حامی مالی: این پایاننامه تحقیقاتی با حمایت مالی دانشگاه علوم پزشکی شهید صدوقی یزد صورت گرفته است.
تعارض در منافع: وجود ندارد.
عفونت مجاری ادراری (UTI: UrinaryTractInfection) از شایعترین بیماریهای عفونی خارج روده¬ای انسان است که در همه سنین اتفاق میافتد (1،2) و براساس جایگاه عفونت به سه دسته تقسیم میشوند: سیستیت، پیلونفریت، باکتری وری (3). براساس مطالعات قبلی شیوع سالانه عفونت ادراری حدود 150 تا 250 میلیون مورد در جهان می¬باشد (4-6). هشتاد تا نود درصد موارد عفونت ادراری توسط اشریشیاکلی اتفاق میافتد (7). سروتیپهایی از اشریشیاکلی که با عفونت ادراری مرتبط هستند تحت عنوان اشرشیاکلی یوروپاتوژن (UPEC:Uropathogenic Escherichia coli) شناخته میشوند (8). ایزولههای UPECبه منظور پایداری در مجرای ادراری و ایجاد بیماری دارای چندین فاکتورهای ویرولانس ضروری میباشند (3،4). این فاکتورهای ویرولانس که بهطور بالقوه باعث انتشار عفونت میشوند، به دو گروه تقسیم میشوند؛ فاکتورهای ویرولانس سطحی که باعث اتصال باکتری به بافت میزبان میشوند و فاکتورهای ویرولانس ترشحی که به سمت محل عفونت می¬روند (3،9). از نخستین ویرولانس فاکتورهای سطحی که باعث انتشار عفونت می¬شوند میتوان به ادهزینها اشاره کرد که علاوه بر نقش چسبندگی، با تشکیل بیوفیلم و انتقال سیگنالهایی به سلولهای اپیتلیال، باعث التهاب میشوند (9). فیمبریه تیپ یک و فیمبریه Pاز معمولترین و شایعترین فیمبریه ایزولههای UPEC هستند که باعث افزایش ویرولانس باکتری و مشارکت در کلونیزاسیون اولیه در مجرا میشوند (9،10). فیمبریه تیپ یک به وسیله ژن fim H کد میشود. fim H واسطه اتصال باکتری به رسپتورهای گلیکوپروتیینی حاوی مانوز میباشد که بر سطح لومینال سلولهای اپی تلیال مثانه قرار دارد (3،10). فیمبریه P به وسیله ژن (pap : Pyelonephritis associated pili) کد میشود که برای عفونت قسمت فوقانی مجاری ادراری ضروری است و با القا سیگنالهای التهابی باعث پیلونفریت حاد میشود (11). ژن papC غشای خارجی پروتئین آشر را رمزدهی می-کند که برای گردهمایی فیمبریه P مورد نیاز میباشد. تخمین زده شده است هشتاد درصد ایزولههای UPEC مرتبط با بیماران پیلونفریت، فیمبریه P دارند (9). آئروباکتین سیدروفور باکتریایی است که توسط ژن aer کد میشود و در ایزولههای مرتبط با پیلونفریت و سیستیت یافت شده است. این سیدروفور تجزیه کننده آهن بوده و سیستم انتقالی است که اشریشیاکلی به واسطه آن قادر به رشد در محیط فقیر از آهن، مثل ادرار رقیق می¬باشد. در طی چندین دهه گذشته، فراوانی عفونتهای ادراری مقاوم به آنتیبیوتیکها در سراسر دنیا افزایش یافته است. افزایش مقاومت ضدمیکروبی به طور آشکاری باعث کاهش اثرات درمانی و افزایش هزینههای درمانی و مرگ و میر میشود (12). باتوجه به شیوع عفونت ادراری در جامعه، ضرورت انجام غربالگری، تشخیص ودرمان به موقع بیماران از اهمیت بالایی برخوردار می¬باشد. به دلیل اینکه با سهلانگاری دردرمان این عفونت، مشکلات جبرانناپذیری در آینده برای بیمار رخ خواهد داد، بنابراین تحقیق حاضر با هدف بررسی میزان فراوانی ژنهای ویرولانس papC، fimH و aer در ایزولههای UPEC جدا شده از ادرار بیماران مبتلا به عفونت ادراری یزد و تعیین الگوی مقاومت آنتیبیوتیکی آنها به داروهای ضدمیکروبی بر اساس CLSI صورت پذیرفته است. آگاهی بهتر از مقاومت آنتیبیوتیکی آنها بهپزشک این امکان را میدهد که روند پیشرفت عفونت در میزبان و درمان مناسب آن را پیشبینی کند. همچنین محققین با آگاهی از شیوع ژنهای ویرولانس میتوانند کاندید مناسب واکسن را شناسایی کنند.
روش بررسی
در این مطالعه توصیفی-مقطعی، در مجموع 146 ایزوله اشریشیاکلی از نمونه¬های ادرار بیماران مراجعهکننده به بیمارستانهای شهیدصدوقی و شهدای کارگر یزد طی سال 1394 تا 1395جمع¬آوری شد. باکتری¬ها در محیط TSB/ گلیسرول در70- درجه سانتیگراد نگهداری شدند. این نمونه-ها برروی EMB(Merck آلمان) کشت داده شدند و به مدت 24 ساعت در 37 درجه سانتیگراد نگهداری شدند. پرگنههای لاکتوز مثبت با استفاده از محیط¬های افتراقی (Merck آلمان) TSI، SIM، سیمون سیترات، اوره آگار و MR-VP تعیین هویت شدند. جهت تایید مولکولی ایزولهها ازتکثیر ژن 16SRrna استفاده شد که در بخش مولکولی به آن اشاره میگردد. برای تعیین الگوی مقاومت آنتیبیوتیکی ایزوله¬ها از روش دیسک دیفیوژن بر اساس پروتکل CLSI 2015 (Clinical and Laboratory Standards Institute) استفاده شد (13). در این روش از محیط مولر هینتون آگار (Merck آلمان) و سوسپانسیون باکتریایی معادل کدورت نیم مک فارلند ودیسکهای کوتریموکسازول، سفازولین، جنتامیسین، آمیکاسین، نیتروفورانتوئین، نوروفلوکساسین، آفلوکساسین، سفکسیم، سفالکسین، سفالوتین (پادتن طب، ایران)، سیپروفلوکساسین، نالیدیکسیک اسید، فسفومایسین (MAST، انگلستان) استفاده شد. از سویه استاندارد اشریشیاکلی ATCC 25922 جهت کنترل استفاده شد. جهت استخراجDNA از روش Salting Out استفاده شد (14). کیفیتDNA استخراج شده به وسیله ژل آگارز الکتروفورز (ژل آگارز7/0%) (پدیده نوژن پارس، ایران) بررسی و غلظت DNA استخراج شده به وسیله نسبت A260/A280با استفاده از اسپکتروفتومتر (BioTekinstruments، آمریکا) اندازهگیری شد. غلظت نهایی برای هریک از مواد در واکنش PCR برای ژن 16S rRNA عبارت بود از: μl5 آب مقطر تزریقی استریل، μ l1 از هر کدام از پرایمرهای UNI_OL -Fو UNI_OL -R با غلظت 4پیکومول، μl10 از مستر میکس (Amplicon، دانمارک) و μl3 از DNA استخراج شده از پرایمرهای یونیورسال UNI_OL-F 5’-GTGTAGCGGTGAAATGCG-3’و ACGGGCGGTGTGTACAA-3’) UNI_OL–R 5’-bp709) جهت تکثیر ژن 16S rRNA استفاده شد (15). از روشPCR با استفاده از پرایمرهای اختصاصی برای شناسایی ژنهای ویرولانس papC، fim H، aer استفاده شد (جدول 1). واکنش PCR برای هرکدام از ژن¬ها در حجم 20 میکرولیتر انجام شد. حجم مواد لازم برای واکنش PCR تمامی ژنها به صورت زیر میباشد: μl10 مسترمیکسAmplicon) ، دانمارک)، μl5 آب مقطر استریل، μl25/1 از هرکدام از پرایمرهای Forward و Reverse با غلظت 4 پیکومول، μl5/2 DNA استخراج شده. تکثیر ژن 16SrRNA در دستگاه ترموسایکلر (Quantabiotech، انگلستان) شامل واسرشت اولیه در دمای °C94 به مدت 5 دقیقه و بهدنبال آن 20 چرخه شامل واسرشتگی در دمای °C94، اتصال در دمای °C53 و گسترش در دمای °C72 به مدت 30 ثانیه برای هر مرحله و یک مرحله 5 دقیقه¬ای به عنوان گسترش نهایی در °C72 بود. تکثیر ژنهای papC، fim H،aer با استفاده از دستگاه ترموسیکلر (Quantabiotech، انگلستان) و به صورت زیر انجام شد: واسرشت اولیه به مدت 5 دقیقه در °C94، 30 سیکل حرارتی شامل واسرشتگی در °C94 به مدت 30 ثانیه، دمای اتصال پرایمر در °C61 به مدت 30 ثانیه برای ژن fim H، °C5/60 برای ژن papC به مدت 30 ثانیه و °C57 برای ژنaer به مدت 30 ثانیه. دمای گسترش °C72 به مدت 30 ثانیه و یک مرحله نهایی 5 دقیقهای در °C72 به عنوان گسترش نهایی. قطعات ژن تکثیر شده با این تکنیک به وسیله الکتروفورز با استفاده از ژل 1% در کنار Ladder 50bp و با استفاده از DNA Green viewer نمایان (تصویر1، 2 ،3) و برای تایید قطعات تکثیر شده از نظر وجود ژنهای مورد نظر، از ژنهای تکثیر یافته نمونههایی جهت تعیین توالی ارسال شد.
تجزیه و تحلیل آماری
بررسی دادهها با استفاده ازSPSS version 16 و با استفاده از آزمون آماری Chi-square انجام شد.
ملاحظات اخلاقی
در مطالعه حاضر تمامی موارد مربوط به اصول اخلاق پزشکی رعایت شده است. (کد اخلاق پزشکی IR.SSU.MEDICINE.REC1396.99).
نتایج
146 نمونه جمعآوری شده با روش مولکولی با استفاده ازروش PCR و ژن 16SrRNAتایید شد (شکل4). در این بررسی 17/8% ایزولهها از افراد مذکر و 82/2% ایزولهها از افراد مونث به دست آمد. 43/2% ایزولهها از مراجعهکنندگان سرپایی و 56/8%، مربوط به افراد بستری بود. از بین افراد بستری در بیمارستان، به ترتیب بیشترین (22/6%) و کمترین (0/7%) ایزولهها از بخشهای داخلی و NICU بود. در این بررسی بیشترین مقاومت نسبت به کوتریماکسازول و کمترین مقاومت نسبت به نیتروفورانتوئین و فسفومایسین وجود داشت (جدول 2).
جدول 1: مشخصات پرایمرهای اختصاصی جهت شناسایی ژنهای ویرولانس اشریشیاکلی

جدول 2: الگوی مقاومت آنتیبیوتیکی ایزولههای اشریشیاکلی (n=146)


درصد فراوانی ژنهای مورد بررسی در مطالعه حاضر به ترتیب (87%) fimH، (6/85%)aerو (26%)papC بود (شکل 1،2،3).
بحث
عفونت ادراری در بین عفونتهای کسب شده از جامعه و بیمارستانی اهمیت ویژهای دارد. اشریشیاکلی عامل UTI و یکی از مهمترین عوامل عفونتهای باکتریال میباشد (4). عفونت ادراری ایجاد شده به وسیله ایزولههای اشریشیاکلی یوروپاتوژن از شایعترین عوامل ایجادکننده نارسایی کلیه میباشد و به نظر میرسد که پتانسیل بیماریزایی ایزولههای اشرشیاکلی به حضور فاکتورهای ویرولانس وابسته میباشد یافتن ارتباط بین فاکتورهای ویرولانس ایزولههای اشریشیاکلی و نوع عفونت در درمان عفونت ادراری اثر میگذارد. ادهزینها، توکسینها و فاکتورهای شلاته کننده آهن (سیدروفور) به عنوان اصلیترین فاکتورهای ویرولانس اشریشیاکلی شناخته شدهاند (18). در مطالعه حاضر 146 ایزوله اشریشیاکلی عامل عفونت ادراری طی سال 1394 تا 1395 از بیمارستان شهیدصدوقی و شهدای کارگر شهر یزد جمعآوری شد و بعد از تایید به روش مولکولی با استفاده از 16S rRNA، حضور ژنهای ویرولانس papC، fim H، aerبا استفاده از روش PCR بررسی شد. درصد فراوانی ژنهای مورد بررسی در مطالعه حاضر به ترتیب (87%) fimH، (85/6%) aer و (%26) papC بود. درمان با آنتیبیوتیک اولین و مهمترین اقدام به منظور کنترل عامل مهاجم میباشد. مصرف بیش از اندازه و ناآگاهانه داروهای ضدمیکروبی باعث نارسایی در درمان و نگرانیهای پیرامون آن میشود (19). بدین منظور الگوی مقاومت آنتیبیوتیکی ایزولهها براساس جدول CLSI2015 مورد بررسی قرار گرفت (جدول 2). چندین مطالعه ارتباط بین مقاومت آنتیبیوتیکی و ویرولانس فاکتورها را در ایزولههای UPEC گزارش کردهاند. حضور ژن های ویرولانس معین ممکن است به مکانیسم عمل آنتیبیوتیکها یا واکنشهای ناشناخته بین فاکتورهای ویرولانس و آنتیبیوتیکها مربوط باشد (20). در مطالعه حاضر ارتباط آماری معنیداری بین ژنهای ویرولانس مورد بررسی و مقاومت آنتیبیوتیکی ایزولههای UPEC یافت نشد (P>0/05). در مطالعه حاضر (87%) fimH، بیشترین فراوانی را داشت. بالا بودن درصد ژن fim H در این مطالعه احتمالاً به بیماریزایی ایزولهها مربوط است، زیرا چسبندگی و اتصال باکتری به سطوح اورواپیتلیال مهمترین عامل جهت آغاز بیماریزایی است. fim H در ایزولههای UPEC به شدت حفظ شده است که تعیین کننده نقش آن در کلونیزاسیون باکتری در مجاری ادراری است و با مطالعات دیگر همخوانی دارد (18). در مطالعه نعمتی و همکاران در سال 2013 تا 2012 در کاشان از بین 150 ایزوله اشریشیاکلی جدا شده از عفونت ادراری بیمارستان شهید بهشتی کاشان شیوع ژنهای (30/6%)aer و (16/6%) papC گزارش شده است (12). در مطالعهای دیگر که به وسیله تیبا و همکاران در سال 2008 در برزیل انجام شد، از بین 162 ایزوله اشرشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری شیوع ژنهای (97/5%) fimH و (32/7%)papC گزارش شده است (1) که نزدیک به نتایج مطالعه حاضر میباشد و بالا بودن درصد fimH نشاندهنده این است که فیمبریه نوع یک، یک ویرولانس فاکتور مهم است و چسبندگی به واسطه آن نقش مهمی در آغاز التهاب دارد که باعث افزایش ویرولانس اشریشیاکلی در مجرای ادراری میشود. در مطالعه اسدی و همکاران، 2011 تا2010، در بیمارستان پیمانیه جهرم از بین 60 ایزوله اشرشیاکلی جدا شده از عفونت ادراری، فراوانی ژنهای (56/7%) fim Hو (53/3%)papC گزارش شده است. همچنین 45% ایزولهها به کوتریماکسازول، 41/7% به نالیدیکسیکاسید، 21/7% به سیپروفلوکساسین،20% به سفکسیم، 16/7% به سفالکسین، 13/3% به آمیکاسین، 11/7% به جنتامیسین و 3/3% به نیتروفورانتوئین مقاوم بودند، (4) که با نتایج الگوی مقاومت آنتیبیوتیکی مطالعه حاضر مغایرت دارد که این تفاوت میتواند به دلیل تفاوت مناطق جغرافیایی باشد. در مطالعهSANTO و همکاران در سال2000 در کشور برزیل فراوانی ژنهای (%11) papC و (76 %) aer گزارش شده است (11) که به مطالعه حاضر نزدیک میباشد. آئروباکتین (عامل شلاته کننده آهن)، باعث کلونیزاسیون باکتری در محیطهای فقیر از آهن مثل ادرار رقیق میشود اپرون ژن aer در شرایط فقر آهن فعال میشود تا باکتری بتواند در این شرایط زنده بماند در واقع آئروباکتین باعث ترشح Fe+3 از سلول میزبان میشود (10) که در مطالعه حاضر فراوانی بالای این ژن نشاندهنده نقش مهم این ژن در کلونیزاسیون باکتری در مجاری ادراری میباشد و با مطالعه رئیسپور و همکارانش همخوانی دارد (21). در مطالعه Tarchouna و همکاران در 2009 تا 2008 در تونس، از بین 90 ایزوله اشریشیاکلی جدا شده از بیماران با عفونت ادراری شیوع (68%) fim H، (41%) papC، (52%) aer گزارش شده است (2). در مطالعه LOPEZ و همکاران در 2014 در مکزیک، از بین 108 ایزوله اشریشیاکلی جدا شده از زنان مبتلا به عفونت ادراری درصد فراوانی ژنهای (86%) fim Hو (62%) papCبوده است. 75/9% ایزولهها به آمپیسیلین/ سولباکتام، 62/3% به سیپروفلوکساسین، 60/2% به لووفلوکساسین، 56/1% به کوتریماکسازول، 55/2% به آمپیسیلین، 52/6% به موکسیفلوکساسین، 51/1% به پیپراسیلین، 34/1% به سفازولین، 28/9% به سفکسیم، 27/8% به جنتامیسین، 22/1% به سفتازیدیم، 21/9% به سفتریاکسون، 21/9% به سفپیم، 21/1% به سفوتاکسیم، 6/5% به آمیکاسین، 0/9% به سفوکسیتین، 0/6% به سفوتتان مقاوم بودند (5). در مطالعه Hassan و همکاران در مصر از بین 111 نمونه جمع آوری شده از بیماران مبتلا به عفونت ادراری،40 ایزوله اشریشیاکلی یافت شد که (31%) fim Hو (69%) pap C گزارش شده است که با نتایج مطالعه حاضر مغایرت دارد. حضور ژن pap با پیلونفریت مرتبط است، بنابراین پایین بودن درصد ژن pap در مطالعه حاضر ممکن است بیانگر توانایی کمتر ایزولهها در کلونیزاسیون کلیه و ایجاد پیلونفریت باشد. همچنین در مطالعه Hassan 100% ایزولهها به آمیکاسین، 67% به نیتروفورانتوئین، 62% به جنتامیسین، 32% به نوروفلوکساسین، 32% به آفلوکساسین، 27% به سیپروفلوکساسین، 25% به کوتریماکسازول و 5% به آمپیسیلین، حساس بودند (17). در مطالعه پیمانی و همکاران طی سال 1393تا 1392 در بخش مراقبتهای ویژه کرج و قزوین، از بین 120 ایزوله اشریشیاکلی جدا شده از ادرار بیماران مبتلا به عفونت دستگاه ادراری (88/3%) fim H و (59/2%) papC گزارش شده است (22). در مطالعه کریمیان و همکاران در بیمارستان بقیهالله تهران طی سال 2012 از بین 123 ایزوله اشریشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری (69/67%) fim Hو (50/4%) papC گزارش شده است (7). در مطالعهای از رومانی طی 2007 تا 2006 از بین 60 ایزوله اشریشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری (53/3%) aerو (80%)fim H گزارش شده است (23). در مطالعه بهالو و همکاران در 2011 در شهرکرد از بین 100 ایزوله اشریشیاکلی جدا شده از بیماران مبتلا به عفونت ادراری (30%) fimH، (40%papC ( و (12%) aer گزارش شده است که با نتایج مطالعه حاضر همخوانی ندارد و ممکن است ایزولههای مورد بررسی در مطالعه بهالو از فاکتورهای ویرولانس دیگری استفاده کنند (24). Zhao در سال 2009 شیوع ویرولانس فاکتورها و مقاومت آنتیبیوتیکی رادر ایزولههای اشریشیاکلی جدا شده از افراد مبتلا به عفونت ادراری در Jiangsu چین مورد بررسی قرار داد. فراوانی fimH و papC به ترتیب 92%، 54% بود. 93% ایزولهها به نالیدیکسیکاسید.90% به آمپیسیلین،90% به مزلوسیلین، 86% به تتراسیکلین، 74% به سیپروفلوکساسین، 73% به تریمتوپریمسولفامتوکسازول، 71% به لووفلوکساسین، 68% به کانامایسین، 63% به جنتامیسین، 51% به سفوتاکسیم، 36% به کلرامفنیکل، 23% به نیتروفورا نتوئین،22% به سفوکسیتین و 4% به ایمیپنم مقاوم بودند (25). از کاستیهای مطالعه حاضر میتوان به محدودیت جمعیت مورد مطالعه و عدم بررسی تمامی ژنهای ویرولانس اشریشیاکلی اشاره کرد. اشریشیاکلی فاکتورهای ویرولانس متعددی دارد. آنچه در مطالعه حاضر مهم و بارز به نظر میرسد وجود شاخصتر ژن fim H نسبت به ادهزین papC میباشد. در واقع نقش این ژن در ظهور باکتری اوری ناشی از اشرشیاکلی در بیماران چشمگیر است (26). از آنجا که پروتئین fim H فاقد تنوع ژنتیکی میباشد، از اینرو در بیشتر مطالعات انجام شده در مورد تهیه واکسن علیه عفونت ادراری این پروتئین مدنظر بوده است همچنین در مطالعه حاضر درصد فراوانی ژن aer نسبت به مطالعات قبلی بیشتر می¬باشد که شاید یکی از علل آن، نقش مهم این ژن در پایداری باکتری و مقاومت آن در برابر سیستم ایمنی بدن است. افزایش مقاومت آنتیبیوتیکی در جامعه ممکن است ناشی از استفاده نامناسب از آنتیبیوتیک، استفاده مداوم از آنتیبیوتیک در کشاورزی و حیوانات و برنامههای غیر موثر کنترل عفونت باشد. تخمین زده میشود که 80 تا 90 درصد داروهای ضدمیکروبی توسط افراد عادی و 10 تا 20 درصد باقیمانده توسط افراد بستری در بیمارستان مصرف میشود (20). براساس یافته¬های مطالعه حاضر، ایزولههای جدا شده از بیماران مقاومت کمی به فسفومایسین و نیتروفورانتوئین دارند. همچنین ایزوله¬ها مقاومت نسبتاً بالایی به نالیدیکسیک اسید وکوتریماکسازول دارند که احتمالاً ناشی از استفاده زیاد از این آنتیبیوتیکها در درمان عفونت ادراری می¬باشد.
نتیجهگیری
مطالعه حاضر، اولین مطالعه انجام شده از فراوانی ژنهای fim H، papC،aer اشریشیاکلی در شهر یزد میباشد. نتایج مطالعه حاضر نشان میدهد فراوانی ژن fim H بیشتر از دو ژن دیگر میباشد و از آنجا که اولین مرحله برای ایجاد عفونت اتصال باکتری است و فیمبریه نقش مهم و کلیدی را برای اتصال فراهم میکند، این موضوع میتواند نقطه عطفی باشد تا در مطالعات بعدی به فکر طراحی واکسن علیه این فاکتور ویرولانس باشیم تا بدین طریق بتوانیم از ایجاد این عفونت در جامعه جلوگیری کنیم. مطالعات قبلی روی fim Hنشان داده است که واکسن حاصل از fim H توانسته است موشهای ایمن شده را به صورت فعال و غیرفعال در برابر اشریشیاکلی یوروپاتوژن محافظت کند. همچنین مطالعه روی سرم حیوانات واکسینه شده با fim H نشان داده که این واکسن میتواند از اتصال باکتری یوروپاتوژن به سلولهای مثانه انسان در شرایط آزمایشگاهی جلوگیری کند (27). برای ارزیابی دقیقتر پیشنهاد میشود تا در مطالعات دیگر حضور دیگر عوامل ویرولانس نیز مورد بررسی قرار گیرد تا بتوان مقایسهای بین این فاکتورها انجام داد. در نتیجه به دلیل شیوع فراوان عفونت ادراری در حضور این ژنها تشخیص سریع آنها در نمونهها میتواند به درمان و مدیریت سریع بیماری کمک کند و از هزینههای زیادی که هر ساله برای درمان عفونت ادراری بر جامعه و خانواده بیمار تحمیل میشود جلوگیری کرد. همچنین براساس نتایج این مطالعه، پیشنهاد میشود استفاده منطقی از داروهای موثر و به کارگیری ابزارهای مناسب کنترل در محیطهای بیمارستانی مورد توجه پزشکان و متخصصین کنترل عفونت قرار بگیرد. همچنین پیشنهاد میشود که با آموزش راهکارهای مناسب کنترل عفونت، به پرسنل پزشکی بخشهای بیمارستانی از بروز و گسترش عفونتهای ادراری در جامعه و مراکز درمانی جلوگیری کرد و سایر فاکتورهای بیماریزایی این ارگانیسم در سایر مناطق جغرافیایی کشور مورد بررسی قرار بگیرد تا اطلاعات جامعتری در بحث پیشگیری، درمان و نحوه مدیریت عفونتهای ناشی از این ارگانیسم در اختیار محققین قرار بگیرد.
سپاسگزاری
این مقاله برگرفته از پایاننامه دوره کارشناسی ارشد میکروب شناسی پزشکی دانشگاه علوم پزشکی شهید صدوقی یزد میباشد. نویسندگان این مقاله لازم میدانند از کارکنان آزمایشگاه میکروب شناسی دانشگاه علوم پزشکی شهید صدوقی یزد، بیمارستان شهیدصدوقی و شهدای کارگر یزد برای زحمات بیدریغشان قدردانی نمایند.
حامی مالی: این پایاننامه تحقیقاتی با حمایت مالی دانشگاه علوم پزشکی شهید صدوقی یزد صورت گرفته است.
تعارض در منافع: وجود ندارد.
References:
1- Tiba MR, Yano T, Leite Dds. Genotypic Characterization of Virulence Factors in Escherichia Coli Strains from Patients with Cystitis. Revista Do Instituto De Medicina Tropical De Sao Paulo 2008; 50(5): 255-60.
2- Tarchouna M, Ferjani A, Ben-Selma W, Boukadida J. Distribution of Uropathogenic Virulence Genes in Escherichia Coli Isolated from Patients with Urinary Tract Infection. International J Infectious Diseases 2013; 17(6): E450-E53.
3- Bien J, Sokolova O, Bozko P. Role of Uropathogenic Escherichia Coli Virulence Factors in Development of Urinary Tract Infection and Kidney Damage. International J Nephrology 2012; 2012: 1-15.
4- Asadi S, Kargar M, Solhjoo K, Najafi A, Ghorbani-Dalini S. The Association of Virulence Determinants of Uropathogenic Escherichia Coli with Antibiotic Resistance. Jundishapur J Microbiology 2014; 7(5): e9936.
5- López-Banda DA, Carrillo-Casas EM, Leyva- Leyva M, Orozco-Hoyuela G, Manjarrez-Hernández AH, Arroyo-Escalante S, et al. Identification of Virulence Factors Genes in Escherichia Coli Isolates from Women with Urinary Tract Infection in Mexico. Biomed Research International 2014; 2014: 1-10.
6- Mukherjee M, Basu S, Mukherjee SK, Majumder M. Multidrug-Resistance and Extended Spectrum Beta-Lactamase Production in Uropathogenic E. Coli Which Were Isolated from Hospitalized Patients In Kolkata, India. J Clin Diagn Res 2013; 7(3): 449-53.
7- Karimian A, Momtaz H,Madani M. Detection of Uropathogenic Escherichia Coli Virulence Factors in Patients with Urinary Tract Infections in Iran. African J Microbiology Res 2012; 6(39): 6811-16.
8- Kumar Y, Sood S, Sharma A, Mani KR. Antibiogram and Characterization of Resistance Markers among Escherichia Coli Isolates from Urinary Tract Infections. The J Infection in Developing Countries 2013; 7(07): 513-19.
9- Starčič Erjavec M, Žgur-Bertok D. Prevalence, Distribution and Genetic Association of Adhesin Gene Sequences of Escherichia Coli Isolates from Urinary Tract Infections in Slovenia. Acta Biol Slov 2008; 51: 21-31.
10- Slavchev G, Pisareva E, Markova N. Virulence of Uropathogenic Escherichia Coli. J Culture Collections 2009; 6(1): 3-9.
11- Szemiako K, Krawczyk B, Samet A, Śledzińska A, Nowicki B, Nowicki S, et al. A Subset of Two Adherence Systems, Acute Pro-Inflammatory Pap Genes and Invasion Coding Dra, Fim, Or Sfa, Increases the Risk of Escherichiacoli Translocation to the Bloodstream. European J Clinical Microbiology & Infectious Diseases 2013; 32(12): 1579-82.
12- Neamati F, Firoozeh F, Saffari M, Zibaei M. Virulence Genes and Antimicrobial Resistance Pattern in Uropathogenic Escherichia Coli Isolated from Hospitalized Patients in Kashan, Iran." Jundishapur J Microbiology 2015; 8(2).
13- Wayne P. Clinical and Laboratory Standard Institute. Performance Standard for Antimicrobial Susceptibilitytesting: Document M100-S23.
14- Hosseini SS, Eslami G, Zandi H, Vakili M. Frequency of OQXA and OQXB Plasmid-Mediated Quinolone Resistence Genese in Escherichia Coli Isolated from Urine of Inpatient with Urinary Tract Infection in YAZD City, IRAN. IUMS 2016; 34(402): 1211-17.
15- Sauer P, Gallo J, Kesselová M, Kolar M, Koukalová D. Universal Primers for Detection of Common Bacterial Pathogens Causing Prosthetic Joint Infection. Biomedical Papers-Palacky University in Olomouc Czech Repub 2005; 149(2): 285-8.
16- Santo E, Macedo C, Marin JM. Virulence Factors of Uropathogenic Escherichia Coli from a University Hospital in Ribeirão Preto, São Paulo, Brazil. Revista Do Instituto De Medicina Tropical De Sao Paulo 2006; 48(4): 185-88.
17- Hassan R, El-Naggar W, El-Sawy E, El-Mahdy A. Characterization of Some Virulence Factors Associated with Enterbacteriaceae Isolated from Urinary Tract Infections in Mansoura Hospitals. Egyptian J MedMicrobiology 2011; 20(2): 9-17.
18- Ranjbar R, Farahani O. The Prevalence of Virulence Genes and Virulotypes of Escherichiacoli Strains Isolated from Hospital Wastewaters in Tehran, Iran. Iran J Public Health 2018; 47(5): 713-19.
19- Farshad S, Ranjbar R, Anvarinejad M, Shahidi MA, Hosseini M. Emergence of Multi Drug Resistant Strains of Eschetichiacoli Isolated from Urinary Tract Infection. The Open Conference Proceedings J 2010; 1(1): 192-96.
20- Pourzare M, Derakhshan S, Roshani D. Distribution of Uropathogenic Virulence Genes in Escherichiacoli Isolated from Children with Urinary Tract Infection in Sanandaj, Iran. Archives of Pediatric Infectious Diseases 2017. [Persian]
21- Raeispour M, Ranjbar RJAR, Control I. Antibiotic Resistance, Virulence Factors and Genotyping of Uropathogenic Escherichiacoli Strains. Antimicrobial Resistance & Infection Control 2018; 7(1): 118.
22- Peymani D. Frequency of P and Type 1 Fimbriae-Encoding Genes among Uropathogenic Escherichiacoli Isolated From Hospitalized Patients in Qazvin and Karaj Hospitals 2015.
23- Mladin C, Usein CR, Chifiriuc MC, Palade A, Slavu CL, Negut M, et al. Genetic Analysis of Virulence and Pathogenicity Features of Uropathogenic Escherichiacoli Isolated from Patients with Neurogenic Bladder. Romanian Biotechnological Letters 2009; 14(6): 4900-5.
24- Bahalo S, Tajbakhsh E, Tajbakhsh S, Momeni M, Tajbakhsh F. Detection of Some Virulence Factors of Escherichiacoli Isolated from Urinary Tract Infection Isolated of Children in Shahrekord Iran by Multiplex PCR. Middle-East J Scientific Res 2013; 14(1): 29-32.
25- Zhao L, Chen X, Zhu X, Yang W, Dong L, Xu X, et al. Prevalence of Virulence Factors and Antimicrobial Resistance of Uropathogenic Escherichiacoli in Jiangsu Province (China). Urology 2009; 74(3): 702-7.
26- Saki A, Mirzaee M. Frequency of Fimbrial Virulence Genese (FIM, PAP, SFA) in Escherichiacoli Isolated from the Patients with Urinary Tract Infection from Selective Hospitals of Tehran, Boroujerd and Sanandej City in 2015-2016. JSSU 2017; 24(11): 913-23.
27- Thankavel K, Madison B, Ikeda T, Malaviya R, Shah AH, Arumugam PM, et al. Localization of a Domain in the Fimh Adhesin of Escherichia Coli Type 1 Fimbriae Capable of Receptor Recognition and Use of A Domain-Specific Antibody to Confer Protection Against Experimental Urinary Tract Infection. J Clin Invest 1997; 100(5): 1123-36.
1- Tiba MR, Yano T, Leite Dds. Genotypic Characterization of Virulence Factors in Escherichia Coli Strains from Patients with Cystitis. Revista Do Instituto De Medicina Tropical De Sao Paulo 2008; 50(5): 255-60.
2- Tarchouna M, Ferjani A, Ben-Selma W, Boukadida J. Distribution of Uropathogenic Virulence Genes in Escherichia Coli Isolated from Patients with Urinary Tract Infection. International J Infectious Diseases 2013; 17(6): E450-E53.
3- Bien J, Sokolova O, Bozko P. Role of Uropathogenic Escherichia Coli Virulence Factors in Development of Urinary Tract Infection and Kidney Damage. International J Nephrology 2012; 2012: 1-15.
4- Asadi S, Kargar M, Solhjoo K, Najafi A, Ghorbani-Dalini S. The Association of Virulence Determinants of Uropathogenic Escherichia Coli with Antibiotic Resistance. Jundishapur J Microbiology 2014; 7(5): e9936.
5- López-Banda DA, Carrillo-Casas EM, Leyva- Leyva M, Orozco-Hoyuela G, Manjarrez-Hernández AH, Arroyo-Escalante S, et al. Identification of Virulence Factors Genes in Escherichia Coli Isolates from Women with Urinary Tract Infection in Mexico. Biomed Research International 2014; 2014: 1-10.
6- Mukherjee M, Basu S, Mukherjee SK, Majumder M. Multidrug-Resistance and Extended Spectrum Beta-Lactamase Production in Uropathogenic E. Coli Which Were Isolated from Hospitalized Patients In Kolkata, India. J Clin Diagn Res 2013; 7(3): 449-53.
7- Karimian A, Momtaz H,Madani M. Detection of Uropathogenic Escherichia Coli Virulence Factors in Patients with Urinary Tract Infections in Iran. African J Microbiology Res 2012; 6(39): 6811-16.
8- Kumar Y, Sood S, Sharma A, Mani KR. Antibiogram and Characterization of Resistance Markers among Escherichia Coli Isolates from Urinary Tract Infections. The J Infection in Developing Countries 2013; 7(07): 513-19.
9- Starčič Erjavec M, Žgur-Bertok D. Prevalence, Distribution and Genetic Association of Adhesin Gene Sequences of Escherichia Coli Isolates from Urinary Tract Infections in Slovenia. Acta Biol Slov 2008; 51: 21-31.
10- Slavchev G, Pisareva E, Markova N. Virulence of Uropathogenic Escherichia Coli. J Culture Collections 2009; 6(1): 3-9.
11- Szemiako K, Krawczyk B, Samet A, Śledzińska A, Nowicki B, Nowicki S, et al. A Subset of Two Adherence Systems, Acute Pro-Inflammatory Pap Genes and Invasion Coding Dra, Fim, Or Sfa, Increases the Risk of Escherichiacoli Translocation to the Bloodstream. European J Clinical Microbiology & Infectious Diseases 2013; 32(12): 1579-82.
12- Neamati F, Firoozeh F, Saffari M, Zibaei M. Virulence Genes and Antimicrobial Resistance Pattern in Uropathogenic Escherichia Coli Isolated from Hospitalized Patients in Kashan, Iran." Jundishapur J Microbiology 2015; 8(2).
13- Wayne P. Clinical and Laboratory Standard Institute. Performance Standard for Antimicrobial Susceptibilitytesting: Document M100-S23.
14- Hosseini SS, Eslami G, Zandi H, Vakili M. Frequency of OQXA and OQXB Plasmid-Mediated Quinolone Resistence Genese in Escherichia Coli Isolated from Urine of Inpatient with Urinary Tract Infection in YAZD City, IRAN. IUMS 2016; 34(402): 1211-17.
15- Sauer P, Gallo J, Kesselová M, Kolar M, Koukalová D. Universal Primers for Detection of Common Bacterial Pathogens Causing Prosthetic Joint Infection. Biomedical Papers-Palacky University in Olomouc Czech Repub 2005; 149(2): 285-8.
16- Santo E, Macedo C, Marin JM. Virulence Factors of Uropathogenic Escherichia Coli from a University Hospital in Ribeirão Preto, São Paulo, Brazil. Revista Do Instituto De Medicina Tropical De Sao Paulo 2006; 48(4): 185-88.
17- Hassan R, El-Naggar W, El-Sawy E, El-Mahdy A. Characterization of Some Virulence Factors Associated with Enterbacteriaceae Isolated from Urinary Tract Infections in Mansoura Hospitals. Egyptian J MedMicrobiology 2011; 20(2): 9-17.
18- Ranjbar R, Farahani O. The Prevalence of Virulence Genes and Virulotypes of Escherichiacoli Strains Isolated from Hospital Wastewaters in Tehran, Iran. Iran J Public Health 2018; 47(5): 713-19.
19- Farshad S, Ranjbar R, Anvarinejad M, Shahidi MA, Hosseini M. Emergence of Multi Drug Resistant Strains of Eschetichiacoli Isolated from Urinary Tract Infection. The Open Conference Proceedings J 2010; 1(1): 192-96.
20- Pourzare M, Derakhshan S, Roshani D. Distribution of Uropathogenic Virulence Genes in Escherichiacoli Isolated from Children with Urinary Tract Infection in Sanandaj, Iran. Archives of Pediatric Infectious Diseases 2017. [Persian]
21- Raeispour M, Ranjbar RJAR, Control I. Antibiotic Resistance, Virulence Factors and Genotyping of Uropathogenic Escherichiacoli Strains. Antimicrobial Resistance & Infection Control 2018; 7(1): 118.
22- Peymani D. Frequency of P and Type 1 Fimbriae-Encoding Genes among Uropathogenic Escherichiacoli Isolated From Hospitalized Patients in Qazvin and Karaj Hospitals 2015.
23- Mladin C, Usein CR, Chifiriuc MC, Palade A, Slavu CL, Negut M, et al. Genetic Analysis of Virulence and Pathogenicity Features of Uropathogenic Escherichiacoli Isolated from Patients with Neurogenic Bladder. Romanian Biotechnological Letters 2009; 14(6): 4900-5.
24- Bahalo S, Tajbakhsh E, Tajbakhsh S, Momeni M, Tajbakhsh F. Detection of Some Virulence Factors of Escherichiacoli Isolated from Urinary Tract Infection Isolated of Children in Shahrekord Iran by Multiplex PCR. Middle-East J Scientific Res 2013; 14(1): 29-32.
25- Zhao L, Chen X, Zhu X, Yang W, Dong L, Xu X, et al. Prevalence of Virulence Factors and Antimicrobial Resistance of Uropathogenic Escherichiacoli in Jiangsu Province (China). Urology 2009; 74(3): 702-7.
26- Saki A, Mirzaee M. Frequency of Fimbrial Virulence Genese (FIM, PAP, SFA) in Escherichiacoli Isolated from the Patients with Urinary Tract Infection from Selective Hospitals of Tehran, Boroujerd and Sanandej City in 2015-2016. JSSU 2017; 24(11): 913-23.
27- Thankavel K, Madison B, Ikeda T, Malaviya R, Shah AH, Arumugam PM, et al. Localization of a Domain in the Fimh Adhesin of Escherichia Coli Type 1 Fimbriae Capable of Receptor Recognition and Use of A Domain-Specific Antibody to Confer Protection Against Experimental Urinary Tract Infection. J Clin Invest 1997; 100(5): 1123-36.
نوع مطالعه: پژوهشي |
موضوع مقاله:
میکروبیولوژی
دریافت: 1398/5/8 | پذیرش: 1398/5/19 | انتشار: 1400/3/10
دریافت: 1398/5/8 | پذیرش: 1398/5/19 | انتشار: 1400/3/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







