دوره 29، شماره 11 - ( بهمن 1400 )
جلد 29 شماره 11 صفحات 4267-4255 |
برگشت به فهرست نسخه ها
Ethics code: IR.SUMS.REC.1396.S1062
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Jokar M, Sherafati Moghadam M. Effect of 4 weeks of High-Intensity Interval Training on P53 and Caspase-3 Proteins Content in the Heart Muscle Tissue of Rats with Type 1 Diabetes. JSSU 2022; 29 (11) :4255-4267
URL: http://jssu.ssu.ac.ir/article-1-4947-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4947-fa.html
جوکار مسعود، شرافتی مقدم محمد. تأثیر 4 هفته تمرین تناوبی با شدت بالا بر محتوای پروتئینهای P53 و کاسپاز-3 در بافت عضله قلب موشهای صحرایی مبتلا به دیابت نوع 1. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (11) :4255-4267
واژههای کلیدی: آپوپتوز، تمرین تناوبی با شدت بالا، پروتئین کاسپاز-3، پروتئین P53، استرپتوزوتوسین، دیابت نوع 1
متن کامل [PDF 974 kb]
(431 دریافت)
| چکیده (HTML) (1238 مشاهده)
متن کامل: (627 مشاهده)
مقدمه
بهطور عادی تکثیر و تمایز سلولها توسط یک سازوکار کاملاً حسابشده و در پاسخ به نیازهای مختلف انجام میشود. در یک موجود جوان به موازات افزایش تکثیر سلولی، افزایش مرگ سلولی را نیز شاهد هستیم، به طوریکه این دو با یکدیگر در یک حالت تعادل قرار میگیرند (1). مرگ برنامهریزیشده سلولی یا آپوپتوز Apoptosis نوعی مرگ سازمانیافته است که در تکامل جنینی و یا سلولهای آسیب دیده خاص (مانند آسیبهایی که به DNA سلولی وارد میشود) روی میدهد. برخلاف نکروزNecrosis ، در آپوپتوز محتویات سلولی به بیرون نمیریزد و پاسخ التهابی ایجاد نمیگردد. در واقع در طی آپوپتوز سلولها به کمک آنزیمهای پروتئولیتیک خاصی (کاسپازها) بهصورت وزیکولهای کوچک و دارای غشاء در میآیند (2). کاردیومیوپاتی دیابتی Diabetic Cardiomyopathy یک عارضه شایع دیابت و علت مرگ و میر در بیماران دیابتی میباشد که در دیابت نوع 1 یا نوع 2 اتفاق میافتد (3). این عارضه توسط مجموعهای از ناهنجاریهای ساختاری و عملکردی در قلب بیماران دیابتی از جمله اختلال در انقباض دیاستولیکDiastolic و سیستولیکSystolic، هیپرتروفی کاردیومیوسیت، آپوپتوز و فیبروزFibrosis قلبی مشخص میشود (4). در بررسیهای اخیر بر روی افراد مبتلا به دیابت نشان داده شده است که قلب این افراد بر اثر کاردیومیوپاتی دیابتی منجر نارسایی قلبی میشود و در بافت قلبی آنها نکروز و آپوپتوز افزایش مییابد (5). سازوکارهای پایه برای افزایش میزان آپوپتوز شامل افزایش تولید رادیکالهای آزاد اکسیژن (ROS)Reactive Oxygen Species ، افزایش سیتوکینهای التهابی و شیمیایی، فعالسازی کاسپازها، آپوپتوز وابسته به گیرنده Fas و وابسته به میتوکندری، استرس ریتوکلوم آندوپلاسمی (ER)Endoplasmic Reticulum ، افزایش فعالشدن مسیر سیگنالینگTransforming Growth Factor Beta TGF-β، فعالسازی موضعی سیستم رنین-آنژیوتانسین-آلدوسترون (RAAS) Renin-Angiotensin-Aldosterone System، مقاومت IGF-1 است (9-6). آپوپتوز و مسیر آبشاری آپوپتوز میتواند از داخل و یا خارج سلول آغاز شود و نیز میتواند به پروتئین P53 وابسته و یا مستقل از آن باشد (10). پروتئین P53 در تنظیم آپوپتوز نقش مهمی دارد. این پروتئین از ٣۹٣ آمینواسید ساخته شده است و نام پروتئین P53، از وزن مولکولی آن گرفته شده که برابر با ٥٣ کیلو دالتون است (11). در سلولهایی که بعد از آسیب DNA نقاط کنترل چرخه سلولی فعال میگردند، درصورتیکه ترمیم انجام نشود، آپوپتوز بهصورت وابسته به P53 صورت میگیرد. بعد از تولید P53 چندین ژن (Bax و Fas) تحت تأثیر این پروتئین بیان میشوند که باعث تقویت مسیر آپوپتوز میشود (12). کاسپاز-3Caspase، مؤثرترین کاسپاز شناخته شده در آپوپتوز است. کاسپاز-3، همچنین بهعنوان apopain، SCA-1، Yama و CPP32 نیز شناخته می¬شود و یک پروتئاز سیستئین-آسپارتات خاص میباشد. ژن کاسپاز-3 در انسان یک پروتئین سیتوپلاسمی است که بسیار زیاد در ریه، طحال، قلب، کبد، کلیهها و سلولهای سیستم ایمنی بدن بیان میشود (13). کاسپاز-3 یکی از عوامل اجرایی آپوپتوز است که بهنوبه خود مسئول شکستن پروتئولیتیکی جزئی و کلی بسیاری از پروتئینهای مهم میباشد. در طول اجرای آبشار آپوپتوز، کاسپاز-3 فعالشده و منجر به رهاسازی پروتئینSterol Regulatory Element-Binding Proteins SREBP از غشاء و ER در یک واکنشهای پروتئولیتیک میشود. کاسپاز-3 همچنین کاسپازهای 6، 7 و 9 را فعال میکند (14). القای آپوپتوز بهعنوان یکی از آسیبهای دیابت بر میوکارد توسط فعالسازی اجزای مسیر آپوپتوز و فعالیت کاسپاز نشان داده شده و مرگ سلولهای میوکاردی بهعنوان یک اتفاق مهم در پیشرفت آسیب قلبی ناشی از دیابت شناختهشده است (15). مطالعههای اخیر نشاندهنده افزایش شیوع آپوپتوز در قلب بیماران دیابتی و دیابت القا شده بهوسیله استرپتوزوتوسین (STZ) Strepotozocin در مدل حیوانی هستند (16). مطالعات مختلف نشان دادند که دیابت میزان آپوپتوز را در سلولهای قلبی به میزان چشمگیری افزایش میدهد (17). تأثیر تمرینهای ورزشی با شدتها و حجمهای مختلف بر فرآیند آپوپتوز توجه بسیاری از محققان را به خود جلب کرده است. با اینحال نتایج برخی از مطالعهها در این حوزه متناقض هستند. تمرین تناوبی با شدت بالا (HIIT) High-Intensity Interval Training ازجمله فعالیتهای ورزشی است که در سالهای اخیر موردتوجه ورزشکاران، مربیان و پژوهشگران علوم ورزشی قرارگرفته است. تمرینهای HIIT به جلسات تکراری نسبتاً کوتاه و متناوب تمرینی برمیگردد که اغلب با حداکثر کوشش و توان انجام میگیرد (18). در تحقیقی میردار و همکاران (1398) به بررسی تأثیر تمرینات تناوبی فزاینده بر آپوپتوز قلب موشهای جوان پرداختند. این محققان نشان دادند که 6 هفته تمرین تناوبی با شدت بالا موجب افزایش 200 و 320 درصدی آپوپتوز گروه تمرین در مقایسه با گروه کنترل 6 هفته و گروه پایه میشود (19). سیدقمی و همکاران (1396) با بررسی اثر تمرین استقامتی با شدت بالا بر بیان ژن پروتئین P53 در عضله اسکلتی به این نتیجه رسیدند که تمرینات استقامتی با شدت بالا منجر به تغییر معنیداری در بیان ژن این پروتئین نمیشود (20). در تحقیقی رنجبر و همکاران (1394) به بررسی تأثیر ده هفته تمرین هوازی زیر بیشینه دویدن بر سطوح کاسپاز-3 در موشهای صحرایی با انفارکتوس قلبی پرداختند. گروه تمرین به مدت 10 هفته تمرین ورزشی دویدن بر روی تردمیل (هر هفته 5 جلسه و هر جلسه 50 دقیقه با سرعت 17 متر بر دقیقه معادل 55 درصد ظرفیت هوازی) را انجام دادند. سطوح کاسپاز-3 تغییر معنیداری نیافته بود. این محققان بیان کردند که تمرینات هوازی منجر به کاهش مرگ سلولی قلبی میشود (21). بنابراین، یافتهها حاکی از آن است که پروتکلهای ورزشی مختلف تأثیرات متفاوتی بر عوامل آپوپتوزی دارد. شدت تمرینات میتواند از عوامل تأثیرگذار مهم در این زمینه باشد. بنابراین، با توجه به نقشهای بسیار مهم پروتئینهای P53 و کاسپاز-3 در تنظیم مسیر آپوپتوزی نقش مهمی را ایفا میکنند. همچنین مشخص شده است که بیماران دیابتی مستعد عارضه کاردیومیوپاتی و مرگ سلولی در قلب خود هستند. از طرفی دیگر، تمرینات ورزشی را میتوان بهعنوان یک عامل محافظتی برای قلب بیماران دیابتی در نظر گرفت. تحقیقات بسیاری نشان دادهاند که تمرینات ورزشی، منجر به تغییرات ساختاری و عملکردی قلبی میشود. تحقیقات بسیار کمی، نقش سازوکار سلولی آپوپتوز را در قلب افراد دیابتی نوع 1 بررسی کردهاند؛ بنابراین، هدف از تحقیق حاضر، بررسی تأثیر شش هفته تمرین تناوبی با شدت بالا و استقامتی بر میزان پروتئینهای P53، فرم اولیه (Pro) و فرم فعالشده (Cleaved) کاسپاز-3 در بافت عضله قلب موشهای صحرایینر مبتلابه دیابت نوع 1 میباشد.
روش بررسی
پژوهش حاضر از نوع تجربی-بنیادی میباشد که بهصورت گروه آزمایش و کنترل انجام گرفت؛ در این پژوهش، 12 سر موش صحرایینر 2 ماهه از نژاد اسپراگداولی با میانگین وزن 20±300 گرم انتخاب شدند. موشهای صحرایی در حیوان خانه دانشگاه علوم پزشکی شیراز با دمای 2±22 درجه سانتیگراد، رطوبت 50-40 درصد و چرخه تاریکی-روشنایی 12-12 ساعت نگهداری شدند. غذای موشهای صحرایی بهصورت پلت مخصوص حیوانات آزمایشگاهی از دانشگاه علوم پزشکی شیراز تهیه شد. همچنین آب مورد نیاز حیوانات بهصورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. اصول اخلاقی (کد اخلاقی IR.SUMS.REC.1396.S1062) مطالعه مطابق با اصول کار با حیوانات آزمایشگاهی مصوب دانشگاه علوم پزشکی شیراز موردتوجه قرار گرفت.
روش القاء دیابت
برای ایجاد دیابت نوع 1 در موشها، محلول استرپتوزوتوسین (STZ) (حلشده در بافر سیترات 0/1 مولار با 4/5=ph) بهصورت داخل صفاقی و فقط یک مرتبه با دوز 50 میلیگرم به ازای هر کیلوگرم از وزن بدن تزریق گردید. جهت اطمینان از دیابتی شدن حیوانها، قند خون آنها 72 ساعت پس از تزریق با کمک گلوکومتر و نمونه خونی گرفتهشده از سیاهرگ دمی موشها اندازهگیری شد؛ قند خون بالای 300 میلیگرم بر دسیلیتر بهعنوان شاخص دیابتی شدن نوع 1 در نظر گرفته شد (23،22).
پروتکل تمرینی
پس از القای دیابت موشهای صحرایی به روش تصادفی به 2 گروه: گروه تمرین دیابتی (6 سر) و کنترل دیابتی (6 سر) تقسیم شدند. موشهای گروههای تمرین برای آشنایی با نوارگردان به مدت یک هفته (4 روز در هفته) با سرعت 5 تا 10 متر بر دقیقه، روی نوارگردان دویدند. برنامه گروه تمرینی به مدت 4 هفته و هر هفته 4 جلسه بود. موشهای تمرینی در شروع هر جلسه با سرعتی حدود 10 تا 12 متر بر دقیقه گرم میکردند. سپس برنامه تمرینی شامل 5 مرحله 4 دقیقهای با شدت معادل 85 تا 95 درصد حداکثر سرعت و دورههای استراحت فعال 3 دقیقهای با شدت معادل 50 تا 60 درصد حداکثر سرعت انجام شد. در پایان هر جلسه نیز موشها با سرعتی حدود 10 تا 12 متر بر دقیقه سرد میکردند. کل مدتزمان دویدن موشهای صحرایی در هر جلسه بر روی نوارگردان 44 دقیقه بود. شیب نوارگردان صفر درجه و در 4 هفته تغییری نداشت (24).
آزمون اندازهگیری حداکثر سرعت
آزمون اندازهگیری حداکثر سرعت با سرعت 5 متر در دقیقه شروع و هر 3 دقیقه، سرعت نوارگردان 5 متر در دقیقه افزایش یافت تا موشهای صحرایی به خستگی (چسبیدن موشها بهانتهای نوارگردان) برسند. سرعتی که در آن موشهای صحرایی به خستگی رسیدند، بهعنوان حداکثر سرعت در نظر گرفته شد (25). در این مدت، گروه کنترل هیچگونه برنامه تمرینی نداشتند. همچنین موشهای صحرایی هیچگونه درمانی با انسولین را در طول دوره پژوهش نداشتند.
روش بافتبرداری
برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 24 ساعت پس از آخرین جلسه تمرین، موشها با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس بافت عضله قلبی از بدن حیوان برداشته شد و در سرم فیزیولوژیک شستشو داده و سپس بلافاصله با استفاده از مایع ازت منجمد و برای سنجشهای بعدی با دمای 80 فریزر شد (26).
اندازهگیری متغیرهای بیوشیمیایی
با استفاده از روش آزمایشگاهی وسترن-بلات پروتئینهای P53 و کاسپاز-3 اندازهگیری شد. در این روش ابتدا مخلوط بافت قلب در لیزکننده ریپا (RIPA) RIPA Lysis Buffer System حاوی آنتی پروتئاز کوکتیل (sigma) تهیه شد و پس از سانتریفوژ در 12000 دور در دقیقه و مخلوط کردن با محلول نمونه، با الکتروفورز (مدل عمودی، شرکت BioRad، ساخت آمریکا) در ژل آکریلامید حاوی سدیم دودسیل سولفات (Sodium dodecyl sulfate; SDS) تفکیک شدند. بعد از تفکیک، باندهای پروتئینی بر روی غشا ترانسفرشده (غشاء دیفورید پلیوینیلیدینPolyvinylidene difluoride (PVDF) membrane sigma) و بعد از پوشاندن غشا با محلول سرم آلبومین گاوی 3 درصد به مدت یک ساعت در دمای آزمایشگاه در معرض آنتیبادی اولیه خرگوشی آنتیبادی-P53 با شماره سریال (DP-1) (sc-126) و آنتیبادی-کاسپاز-3 با شماره سریال (31A1067) (Sc-56053) رقیقشده (500/1) در محلول پوشاننده به مدت یک شب در دمای 4 درجه قرار داده شدند. پس از سه بار شستشو با محلول فسفات نمکی تویندار با آنتیبادی ثانویه ضد خرگوشی متصل به HRP (sc-2004) در دمای اتاق به مدت یک ساعت مجاور گردیدند. ایمیون کمپلکسهای ایجادشده با روش پرتوزایی شیمیایی و استفاده از فیلم رادیوگرافی بهظهور رسیدند. دانسیته باندها توسط نرمافزار Image J (نسخه 112/0/8/1) اندازهگیری شد و نتایج بعد از نرمالیزه شدن در مقابل کنترل داخلی (بتا-اکتین) بهصورت چند برابر گروه از کنترل ارائه شدند (27).
تجزیه و تحلیل آماری
ابتدا از آزمون کالموگروف اسمیرنوف (KS) برای تعیین نرمالیتی توزیع دادههای پژوهش استفاده شد. با توجه به نرمال بودن توزیع نمرات در متغیرها، از آزمون پارامتریک t مستقل برای مقایسه بین گروهی استفاده شده است. تجزیه و تحلیل دادهها، با استفاده از نرمافزارversion 16 SPSS انجامگرفته است. سطح معنیداری تجزیه و تحلیل آماری تحقیق حاضر، p≤0/05 در نظر گرفتهشده است.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شیراز تایید شده است (کد اخلاق IR.SUMS.REC.1396.S1062)
نتایج
در پایان پژوهش، نتایج نشان دادند که به دنبال چهار هفته تمرین HIIT، کاهش معنیداری در محتوای پروتئین P53 بین گروههای تمرین دیابتی و کنترل دیابتی در بافت عضله قلبی وجود دارد (P=0/003) (شکل 1). از طرفی، چهار هفته تمرین HIIT منجر به تغییر معنیداری در محتوای پروتئین کاسپاز-3 در فرم فعالشده (Cleaved) (P=0/71) و فرم اولیه (Pro) (P=0/15) بین گروههای تمرین دیابتی و کنترل دیابتی در بافت عضله قلبی نشد (شکل 2).
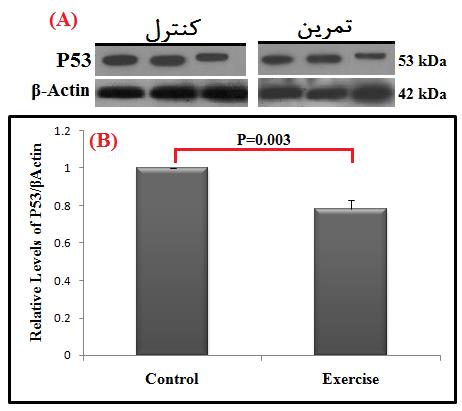
شکل 1: مقایسه محتوای پروتئین P53 در گروههای مورد مطالعه.
(A). تصاویر وسترنبلات پروتئین P53 و بتا-اکتین (β-actin) بهعنوان کنترل داخلی (لودینگ کنترل) در بافت عضله قلب. (B). نمودار ستونی (میانگین و انحراف استاندارد) نشاندهنده مقادیر کمیشده باندهای پروتئین P53 در مقابل کنترل داخلی
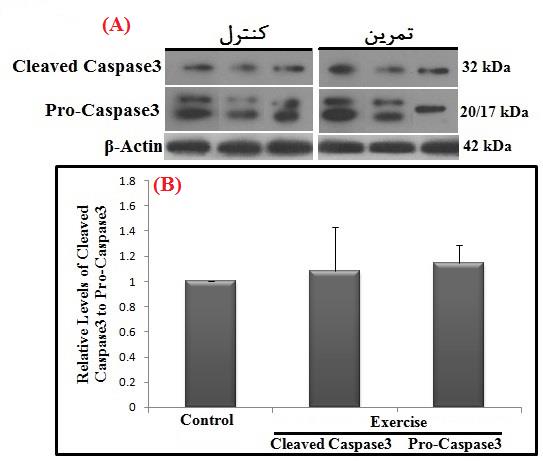
شکل 2: مقایسه محتوای پروتئین کاسپاز-3 در گروههای مورد مطالعه.
(A). تصاویر وسترنبلات پروتئین کاسپاز-3 و بتا-اکتین (β-actin) بهعنوان کنترل داخلی (لودینگ کنترل) در بافت عضله قلب. (B). نمودار ستونی (میانگین و انحراف استاندارد) نشاندهنده مقادیر کمیشده باندهای پروتئین کاسپاز-3 در مقابل کنترل داخلی
بحث
نتایج تحقیق حاضر، کاهش معنیداری را بین گروههای تمرین HIIT و کنترل در محتوای پروتئینهای P53 نشان داد؛ اما تغییر معنیداری در محتوای پروتئین کاسپاز-3 در فرم فعالشده (Cleaved) و فرم اولیه (Pro) مشاهده نشد. بیماریهای قلبی- عروقی یکی از مهمترین عوارض ناشی از دیابت میباشد. مطالعهها نشان میدهند که آترواسکلروز کرونری و کاردیومیوپاتی در اثر متابولیسم غیرطبیعی وابسته به دیابت به وجود میآید. کاردیومیوپاتی دیابتی را بهعنوان بیماری ویژهی عضله قلب بدون وجود هیچ آسیب عروقی در مدلهای حیوانی و بالینی دیابت نشان دادهاند (28). در این عارضه هرگونه افزایش غیرعادی گلوکز پلاسما، سلولهای عضله قلبی را مستعد مرگ سلولی به طریق آپوپتوز میکند و درنهایت موجب تغییر انقباضی عضلانی میشود (16). مرگ سلولی ناشی از متابولیسم غیرطبیعی میوکارد، بهعنوان علت اصلی کاردیومیوپاتیها در نظر گرفته میشود. در این حالت سلولهای عضلهی قلب با هیپرتروفی و فیبروز جبرانی به مقابله با کاهش بافت انقباضی ناشی از دیابت میپردازند (29،30). تحقیقات بسیار اندکی به بررسی محتوای پروتئینهای P53 و کاسپاز-3 بر روی آزمودنیهای دیابتی که مستعد کاردیومیوپاتی دیابتی و مرگ سلول عضله قلبی هستند، پرداختهاند. بر اساس شواهد هنوز ماهیت تمرینات ورزشی بهخصوص تمرینات HIIT بر روی مسیر آپوپتوز و پروتئینهای درگیر در این مسیر بهدرستی مشخص نشده است. با این وجود، در تحقیقی حسنپور و همکاران (2017) به بررسی تأثیر تمرین HIIT بر سطوح پروتئین P53 در قلب موشهای دیابتی نوع 2 کردند. تمرین HIIT سه جلسه در هفته با شدت 80 تا 85 درصد حداکثر سرعت برای 2 دقیقه و دورههای استراحت فعال یک دقیقه انجام شد. تمرین HIIT منجر به کاهش سطوح پروتئین P53 شد اما معنیدار نبود (31). نتایج تحقیق حسنپور و همکاران با نتایج تحقیق حاضر که منجر به کاهش محتوای پروتئین P53 شده است همسو میباشد. این نتایج نشاندهنده این مطلب میباشد که تمرینات HIIT علاوه بر سازگاریهای فیزیولوژیک منجر به افزایش مسیر آپوپتوز نمیشود. گفته شده است انجام فعالیت ورزشی طولانیمدت، عضلات بیشتری را درگیر میکند، که این امر منجر به فشار مکانیکی بیش از حد به عضلات شده و سبب آسیبهای عضلانی میشود؛ این آسیب میتواند منجر به فعالشدن مسیر آپوپتوزی شود (32) که نتایج تحقیق حاضر با این مطلب در تضاد است؛ زیرا تمرینات HIIT در تحقیق حاضر محتوای پروتئین P53 را کاهش و محتوای پروتئین کاسپاز-3 نیز تغییر معنیداری نکرده است. البته شایان ذکر است که بعضی از تحقیقات بیان کردهاند که تمرینات ورزشی منجر به افزایش پروتئینهای P53 و کاسپاز-3 میشوند و از اینرو مسیر آپوپتوزی وابسته به این دو پروتئین فعال میشود. در این راستا در تحقیقی شرفی و همکاران (2012) به بررسی اثر فعالیت ورزشی مقاومتی بر سطوح سرمی پروتئینهای کاسپاز-3 و P53، در مردان ورزشکار و غیر ورزشکار پرداختند. برنامه تمرینی یک دوره متشکل از 4 ست از 6 تمرین با 80 درصد1RM بود. سطوح سرمی پروتئینهای کاسپاز-3 و P53 بهطور قابلتوجهی بلافاصله بعد از تمرین ورزشی در گروه غیر ورزشکاران در مقایسه با گروه ورزشکاران افزایشیافته بود. نتایج تحقیق حاضر نشان میدهد که تمرین مقاومتی، بیومارکرهای آپوپتوز بهخصوص مسیر درونی آپوپتوز را تغییر میدهد (33). نتایج تحقیق شرفی و همکاران با نتایج تحقیق حاضر همسو نمیباشد؛ زیرا در تحقیق حاضر محتوای پروتئین P53 کاهش و محتوای پروتئین کاسپاز-3 تغییر (افزایش) معنیداری نیافته بود. از عوامل مهم تفاوت در نوع تمرین (مقاومتی و تناوبی) را میتوان ذکر کرد. همچنین از تفاوتهای دیگر مدتزمان (در تحقیق شرفی و همکاران یک جلسه فعالیت و در تحقیق حاضر 4 هفته بوده است)، نوع آزمودنی (در تحقیق شرفی و همکاران سالم و در تحقیق حاضر دیابتی بودند) میباشد. به این مسئله نیز باید توجه کرد که در تحقیق شرفی و همکاران سطوح سرمی پروتئینهای کاسپاز-3 و P53 در گروه غیر ورزشکاران افزایش بیشتری نسبت به ورزشکاران داشته است و این نشاندهنده این مطلب است که ورزشکاران به علت سازگاریهای فیزیولوژیکی که بهوسیله فعالیتهای ورزشی به دست میآورند کمتر مستعد آپوپتوز سلولی در اندام خود هستند. با این وجود یکی از فرضیههای اصلی آپوپتوز این است که فعالیتهای ورزشی، متابولیسم بدن را افزایش میدهد که منجر به افزایش تولید ROS میشود. مقدار چشمگیر گونههای واکنشی اکسیژن مسبب تخریب DNA است و از این طریق مستقیماً سبب آپوپتوز میشوند (34). استرس اکسیداتیو ایجاد شده بهوسیله دیابت نیز ممکن است نقش مهمی در ایجاد آپوپتوز در شرایط هیپرگلیسمی داشته باشد. در اثر عدم تعادل بین تولید شکلهای باز ROS و عوامل آنتیاکسیدان که سبب حذف ROS میشود، استرس اکسیداتیو به وجود میآید. در قلب یک فرد دیابتی تجمع ROS میتواند در اثر نقص میتوکندریایی، اتواکسیداسیون گلوکز، گلیکاسیون پروتئینی و افزایش فعالیت زانتین اکسیداز تقویت شود (35). در این راستا در تحقیقی طباطباییپناه و همکاران (2016) نشان دادند که افزایش استرس اکسیداتیو و بیان ژن P53 در بیماران قلبی میتواند به ترتیب بهعنوان مارکرهای قابل اعتماد برای گزارش آپوپتوزیس و آسیب DNA بهدنبال وقوع بیماری قلبی مطرح گردند. نتایج این مطالعه آشکار کرد که آپوپتوزیس در اثر افزایش بیان P53 اتفاق میافتد که ممکن است یک روش درمانی در بهبود بیماری قلبی باشد (36). در تحقیقی دیگر شیرپور و همکاران (2017) به بررسی تأثیر تمرین HIIT بر سطوح پروتئین کاسپاز-3 در هپاتوسیتهای موشهای صحرایی ماده پیر پرداختند. تمرین HIIT از سرعت 20 متر بر دقیقه به 34 متر بر دقیقه در هفته هشتم رسید. سطوح پروتئین کاسپاز-3 در گروه تمرین HIIT نسبت به گروه کنترل افزایش معنیداری یافته بود (37). نتایج تحقیق شیرپور و همکاران با نتایج تحقیق حاضر همسو نمیباشد؛ زیرا در تحقیق حاضر محتوای پروتئین کاسپاز-3 افزایش معنیداری نیافته است. از عوامل مهم در تفاوت نتایج این دو تحقیق میتوان به نوع آزمودنی و مکان اندازهگیری پروتئینها اشاره کرد. در تحقیق حاضر آزمودنیها موشهای صحرایینر دیابتی و در تحقیق شیرپور و همکاران موشهای ماده پیر بودند. همچنین محتوای پروتئین کاسپاز-3 در تحقیق شیرپور و همکاران در هپاتوسیتهای کبد اندازهگیری شده است و این در حالی است که محققان تحقیق حاضر در سلولهای عضله قلبی محتوای کاسپاز-3 را اندازهگیری کردهاند. ﺷﺎﻳﺪ ﺗﻔﺎوت در ﭘﺎراﻣﺘﺮﻫﺎی ﺗﻤﺮﻳﻨﻲ ﻣﺜﻞ ﺷﺪت، ﻣﺪت، ﻧﻮع ﺗﻤﺮﻳﻦ و همچنین ﺑﺎﻓﺖ ﻣﻮرد ﺑﺮرﺳﻲ ﺑﺎﻋﺚ ﻣﻐﺎﻳﺮت در ﻧﺘﺎﻳﺞ ﺷﻮد. در تحقیقی دیگر صدیقی و همکاران (2019) به بررسی تاثیر تمرین هوازی بر روی محتوای پروتئین کاسپاز-3 بافت قلب پرداختند. محتوای پروتئین کاسپاز-3 گروه تمرین افزایش معنیداری یافته بود. با این وجود این محققان بیان کردند به نظر میرسد تمرین هوازی با شدت متوسط میتواند باعث تعدیل برخی عوامل مؤثر بر آپوپتوز بافت قلبی موشهای صحرایینر شود (38). از دﻳﮕﺮ ﻧﺘﺎﻳﺞ تحقیقهای انجام شده ﻛﺎﻇﻤﻲ و ﻫﻤﻜﺎران (2018) در ﭘﮋوﻫﺸﻲ ﻧﺸﺎن دادﻧﺪ ﻛﻪ ﻳﻚ دوره ﺗﻤﺮﻳﻦ اﺳﺘﻘﺎﻣﺘﻲ ﺑﺎﻋﺚ اﻓﺰاﻳﺶ ﻣﻌﻨﻲدار ﺑﻴﺎن ﻛﺎﺳﭙﺎز-3 در ﻣﻮش ﻫﺎی ﻣﺒﺘﻼ ﺑﻪ ﺳﺮﻃﺎن ﺳﻴﻨﻪ میشود (39). همچنین Li و ﻫﻤﻜﺎران ﻧﻴﺰ ﻧﺸﺎن دادﻧﺪ ﻛﻪ ﻓﻌﺎﻟﻴﺖ ورزﺷﻲ ﻣﻴﺰان آﭘﻮﭘﺘﻮز را ﺑﺎ اﻓﺰاﻳﺶ ﻓﻌﺎﻟﻴﺖ ﻛﺎﺳﭙﺎز-3 در ﻣﺪل ﻣﻮشﻫﺎی ﺳﻜﺘﻪ ﻣﻐﺰی اﻓﺰاﻳﺶ ﻣﻲدﻫﺪ (40)؛ ﺑﺎ اﻳﻦ وﺟﻮد اﻛﺜﺮ ﻣﻄﺎﻟﻌﺎت ﻧﺸﺎن ﻣﻲدﻫﺪ ﻛﻪ ﻣﻴﺰان ﻛﺎﺳﭙﺎز-3 ﺑﻪدﻧﺒﺎل ﻓﻌﺎﻟﻴﺖﻫﺎی ورزﺷﻲ دارای ﻛﺎﻫﺶ ﻣﻲﺑﺎﺷﺪ (41،42). Seo و ﻫﻤﻜﺎران ﻧﺸﺎن دادﻧﺪ ﻛﻪ ﺳﻄﺢ ﭘﺮوﺗﺌﻴﻦ ﻛﺎﺳﭙﺎز-3 ﻋﻀﻠﻪ ﻧﻌﻠﻲ ﭘﺲ از ﻫﺸﺖ ﻫﻔﺘﻪ ﺗﻤﺮﻳﻦ در آزﻣﻮدﻧﻲﻫﺎی ﮔﺮوه ﺗﻤﺮﻳﻦ و ﻛﻨﺘﺮل ﺗﻔﺎوت ﻣﻌﻨﻲداری ﻧﺪاﺷﺖ (43). همچنین، Kim و ﻫﻤﻜﺎران ﮔﺰارش ﻛﺮدﻧﺪ ﻛﻪ ﺑﻴﻦ ﮔﺮوهﻫﺎی ﺗﻤﺮﻳﻦ و ﻛﻨﺘﺮل در ﺑﻴﺎن ﭘﺮوﺗﺌﻴﻦ ﻛﺎﺳﭙﺎز-3 ﭘﺲ از ﻫﺸﺖ ﻫﻔﺘﻪ ﺗﻤﺮﻳﻦ روی ﻧﻮارﮔﺮدان ﺗﻔﺎوت ﻣﻌﻨﻲداری وﺟﻮد ﻧﺪارد (44). ﻛﻨﺘﺮل ﻛﺎﺳﭙﺎز-3 ﻓﺮآﻳﻨﺪ ﭘﻴﭽﻴﺪهای دارد و ﭼﻨﺪﻳﻦ ﻣﺴﻴﺮ ﭘﻴﺎمرﺳﺎﻧﻲ آﭘﻮﭘﺘﻮز را درﮔﻴﺮ ﻣﻲﻛﻨﺪ. ﻧﺸﺎن داده ﺷﺪه ﻛﻪ ﻛﺎﺳﭙﺎز-3 ﺑﻪوﺳﻴﻠﻪ ﻓﻌﺎلﺷﺪن ﻛﺎﺳﭙﺎز-12 از ﻃﺮﻳﻖ ﻣﺴﻴﺮ آزادﺳﺎزی ﻛﻠﺴﻴﻢ ﻳﺎ ﺑﻪ وﺳﻴﻠﻪ ﻓﻌﺎلﺷﺪن ﻛﺎﺳﭙﺎز-9 در ﻣﺴﻴﺮ داﺧﻠﻲ و ﻳﺎ اﻓﺰاﻳﺶ TNF-α ﺳﺮم در ﻣﺴﻴﺮ ﺧﺎرﺟﻲ ﻓﻌﺎل ﻣﻲﺷﻮد (45). ﺑﻨﺎﺑﺮاﻳﻦ، ﺣﻔﻆﺷﺪن ﻓﻌﺎﻟﻴﺖ ﻛﺎﺳﭙﺎز-3 ﭘﺲ از ﺗﻤﺮﻳﻨﺎت ورزﺷﻲ ﻣﻤﻜﻦ اﺳﺖ ﺑﺮای ﺳﺎﻳﺮ اﻋﻤﺎل ﺳﻠﻮﻟﻲ از ﻗﺒﻴﻞ ﺗﻐﻴﻴﺮ ﺣﺎﻟﺖ ﻧﺎﺷﻲ از ﻓﻌﺎﻟﻴﺖ ورزﺷﻲ و ﺗﻔﻜﻴﻚ ﺳﻠﻮلﻫﺎی ﻣﺎﻫﻮارهای ﻣﻮرد ﻧﻴﺎز ﺑﺎﺷﺪ، ﻛﻪ ﻫﻨﻮز ﻣﻮرد ﺑﺮرﺳﻲ ﻗﺮار ﻧﮕﺮﻓﺘﻪاﻧﺪ. ﻋﺪم وﺟﻮد ﻛﺎﻫﺶ در ﻓﻌﺎﻟﻴﺖ و ﺑﻴﺎن ﻛﺎﺳﭙﺎز-3 در ﻧﺘﻴﺠﻪ ﺗﻤﺮﻳﻦ ورزﺷﻲ ﻣﻤﻜﻦ اﺳﺖ ﻧﺘﻴﺠﻪ ﻛﺎﻫﺶ ﭼﺸﻤﮕﻴﺮ ﺳﻄﻮح مهارکننده قوی کاسپاز-3 (XIAP) X-Linked Inhibitor Of Apoptosis و افزایش مهارکننده XIAP (SMAC) Second Mitochondria-Derived Activator of Caspases باشد (46). همچنین این احتمال وجود دارد که افزایش TNF-α و IL-6 پلاسما با فعالکردن مستقیم ﻛﺎﺳﭙﺎز-3 از ﻃﺮﻳﻖ ﻣﺴﻴﺮﻫﺎی ﺧﺎرﺟﻲ ﻣﻴﺎﻧﺠﻲﮔﺮی ﻛﺮده، ﺑﺎﻋﺚ ﺣﻔﻆ و اﻓﺰاﻳﺶ ﻛﺎﺳﭙﺎز-3 ﺷﻮد (47)؛ در این راستا برخی از شواهد و مدارک حاکی از این است که پروتئین P53 یا سرکوبگر تومور از طریق فعالسازی فرآیند آپوپتوز باعث ممانعت از تکثیر و ترمیم سلولهای عضلانی (اسکلتی و قلبی) و منجر به تسریع مرگ سلولی میشود (48). این امر اغلب بهواسطه مسیر داخلی یا میتوکندریایی آپوپتوز و افزایش نفوذپذیری غشای خارجی میتوکندری و در نتیجه رهایش عوامل آپوپتوزی به داخل سیتوپلاسم انجام میشود. در این بین سیتوکروم- Cytochrome C بهعنوان یکی از مهمترین عوامل آپوپتوزی که در فضای بین غشایی میتوکندری قرار دارد، با افزایش نفوذپذیری غشای خارجی میتوکندری به داخل سیتوزولها رها شده و موجب راهاندازی واکنشهای کاسپازی در مسیر داخلی میشود. سیتوکروم-C با اتصال به فاکتور فعالکننده آپوپتوز-1 (Apaf-1) Apoptotic Protease Activating Factor موجب فعالسازی پروکاسپاز-9 و سپس کاسپاز 9 بهعنوان کاسپاز آغازگر آپوپتوز در مسیر میتوکندریایی میشود. این روند نهایتاً موجب فعالسازی کاسپاز-3 بهعنوان کاسپاز اجرایی و فصل مشترک همه مسیرهای آپوپتوزی میگردد. کاسپازها پس از فعالشدن، بسیاری از پروتئینهای حیاتی سلولی را هیدرولیز و تجزیه میکنند و باعث ورود سلول به مرحله غیرقابل برگشت مرگ سلولی میشوند (51-49). البته، سنجش پروتئین P53 و کاسپاز-3 بهتنهایی برای ارزیابی تغییرات اندازه ناحیه آسیبدیده قلب در پاسخ به تمرینات ورزشی کافی نیست و به نظر میرسد که نقش سایر پروتئینهای درگیر در فرآیند آپوپتوز و نکروزه شدن میوسیت قابل توجه باشند. همچنین در زمینه مرگ سلولی، سایر مکانیسمها مانند نکروز و اوتوفاژی نیز دخیل هستند (52).
نتیجه گیری
بهطور کلی تمرینات ورزشی (حجم، شدت و ماهیت فعالیت تمرینی بر این روابط تأثیر میگذارد) تنوعی از پروتئینهای مسیر آپوپتوز را تغییر (فعال یا غیرفعال) میدهد. نتایج تحقیق حاضر نشان داد که تمرین HIIT با وجود تغییر ندادن محتوای پروتئین کاسپاز-3 منجر به کاهش محتوای بافتی قلب پروتئین P53 میشود. این کاهش میتواند نشاندهنده این باشد که مسیر آپوپتوز مربوط به این دو پروتئین فعال نشده است؛ بنابراین، میتوان گفت که تمرینات HIIT میتواند در قلب افراد دیابتی نوع 1 که مستعد کاردیومیوپاتی و مرگ سلولی هستند، نقش یک عامل بازدارنده را ایفا میکند. با این وجود سازگاری که از طریق آن بتوان آثار سودمندی تمرینات ورزشی بر مسیر آپوپتوز در بدن پی برد هنوز ناشناخته است؛ بنابراین باید تحقیقات بیشتری انجام شود که آیا تمرینات ورزشی که منجر به فعال شدن مسیر آپوپتوز در بدن میشود در دراز مدت سودمند هستند یا اینکه سبب آسیبهای جدی به بدن میشود.
سپاسگزاری
این پژوهش حاصل تلاش پایاننامه انجام شده در دانشگاه شیراز و دانشگاه علوم پزشکی شیراز میباشد. از تمامی افرادی که در این امر مهم ما را یاری کردند، تشکر میشود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
بهطور عادی تکثیر و تمایز سلولها توسط یک سازوکار کاملاً حسابشده و در پاسخ به نیازهای مختلف انجام میشود. در یک موجود جوان به موازات افزایش تکثیر سلولی، افزایش مرگ سلولی را نیز شاهد هستیم، به طوریکه این دو با یکدیگر در یک حالت تعادل قرار میگیرند (1). مرگ برنامهریزیشده سلولی یا آپوپتوز Apoptosis نوعی مرگ سازمانیافته است که در تکامل جنینی و یا سلولهای آسیب دیده خاص (مانند آسیبهایی که به DNA سلولی وارد میشود) روی میدهد. برخلاف نکروزNecrosis ، در آپوپتوز محتویات سلولی به بیرون نمیریزد و پاسخ التهابی ایجاد نمیگردد. در واقع در طی آپوپتوز سلولها به کمک آنزیمهای پروتئولیتیک خاصی (کاسپازها) بهصورت وزیکولهای کوچک و دارای غشاء در میآیند (2). کاردیومیوپاتی دیابتی Diabetic Cardiomyopathy یک عارضه شایع دیابت و علت مرگ و میر در بیماران دیابتی میباشد که در دیابت نوع 1 یا نوع 2 اتفاق میافتد (3). این عارضه توسط مجموعهای از ناهنجاریهای ساختاری و عملکردی در قلب بیماران دیابتی از جمله اختلال در انقباض دیاستولیکDiastolic و سیستولیکSystolic، هیپرتروفی کاردیومیوسیت، آپوپتوز و فیبروزFibrosis قلبی مشخص میشود (4). در بررسیهای اخیر بر روی افراد مبتلا به دیابت نشان داده شده است که قلب این افراد بر اثر کاردیومیوپاتی دیابتی منجر نارسایی قلبی میشود و در بافت قلبی آنها نکروز و آپوپتوز افزایش مییابد (5). سازوکارهای پایه برای افزایش میزان آپوپتوز شامل افزایش تولید رادیکالهای آزاد اکسیژن (ROS)Reactive Oxygen Species ، افزایش سیتوکینهای التهابی و شیمیایی، فعالسازی کاسپازها، آپوپتوز وابسته به گیرنده Fas و وابسته به میتوکندری، استرس ریتوکلوم آندوپلاسمی (ER)Endoplasmic Reticulum ، افزایش فعالشدن مسیر سیگنالینگTransforming Growth Factor Beta TGF-β، فعالسازی موضعی سیستم رنین-آنژیوتانسین-آلدوسترون (RAAS) Renin-Angiotensin-Aldosterone System، مقاومت IGF-1 است (9-6). آپوپتوز و مسیر آبشاری آپوپتوز میتواند از داخل و یا خارج سلول آغاز شود و نیز میتواند به پروتئین P53 وابسته و یا مستقل از آن باشد (10). پروتئین P53 در تنظیم آپوپتوز نقش مهمی دارد. این پروتئین از ٣۹٣ آمینواسید ساخته شده است و نام پروتئین P53، از وزن مولکولی آن گرفته شده که برابر با ٥٣ کیلو دالتون است (11). در سلولهایی که بعد از آسیب DNA نقاط کنترل چرخه سلولی فعال میگردند، درصورتیکه ترمیم انجام نشود، آپوپتوز بهصورت وابسته به P53 صورت میگیرد. بعد از تولید P53 چندین ژن (Bax و Fas) تحت تأثیر این پروتئین بیان میشوند که باعث تقویت مسیر آپوپتوز میشود (12). کاسپاز-3Caspase، مؤثرترین کاسپاز شناخته شده در آپوپتوز است. کاسپاز-3، همچنین بهعنوان apopain، SCA-1، Yama و CPP32 نیز شناخته می¬شود و یک پروتئاز سیستئین-آسپارتات خاص میباشد. ژن کاسپاز-3 در انسان یک پروتئین سیتوپلاسمی است که بسیار زیاد در ریه، طحال، قلب، کبد، کلیهها و سلولهای سیستم ایمنی بدن بیان میشود (13). کاسپاز-3 یکی از عوامل اجرایی آپوپتوز است که بهنوبه خود مسئول شکستن پروتئولیتیکی جزئی و کلی بسیاری از پروتئینهای مهم میباشد. در طول اجرای آبشار آپوپتوز، کاسپاز-3 فعالشده و منجر به رهاسازی پروتئینSterol Regulatory Element-Binding Proteins SREBP از غشاء و ER در یک واکنشهای پروتئولیتیک میشود. کاسپاز-3 همچنین کاسپازهای 6، 7 و 9 را فعال میکند (14). القای آپوپتوز بهعنوان یکی از آسیبهای دیابت بر میوکارد توسط فعالسازی اجزای مسیر آپوپتوز و فعالیت کاسپاز نشان داده شده و مرگ سلولهای میوکاردی بهعنوان یک اتفاق مهم در پیشرفت آسیب قلبی ناشی از دیابت شناختهشده است (15). مطالعههای اخیر نشاندهنده افزایش شیوع آپوپتوز در قلب بیماران دیابتی و دیابت القا شده بهوسیله استرپتوزوتوسین (STZ) Strepotozocin در مدل حیوانی هستند (16). مطالعات مختلف نشان دادند که دیابت میزان آپوپتوز را در سلولهای قلبی به میزان چشمگیری افزایش میدهد (17). تأثیر تمرینهای ورزشی با شدتها و حجمهای مختلف بر فرآیند آپوپتوز توجه بسیاری از محققان را به خود جلب کرده است. با اینحال نتایج برخی از مطالعهها در این حوزه متناقض هستند. تمرین تناوبی با شدت بالا (HIIT) High-Intensity Interval Training ازجمله فعالیتهای ورزشی است که در سالهای اخیر موردتوجه ورزشکاران، مربیان و پژوهشگران علوم ورزشی قرارگرفته است. تمرینهای HIIT به جلسات تکراری نسبتاً کوتاه و متناوب تمرینی برمیگردد که اغلب با حداکثر کوشش و توان انجام میگیرد (18). در تحقیقی میردار و همکاران (1398) به بررسی تأثیر تمرینات تناوبی فزاینده بر آپوپتوز قلب موشهای جوان پرداختند. این محققان نشان دادند که 6 هفته تمرین تناوبی با شدت بالا موجب افزایش 200 و 320 درصدی آپوپتوز گروه تمرین در مقایسه با گروه کنترل 6 هفته و گروه پایه میشود (19). سیدقمی و همکاران (1396) با بررسی اثر تمرین استقامتی با شدت بالا بر بیان ژن پروتئین P53 در عضله اسکلتی به این نتیجه رسیدند که تمرینات استقامتی با شدت بالا منجر به تغییر معنیداری در بیان ژن این پروتئین نمیشود (20). در تحقیقی رنجبر و همکاران (1394) به بررسی تأثیر ده هفته تمرین هوازی زیر بیشینه دویدن بر سطوح کاسپاز-3 در موشهای صحرایی با انفارکتوس قلبی پرداختند. گروه تمرین به مدت 10 هفته تمرین ورزشی دویدن بر روی تردمیل (هر هفته 5 جلسه و هر جلسه 50 دقیقه با سرعت 17 متر بر دقیقه معادل 55 درصد ظرفیت هوازی) را انجام دادند. سطوح کاسپاز-3 تغییر معنیداری نیافته بود. این محققان بیان کردند که تمرینات هوازی منجر به کاهش مرگ سلولی قلبی میشود (21). بنابراین، یافتهها حاکی از آن است که پروتکلهای ورزشی مختلف تأثیرات متفاوتی بر عوامل آپوپتوزی دارد. شدت تمرینات میتواند از عوامل تأثیرگذار مهم در این زمینه باشد. بنابراین، با توجه به نقشهای بسیار مهم پروتئینهای P53 و کاسپاز-3 در تنظیم مسیر آپوپتوزی نقش مهمی را ایفا میکنند. همچنین مشخص شده است که بیماران دیابتی مستعد عارضه کاردیومیوپاتی و مرگ سلولی در قلب خود هستند. از طرفی دیگر، تمرینات ورزشی را میتوان بهعنوان یک عامل محافظتی برای قلب بیماران دیابتی در نظر گرفت. تحقیقات بسیاری نشان دادهاند که تمرینات ورزشی، منجر به تغییرات ساختاری و عملکردی قلبی میشود. تحقیقات بسیار کمی، نقش سازوکار سلولی آپوپتوز را در قلب افراد دیابتی نوع 1 بررسی کردهاند؛ بنابراین، هدف از تحقیق حاضر، بررسی تأثیر شش هفته تمرین تناوبی با شدت بالا و استقامتی بر میزان پروتئینهای P53، فرم اولیه (Pro) و فرم فعالشده (Cleaved) کاسپاز-3 در بافت عضله قلب موشهای صحرایینر مبتلابه دیابت نوع 1 میباشد.
روش بررسی
پژوهش حاضر از نوع تجربی-بنیادی میباشد که بهصورت گروه آزمایش و کنترل انجام گرفت؛ در این پژوهش، 12 سر موش صحرایینر 2 ماهه از نژاد اسپراگداولی با میانگین وزن 20±300 گرم انتخاب شدند. موشهای صحرایی در حیوان خانه دانشگاه علوم پزشکی شیراز با دمای 2±22 درجه سانتیگراد، رطوبت 50-40 درصد و چرخه تاریکی-روشنایی 12-12 ساعت نگهداری شدند. غذای موشهای صحرایی بهصورت پلت مخصوص حیوانات آزمایشگاهی از دانشگاه علوم پزشکی شیراز تهیه شد. همچنین آب مورد نیاز حیوانات بهصورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. اصول اخلاقی (کد اخلاقی IR.SUMS.REC.1396.S1062) مطالعه مطابق با اصول کار با حیوانات آزمایشگاهی مصوب دانشگاه علوم پزشکی شیراز موردتوجه قرار گرفت.
روش القاء دیابت
برای ایجاد دیابت نوع 1 در موشها، محلول استرپتوزوتوسین (STZ) (حلشده در بافر سیترات 0/1 مولار با 4/5=ph) بهصورت داخل صفاقی و فقط یک مرتبه با دوز 50 میلیگرم به ازای هر کیلوگرم از وزن بدن تزریق گردید. جهت اطمینان از دیابتی شدن حیوانها، قند خون آنها 72 ساعت پس از تزریق با کمک گلوکومتر و نمونه خونی گرفتهشده از سیاهرگ دمی موشها اندازهگیری شد؛ قند خون بالای 300 میلیگرم بر دسیلیتر بهعنوان شاخص دیابتی شدن نوع 1 در نظر گرفته شد (23،22).
پروتکل تمرینی
پس از القای دیابت موشهای صحرایی به روش تصادفی به 2 گروه: گروه تمرین دیابتی (6 سر) و کنترل دیابتی (6 سر) تقسیم شدند. موشهای گروههای تمرین برای آشنایی با نوارگردان به مدت یک هفته (4 روز در هفته) با سرعت 5 تا 10 متر بر دقیقه، روی نوارگردان دویدند. برنامه گروه تمرینی به مدت 4 هفته و هر هفته 4 جلسه بود. موشهای تمرینی در شروع هر جلسه با سرعتی حدود 10 تا 12 متر بر دقیقه گرم میکردند. سپس برنامه تمرینی شامل 5 مرحله 4 دقیقهای با شدت معادل 85 تا 95 درصد حداکثر سرعت و دورههای استراحت فعال 3 دقیقهای با شدت معادل 50 تا 60 درصد حداکثر سرعت انجام شد. در پایان هر جلسه نیز موشها با سرعتی حدود 10 تا 12 متر بر دقیقه سرد میکردند. کل مدتزمان دویدن موشهای صحرایی در هر جلسه بر روی نوارگردان 44 دقیقه بود. شیب نوارگردان صفر درجه و در 4 هفته تغییری نداشت (24).
آزمون اندازهگیری حداکثر سرعت
آزمون اندازهگیری حداکثر سرعت با سرعت 5 متر در دقیقه شروع و هر 3 دقیقه، سرعت نوارگردان 5 متر در دقیقه افزایش یافت تا موشهای صحرایی به خستگی (چسبیدن موشها بهانتهای نوارگردان) برسند. سرعتی که در آن موشهای صحرایی به خستگی رسیدند، بهعنوان حداکثر سرعت در نظر گرفته شد (25). در این مدت، گروه کنترل هیچگونه برنامه تمرینی نداشتند. همچنین موشهای صحرایی هیچگونه درمانی با انسولین را در طول دوره پژوهش نداشتند.
روش بافتبرداری
برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل استرس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 24 ساعت پس از آخرین جلسه تمرین، موشها با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس بافت عضله قلبی از بدن حیوان برداشته شد و در سرم فیزیولوژیک شستشو داده و سپس بلافاصله با استفاده از مایع ازت منجمد و برای سنجشهای بعدی با دمای 80 فریزر شد (26).
اندازهگیری متغیرهای بیوشیمیایی
با استفاده از روش آزمایشگاهی وسترن-بلات پروتئینهای P53 و کاسپاز-3 اندازهگیری شد. در این روش ابتدا مخلوط بافت قلب در لیزکننده ریپا (RIPA) RIPA Lysis Buffer System حاوی آنتی پروتئاز کوکتیل (sigma) تهیه شد و پس از سانتریفوژ در 12000 دور در دقیقه و مخلوط کردن با محلول نمونه، با الکتروفورز (مدل عمودی، شرکت BioRad، ساخت آمریکا) در ژل آکریلامید حاوی سدیم دودسیل سولفات (Sodium dodecyl sulfate; SDS) تفکیک شدند. بعد از تفکیک، باندهای پروتئینی بر روی غشا ترانسفرشده (غشاء دیفورید پلیوینیلیدینPolyvinylidene difluoride (PVDF) membrane sigma) و بعد از پوشاندن غشا با محلول سرم آلبومین گاوی 3 درصد به مدت یک ساعت در دمای آزمایشگاه در معرض آنتیبادی اولیه خرگوشی آنتیبادی-P53 با شماره سریال (DP-1) (sc-126) و آنتیبادی-کاسپاز-3 با شماره سریال (31A1067) (Sc-56053) رقیقشده (500/1) در محلول پوشاننده به مدت یک شب در دمای 4 درجه قرار داده شدند. پس از سه بار شستشو با محلول فسفات نمکی تویندار با آنتیبادی ثانویه ضد خرگوشی متصل به HRP (sc-2004) در دمای اتاق به مدت یک ساعت مجاور گردیدند. ایمیون کمپلکسهای ایجادشده با روش پرتوزایی شیمیایی و استفاده از فیلم رادیوگرافی بهظهور رسیدند. دانسیته باندها توسط نرمافزار Image J (نسخه 112/0/8/1) اندازهگیری شد و نتایج بعد از نرمالیزه شدن در مقابل کنترل داخلی (بتا-اکتین) بهصورت چند برابر گروه از کنترل ارائه شدند (27).
تجزیه و تحلیل آماری
ابتدا از آزمون کالموگروف اسمیرنوف (KS) برای تعیین نرمالیتی توزیع دادههای پژوهش استفاده شد. با توجه به نرمال بودن توزیع نمرات در متغیرها، از آزمون پارامتریک t مستقل برای مقایسه بین گروهی استفاده شده است. تجزیه و تحلیل دادهها، با استفاده از نرمافزارversion 16 SPSS انجامگرفته است. سطح معنیداری تجزیه و تحلیل آماری تحقیق حاضر، p≤0/05 در نظر گرفتهشده است.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شیراز تایید شده است (کد اخلاق IR.SUMS.REC.1396.S1062)
نتایج
در پایان پژوهش، نتایج نشان دادند که به دنبال چهار هفته تمرین HIIT، کاهش معنیداری در محتوای پروتئین P53 بین گروههای تمرین دیابتی و کنترل دیابتی در بافت عضله قلبی وجود دارد (P=0/003) (شکل 1). از طرفی، چهار هفته تمرین HIIT منجر به تغییر معنیداری در محتوای پروتئین کاسپاز-3 در فرم فعالشده (Cleaved) (P=0/71) و فرم اولیه (Pro) (P=0/15) بین گروههای تمرین دیابتی و کنترل دیابتی در بافت عضله قلبی نشد (شکل 2).

شکل 1: مقایسه محتوای پروتئین P53 در گروههای مورد مطالعه.
(A). تصاویر وسترنبلات پروتئین P53 و بتا-اکتین (β-actin) بهعنوان کنترل داخلی (لودینگ کنترل) در بافت عضله قلب. (B). نمودار ستونی (میانگین و انحراف استاندارد) نشاندهنده مقادیر کمیشده باندهای پروتئین P53 در مقابل کنترل داخلی

شکل 2: مقایسه محتوای پروتئین کاسپاز-3 در گروههای مورد مطالعه.
(A). تصاویر وسترنبلات پروتئین کاسپاز-3 و بتا-اکتین (β-actin) بهعنوان کنترل داخلی (لودینگ کنترل) در بافت عضله قلب. (B). نمودار ستونی (میانگین و انحراف استاندارد) نشاندهنده مقادیر کمیشده باندهای پروتئین کاسپاز-3 در مقابل کنترل داخلی
بحث
نتایج تحقیق حاضر، کاهش معنیداری را بین گروههای تمرین HIIT و کنترل در محتوای پروتئینهای P53 نشان داد؛ اما تغییر معنیداری در محتوای پروتئین کاسپاز-3 در فرم فعالشده (Cleaved) و فرم اولیه (Pro) مشاهده نشد. بیماریهای قلبی- عروقی یکی از مهمترین عوارض ناشی از دیابت میباشد. مطالعهها نشان میدهند که آترواسکلروز کرونری و کاردیومیوپاتی در اثر متابولیسم غیرطبیعی وابسته به دیابت به وجود میآید. کاردیومیوپاتی دیابتی را بهعنوان بیماری ویژهی عضله قلب بدون وجود هیچ آسیب عروقی در مدلهای حیوانی و بالینی دیابت نشان دادهاند (28). در این عارضه هرگونه افزایش غیرعادی گلوکز پلاسما، سلولهای عضله قلبی را مستعد مرگ سلولی به طریق آپوپتوز میکند و درنهایت موجب تغییر انقباضی عضلانی میشود (16). مرگ سلولی ناشی از متابولیسم غیرطبیعی میوکارد، بهعنوان علت اصلی کاردیومیوپاتیها در نظر گرفته میشود. در این حالت سلولهای عضلهی قلب با هیپرتروفی و فیبروز جبرانی به مقابله با کاهش بافت انقباضی ناشی از دیابت میپردازند (29،30). تحقیقات بسیار اندکی به بررسی محتوای پروتئینهای P53 و کاسپاز-3 بر روی آزمودنیهای دیابتی که مستعد کاردیومیوپاتی دیابتی و مرگ سلول عضله قلبی هستند، پرداختهاند. بر اساس شواهد هنوز ماهیت تمرینات ورزشی بهخصوص تمرینات HIIT بر روی مسیر آپوپتوز و پروتئینهای درگیر در این مسیر بهدرستی مشخص نشده است. با این وجود، در تحقیقی حسنپور و همکاران (2017) به بررسی تأثیر تمرین HIIT بر سطوح پروتئین P53 در قلب موشهای دیابتی نوع 2 کردند. تمرین HIIT سه جلسه در هفته با شدت 80 تا 85 درصد حداکثر سرعت برای 2 دقیقه و دورههای استراحت فعال یک دقیقه انجام شد. تمرین HIIT منجر به کاهش سطوح پروتئین P53 شد اما معنیدار نبود (31). نتایج تحقیق حسنپور و همکاران با نتایج تحقیق حاضر که منجر به کاهش محتوای پروتئین P53 شده است همسو میباشد. این نتایج نشاندهنده این مطلب میباشد که تمرینات HIIT علاوه بر سازگاریهای فیزیولوژیک منجر به افزایش مسیر آپوپتوز نمیشود. گفته شده است انجام فعالیت ورزشی طولانیمدت، عضلات بیشتری را درگیر میکند، که این امر منجر به فشار مکانیکی بیش از حد به عضلات شده و سبب آسیبهای عضلانی میشود؛ این آسیب میتواند منجر به فعالشدن مسیر آپوپتوزی شود (32) که نتایج تحقیق حاضر با این مطلب در تضاد است؛ زیرا تمرینات HIIT در تحقیق حاضر محتوای پروتئین P53 را کاهش و محتوای پروتئین کاسپاز-3 نیز تغییر معنیداری نکرده است. البته شایان ذکر است که بعضی از تحقیقات بیان کردهاند که تمرینات ورزشی منجر به افزایش پروتئینهای P53 و کاسپاز-3 میشوند و از اینرو مسیر آپوپتوزی وابسته به این دو پروتئین فعال میشود. در این راستا در تحقیقی شرفی و همکاران (2012) به بررسی اثر فعالیت ورزشی مقاومتی بر سطوح سرمی پروتئینهای کاسپاز-3 و P53، در مردان ورزشکار و غیر ورزشکار پرداختند. برنامه تمرینی یک دوره متشکل از 4 ست از 6 تمرین با 80 درصد1RM بود. سطوح سرمی پروتئینهای کاسپاز-3 و P53 بهطور قابلتوجهی بلافاصله بعد از تمرین ورزشی در گروه غیر ورزشکاران در مقایسه با گروه ورزشکاران افزایشیافته بود. نتایج تحقیق حاضر نشان میدهد که تمرین مقاومتی، بیومارکرهای آپوپتوز بهخصوص مسیر درونی آپوپتوز را تغییر میدهد (33). نتایج تحقیق شرفی و همکاران با نتایج تحقیق حاضر همسو نمیباشد؛ زیرا در تحقیق حاضر محتوای پروتئین P53 کاهش و محتوای پروتئین کاسپاز-3 تغییر (افزایش) معنیداری نیافته بود. از عوامل مهم تفاوت در نوع تمرین (مقاومتی و تناوبی) را میتوان ذکر کرد. همچنین از تفاوتهای دیگر مدتزمان (در تحقیق شرفی و همکاران یک جلسه فعالیت و در تحقیق حاضر 4 هفته بوده است)، نوع آزمودنی (در تحقیق شرفی و همکاران سالم و در تحقیق حاضر دیابتی بودند) میباشد. به این مسئله نیز باید توجه کرد که در تحقیق شرفی و همکاران سطوح سرمی پروتئینهای کاسپاز-3 و P53 در گروه غیر ورزشکاران افزایش بیشتری نسبت به ورزشکاران داشته است و این نشاندهنده این مطلب است که ورزشکاران به علت سازگاریهای فیزیولوژیکی که بهوسیله فعالیتهای ورزشی به دست میآورند کمتر مستعد آپوپتوز سلولی در اندام خود هستند. با این وجود یکی از فرضیههای اصلی آپوپتوز این است که فعالیتهای ورزشی، متابولیسم بدن را افزایش میدهد که منجر به افزایش تولید ROS میشود. مقدار چشمگیر گونههای واکنشی اکسیژن مسبب تخریب DNA است و از این طریق مستقیماً سبب آپوپتوز میشوند (34). استرس اکسیداتیو ایجاد شده بهوسیله دیابت نیز ممکن است نقش مهمی در ایجاد آپوپتوز در شرایط هیپرگلیسمی داشته باشد. در اثر عدم تعادل بین تولید شکلهای باز ROS و عوامل آنتیاکسیدان که سبب حذف ROS میشود، استرس اکسیداتیو به وجود میآید. در قلب یک فرد دیابتی تجمع ROS میتواند در اثر نقص میتوکندریایی، اتواکسیداسیون گلوکز، گلیکاسیون پروتئینی و افزایش فعالیت زانتین اکسیداز تقویت شود (35). در این راستا در تحقیقی طباطباییپناه و همکاران (2016) نشان دادند که افزایش استرس اکسیداتیو و بیان ژن P53 در بیماران قلبی میتواند به ترتیب بهعنوان مارکرهای قابل اعتماد برای گزارش آپوپتوزیس و آسیب DNA بهدنبال وقوع بیماری قلبی مطرح گردند. نتایج این مطالعه آشکار کرد که آپوپتوزیس در اثر افزایش بیان P53 اتفاق میافتد که ممکن است یک روش درمانی در بهبود بیماری قلبی باشد (36). در تحقیقی دیگر شیرپور و همکاران (2017) به بررسی تأثیر تمرین HIIT بر سطوح پروتئین کاسپاز-3 در هپاتوسیتهای موشهای صحرایی ماده پیر پرداختند. تمرین HIIT از سرعت 20 متر بر دقیقه به 34 متر بر دقیقه در هفته هشتم رسید. سطوح پروتئین کاسپاز-3 در گروه تمرین HIIT نسبت به گروه کنترل افزایش معنیداری یافته بود (37). نتایج تحقیق شیرپور و همکاران با نتایج تحقیق حاضر همسو نمیباشد؛ زیرا در تحقیق حاضر محتوای پروتئین کاسپاز-3 افزایش معنیداری نیافته است. از عوامل مهم در تفاوت نتایج این دو تحقیق میتوان به نوع آزمودنی و مکان اندازهگیری پروتئینها اشاره کرد. در تحقیق حاضر آزمودنیها موشهای صحرایینر دیابتی و در تحقیق شیرپور و همکاران موشهای ماده پیر بودند. همچنین محتوای پروتئین کاسپاز-3 در تحقیق شیرپور و همکاران در هپاتوسیتهای کبد اندازهگیری شده است و این در حالی است که محققان تحقیق حاضر در سلولهای عضله قلبی محتوای کاسپاز-3 را اندازهگیری کردهاند. ﺷﺎﻳﺪ ﺗﻔﺎوت در ﭘﺎراﻣﺘﺮﻫﺎی ﺗﻤﺮﻳﻨﻲ ﻣﺜﻞ ﺷﺪت، ﻣﺪت، ﻧﻮع ﺗﻤﺮﻳﻦ و همچنین ﺑﺎﻓﺖ ﻣﻮرد ﺑﺮرﺳﻲ ﺑﺎﻋﺚ ﻣﻐﺎﻳﺮت در ﻧﺘﺎﻳﺞ ﺷﻮد. در تحقیقی دیگر صدیقی و همکاران (2019) به بررسی تاثیر تمرین هوازی بر روی محتوای پروتئین کاسپاز-3 بافت قلب پرداختند. محتوای پروتئین کاسپاز-3 گروه تمرین افزایش معنیداری یافته بود. با این وجود این محققان بیان کردند به نظر میرسد تمرین هوازی با شدت متوسط میتواند باعث تعدیل برخی عوامل مؤثر بر آپوپتوز بافت قلبی موشهای صحرایینر شود (38). از دﻳﮕﺮ ﻧﺘﺎﻳﺞ تحقیقهای انجام شده ﻛﺎﻇﻤﻲ و ﻫﻤﻜﺎران (2018) در ﭘﮋوﻫﺸﻲ ﻧﺸﺎن دادﻧﺪ ﻛﻪ ﻳﻚ دوره ﺗﻤﺮﻳﻦ اﺳﺘﻘﺎﻣﺘﻲ ﺑﺎﻋﺚ اﻓﺰاﻳﺶ ﻣﻌﻨﻲدار ﺑﻴﺎن ﻛﺎﺳﭙﺎز-3 در ﻣﻮش ﻫﺎی ﻣﺒﺘﻼ ﺑﻪ ﺳﺮﻃﺎن ﺳﻴﻨﻪ میشود (39). همچنین Li و ﻫﻤﻜﺎران ﻧﻴﺰ ﻧﺸﺎن دادﻧﺪ ﻛﻪ ﻓﻌﺎﻟﻴﺖ ورزﺷﻲ ﻣﻴﺰان آﭘﻮﭘﺘﻮز را ﺑﺎ اﻓﺰاﻳﺶ ﻓﻌﺎﻟﻴﺖ ﻛﺎﺳﭙﺎز-3 در ﻣﺪل ﻣﻮشﻫﺎی ﺳﻜﺘﻪ ﻣﻐﺰی اﻓﺰاﻳﺶ ﻣﻲدﻫﺪ (40)؛ ﺑﺎ اﻳﻦ وﺟﻮد اﻛﺜﺮ ﻣﻄﺎﻟﻌﺎت ﻧﺸﺎن ﻣﻲدﻫﺪ ﻛﻪ ﻣﻴﺰان ﻛﺎﺳﭙﺎز-3 ﺑﻪدﻧﺒﺎل ﻓﻌﺎﻟﻴﺖﻫﺎی ورزﺷﻲ دارای ﻛﺎﻫﺶ ﻣﻲﺑﺎﺷﺪ (41،42). Seo و ﻫﻤﻜﺎران ﻧﺸﺎن دادﻧﺪ ﻛﻪ ﺳﻄﺢ ﭘﺮوﺗﺌﻴﻦ ﻛﺎﺳﭙﺎز-3 ﻋﻀﻠﻪ ﻧﻌﻠﻲ ﭘﺲ از ﻫﺸﺖ ﻫﻔﺘﻪ ﺗﻤﺮﻳﻦ در آزﻣﻮدﻧﻲﻫﺎی ﮔﺮوه ﺗﻤﺮﻳﻦ و ﻛﻨﺘﺮل ﺗﻔﺎوت ﻣﻌﻨﻲداری ﻧﺪاﺷﺖ (43). همچنین، Kim و ﻫﻤﻜﺎران ﮔﺰارش ﻛﺮدﻧﺪ ﻛﻪ ﺑﻴﻦ ﮔﺮوهﻫﺎی ﺗﻤﺮﻳﻦ و ﻛﻨﺘﺮل در ﺑﻴﺎن ﭘﺮوﺗﺌﻴﻦ ﻛﺎﺳﭙﺎز-3 ﭘﺲ از ﻫﺸﺖ ﻫﻔﺘﻪ ﺗﻤﺮﻳﻦ روی ﻧﻮارﮔﺮدان ﺗﻔﺎوت ﻣﻌﻨﻲداری وﺟﻮد ﻧﺪارد (44). ﻛﻨﺘﺮل ﻛﺎﺳﭙﺎز-3 ﻓﺮآﻳﻨﺪ ﭘﻴﭽﻴﺪهای دارد و ﭼﻨﺪﻳﻦ ﻣﺴﻴﺮ ﭘﻴﺎمرﺳﺎﻧﻲ آﭘﻮﭘﺘﻮز را درﮔﻴﺮ ﻣﻲﻛﻨﺪ. ﻧﺸﺎن داده ﺷﺪه ﻛﻪ ﻛﺎﺳﭙﺎز-3 ﺑﻪوﺳﻴﻠﻪ ﻓﻌﺎلﺷﺪن ﻛﺎﺳﭙﺎز-12 از ﻃﺮﻳﻖ ﻣﺴﻴﺮ آزادﺳﺎزی ﻛﻠﺴﻴﻢ ﻳﺎ ﺑﻪ وﺳﻴﻠﻪ ﻓﻌﺎلﺷﺪن ﻛﺎﺳﭙﺎز-9 در ﻣﺴﻴﺮ داﺧﻠﻲ و ﻳﺎ اﻓﺰاﻳﺶ TNF-α ﺳﺮم در ﻣﺴﻴﺮ ﺧﺎرﺟﻲ ﻓﻌﺎل ﻣﻲﺷﻮد (45). ﺑﻨﺎﺑﺮاﻳﻦ، ﺣﻔﻆﺷﺪن ﻓﻌﺎﻟﻴﺖ ﻛﺎﺳﭙﺎز-3 ﭘﺲ از ﺗﻤﺮﻳﻨﺎت ورزﺷﻲ ﻣﻤﻜﻦ اﺳﺖ ﺑﺮای ﺳﺎﻳﺮ اﻋﻤﺎل ﺳﻠﻮﻟﻲ از ﻗﺒﻴﻞ ﺗﻐﻴﻴﺮ ﺣﺎﻟﺖ ﻧﺎﺷﻲ از ﻓﻌﺎﻟﻴﺖ ورزﺷﻲ و ﺗﻔﻜﻴﻚ ﺳﻠﻮلﻫﺎی ﻣﺎﻫﻮارهای ﻣﻮرد ﻧﻴﺎز ﺑﺎﺷﺪ، ﻛﻪ ﻫﻨﻮز ﻣﻮرد ﺑﺮرﺳﻲ ﻗﺮار ﻧﮕﺮﻓﺘﻪاﻧﺪ. ﻋﺪم وﺟﻮد ﻛﺎﻫﺶ در ﻓﻌﺎﻟﻴﺖ و ﺑﻴﺎن ﻛﺎﺳﭙﺎز-3 در ﻧﺘﻴﺠﻪ ﺗﻤﺮﻳﻦ ورزﺷﻲ ﻣﻤﻜﻦ اﺳﺖ ﻧﺘﻴﺠﻪ ﻛﺎﻫﺶ ﭼﺸﻤﮕﻴﺮ ﺳﻄﻮح مهارکننده قوی کاسپاز-3 (XIAP) X-Linked Inhibitor Of Apoptosis و افزایش مهارکننده XIAP (SMAC) Second Mitochondria-Derived Activator of Caspases باشد (46). همچنین این احتمال وجود دارد که افزایش TNF-α و IL-6 پلاسما با فعالکردن مستقیم ﻛﺎﺳﭙﺎز-3 از ﻃﺮﻳﻖ ﻣﺴﻴﺮﻫﺎی ﺧﺎرﺟﻲ ﻣﻴﺎﻧﺠﻲﮔﺮی ﻛﺮده، ﺑﺎﻋﺚ ﺣﻔﻆ و اﻓﺰاﻳﺶ ﻛﺎﺳﭙﺎز-3 ﺷﻮد (47)؛ در این راستا برخی از شواهد و مدارک حاکی از این است که پروتئین P53 یا سرکوبگر تومور از طریق فعالسازی فرآیند آپوپتوز باعث ممانعت از تکثیر و ترمیم سلولهای عضلانی (اسکلتی و قلبی) و منجر به تسریع مرگ سلولی میشود (48). این امر اغلب بهواسطه مسیر داخلی یا میتوکندریایی آپوپتوز و افزایش نفوذپذیری غشای خارجی میتوکندری و در نتیجه رهایش عوامل آپوپتوزی به داخل سیتوپلاسم انجام میشود. در این بین سیتوکروم- Cytochrome C بهعنوان یکی از مهمترین عوامل آپوپتوزی که در فضای بین غشایی میتوکندری قرار دارد، با افزایش نفوذپذیری غشای خارجی میتوکندری به داخل سیتوزولها رها شده و موجب راهاندازی واکنشهای کاسپازی در مسیر داخلی میشود. سیتوکروم-C با اتصال به فاکتور فعالکننده آپوپتوز-1 (Apaf-1) Apoptotic Protease Activating Factor موجب فعالسازی پروکاسپاز-9 و سپس کاسپاز 9 بهعنوان کاسپاز آغازگر آپوپتوز در مسیر میتوکندریایی میشود. این روند نهایتاً موجب فعالسازی کاسپاز-3 بهعنوان کاسپاز اجرایی و فصل مشترک همه مسیرهای آپوپتوزی میگردد. کاسپازها پس از فعالشدن، بسیاری از پروتئینهای حیاتی سلولی را هیدرولیز و تجزیه میکنند و باعث ورود سلول به مرحله غیرقابل برگشت مرگ سلولی میشوند (51-49). البته، سنجش پروتئین P53 و کاسپاز-3 بهتنهایی برای ارزیابی تغییرات اندازه ناحیه آسیبدیده قلب در پاسخ به تمرینات ورزشی کافی نیست و به نظر میرسد که نقش سایر پروتئینهای درگیر در فرآیند آپوپتوز و نکروزه شدن میوسیت قابل توجه باشند. همچنین در زمینه مرگ سلولی، سایر مکانیسمها مانند نکروز و اوتوفاژی نیز دخیل هستند (52).
نتیجه گیری
بهطور کلی تمرینات ورزشی (حجم، شدت و ماهیت فعالیت تمرینی بر این روابط تأثیر میگذارد) تنوعی از پروتئینهای مسیر آپوپتوز را تغییر (فعال یا غیرفعال) میدهد. نتایج تحقیق حاضر نشان داد که تمرین HIIT با وجود تغییر ندادن محتوای پروتئین کاسپاز-3 منجر به کاهش محتوای بافتی قلب پروتئین P53 میشود. این کاهش میتواند نشاندهنده این باشد که مسیر آپوپتوز مربوط به این دو پروتئین فعال نشده است؛ بنابراین، میتوان گفت که تمرینات HIIT میتواند در قلب افراد دیابتی نوع 1 که مستعد کاردیومیوپاتی و مرگ سلولی هستند، نقش یک عامل بازدارنده را ایفا میکند. با این وجود سازگاری که از طریق آن بتوان آثار سودمندی تمرینات ورزشی بر مسیر آپوپتوز در بدن پی برد هنوز ناشناخته است؛ بنابراین باید تحقیقات بیشتری انجام شود که آیا تمرینات ورزشی که منجر به فعال شدن مسیر آپوپتوز در بدن میشود در دراز مدت سودمند هستند یا اینکه سبب آسیبهای جدی به بدن میشود.
سپاسگزاری
این پژوهش حاصل تلاش پایاننامه انجام شده در دانشگاه شیراز و دانشگاه علوم پزشکی شیراز میباشد. از تمامی افرادی که در این امر مهم ما را یاری کردند، تشکر میشود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Mukhopadhyay S, Panda Pk, Sinha N, Das Dn, Bhutia Sk. Autophagy and Apoptosis: Where Do They Meet? Apoptosis 2014; 19(4): 555-66.
2- Surget S, Khoury Mp, Bourdon Jc. Uncovering the Role of P53 Splice Variants in Human Malignancy: A Clinical Perspective. Onco Targets Ther 2013; 7: 57-68.
3- Chavali V, Tyagi Sc, Mishra Pk. Predictors and Prevention of Diabetic Cardiomyopathy. Diabetes Metab Syndr Obes 2013; 6: 151-60.
4- Huynh K, Bernardo Bc, Mcmullen Jr, Ritchie Rh. Diabetic Cardiomyopathy: Mechanisms and New Treatment Strategies Targeting Antioxidant Signaling Pathways. Pharmacol Ther 2014; 142(3): 375-415.
5- Boudina S, Abel Ed. Diabetic Cardiomyopathy, Causes and Effects. Rev Endocr Metab Disord 2010; 11(1): 31-9.
6- Huynh K, Kiriazis H, Du Xj, Love Je, Gray Sp, Jandeleit-Dahm Ka, et al. Targeting the Upregulation of Reactive Oxygen Species Subsequent to Hyperglycemia Prevents Type 1 Diabetic Cardiomyopathy in Mice. Free Radic Biol Med 2013; 60: 307-17.
7- Varma A, Das A, Hoke NN, Durrant DE, Salloum FN, Kukreja Rc. Anti-Inflammatory and Cardioprotective Effects of Tadalafil in Diabetic Mice. Plos One 2012; 7(9): E45243.
8- Sari Fr, Watanabe K, Thandavarayan Ra, Harima M, Zhang S, Muslin Aj, et al. 14-3-3 Protein Protects Against Cardiac Endoplasmic Reticulum Stress (Ers) and Ers-Initiated Apoptosis in Experimental Diabetes. J Pharmacol Sci 2010; 113(4): 325-34.
9- Ares-Carrasco S, Picatoste B, Benito-Martin A, Zubiri I, Sanz Ab, Sanchez-Nino Md, et al. Myocardial Fibrosis and Apoptosis, but Not Inflammation, are Present in Long-Term Experimental Diabetes. Am J Physiol Heart Circ Physiol 2009; 297(6): H2109-19.
10- Flusberg Da, Sorger Pk. Surviving Apoptosis: Life–Death Signaling in Single Cells. Trends Cell Biol 2015; 25(8): 446-58.
11- Surget S, Khoury Mp, Bourdon Jc. Uncovering the Role of P53 Splice Variants in Human Malignancy: A Clinical Perspective. Oncotargets Ther 2013; 7: 57.
12- Phesse Tj, Myant Kb, Cole Am, Ridgway Ra, Pearson H, Muncan V, et al. Endogenous C-Myc is Essential for P53-Induced Apoptosis in Response to Dna Damage in Vivo. Cell Death Differ 2014; 21(6): 956-66.
13- Mcilwain Dr, Berger T, Mak Tw. Caspase Functions in Cell Death and Disease. Cold Spring Harb Perspect Biol 2013; 5(4): A008656.
14- Morales-Cano D, Calviño E, Rubio V, Herráez A, Sancho P, Tejedor Mc, et al. Apoptosis Induced by Paclitaxel Via Bcl-2, Bax and Caspases 3 and 9 Activation in Nb4 Human Leukaemia Cells is Not Modulated by Erk Inhibition. Exp Toxicol Pathol 2013; 65(7-8): 1101-8.
15- Tanoorsaz S, Behpour N, Tadibi V. Investigating the Effect of Mid-Term of Aerobic Exercise on Apoptosis Biomarkers in the Cardiomyocytes of Streptozotocin-Induced Diabetic Rats. J Fasa Univ Med Sci 2018; 7(4): 488-97. (Persian)
16- Kanter M, Aksu F, Takir M, Kostek O, Kanter B, Oymagil A. Effects of Low Intensity Exercise Against Apoptosis and Oxidative Stress in Streptozotocin-Induced Diabetic Rat Heart. Expl Clin Endocrinol Diabetes 2017; 125(09): 583-91.
17- Guleria Rs, Choudhary R, Tanaka T, Baker Km, Pan J. Retinoic Acid Receptor‐Mediated Signaling Protects Cardiomyocytes from Hyperglycemia Induced Apoptosis: Role of the Renin‐Angiotensin System. J Cell Physiol 2011; 226(5): 1292-307.
18- Fisher G, Schwartz DD, Quindry J, Barberio MD, Foster EB, Jones KW, et al. Lymphocyte Enzymatic Antioxidant Responses to Oxidative Stress Following High-Intensity Interval Exercise. J Appl Physiol 2010; 110(3): 730-7.
19- Mirdar Sh, Moghadasi N, Hamidain G. Effect of High Intensity Interval Training on Heart Apoptosis of Young Ratsthe Effect of High Intensity Interval Training on Heart Apoptosis of Young Rats. Harakat 2019; 11(1): 49-61. (Persian)
20- Seyedgomi F, Bashiri J, Gholami F. Effect of High Intensity Endurance Training on P53 and Cytochrome-C Gene Expression in Male Rat Soleus Muscle. Armaghane-Danesh 2017; 22(5): 608-22. (Persian)
21- Ranjbar K, Nazem F, Nazari A, Golami MR. Effect of 10 Weeks Aerobic Exercise Training on Left Ventricular Systolic Function, Caspase-3 and Infarction Size in Myocardial Infarction Rat. J Know Health 2015; 10(3): 16-24. (Persian)
22- Thakur V, Gonzalez M, Pennington K, Nargis S, Chattopadhyay M. Effect of Exercise on Neurogenic Inflammation in Spinal Cord of Type 1 Diabetic Rats. Brain Res 2016; 1642: 87-94.
23- Moradi M, Ravasi A, Khalafi M, Talebi V. The Effect of a High Intensity Interval Exercise (Hiie) on Hypothalamic Nesfatin-1 Gene Expression of Diabetic Male Rats. Iran J Diabetes Metabol 2018; 17(3): 117-24. (Persian)
24- Sherafati Moghadam M, Salesi M, Daryanoosh F, Hemati Nafar M, Fallahi A. The Effect of 4 Weeks of High Intensity Interval Training on the Content of Akt1, Mtor, P70s6k1 and 4e-Bp1 in Soleus Skeletal Muscle of Rats with Type 2 Diabetes: An Experimental Study. JRUMS 2018; 17(9): 843-54. (Persian)
25- Garcia Nf, Sponton Ac, Delbin Ma, Parente Jm, Castro Mm, Zanesco A, et al. Metabolic Parameters and Responsiveness of Isolated Iliac Artery in Ldlr-/-Mice: Role of Aerobic Exercise Training. Am J Cardiovasc Dis 2017; 7(2): 64.
26- Shadmehri S, Sherafati Moghadam M, Daryanoosh F, Jahani Golbar Sh, Tanideh N. The Effect 8 Weeks of Endurance Exercise on the Content of Total and Phosphorylated Akt1, Mtor, P70s6k1 and 4e-Bp1 in Skeletal Muscle Fhl of Rats with Type 2 Diabetes. J Shahid Sadoughi Uni Med Sci 2019; 26(12): 1063-74. (Persian)
27- Khani M, Motamedi P, Dehkhoda Mr, Nikukheslat Sd, Karimi P. Effect of Thyme Extract Supplementation on Lipid Peroxidation, Antioxidant Capacity, Pgc-1α Content and Endurance Exercise Performance in Rats. J the International Society of Sports Nutrition 2017; 14(1): 1-8.
28- Miki T, Yuda S, Kouzu H, Miura T. Diabetic Cardiomyopathy: Pathophysiology and Clinical Features. Heart Fail Rev 2013; 18(2): 149-66.
29- Ward Ml, Crossman DJ. Mechanisms Underlying the Impaired Contractility of Diabetic Cardiomyopathy. World J Cardiol 2014; 6(7): 577-84.
30- Tarquini R, Lazzeri C, Pala L, Rotella Cm, Gensini Gf. The Diabetic Cardiomyopathy. Acta Diabetol 2011; 48(3): 173-81.
31- Hassanpour G, Azarbayjani Ma, Shakeri N, Abednazari H. The Effect of Interval and Continued Trainings with Crocin on Apoptotic Markers in the Heart Tissue of High-Fat Diet and Streptozotocin Induced Type 2 Diabetic Rats. Rep Health Care 2017; 3(3): 58-70. (Persian)
32- Marzetti E, Lawler Jm, Hiona A, Manini T, Seo Ay, Leeuwenburgh C. Modulation of Age-Induced Apoptotic Signaling and Cellular Remodeling by Exercise and Calorie Restriction in Skeletal Muscle. Free Radic Biol Med 2008; 44(2): 160-8.
33- Sharafi H, Rahimi R. The Effect of Resistance Exercise on P53, Caspase-9, and Caspase-3 in Trained and Untrained Men. J Strength Cond Re 2012; 26(4): 1142-8.
34- Wackerhage H. Molecular Exercise Physiology: An Introduction. First Published. New York. Routledge; 2014. 133-156.
35- Moradpour P, Daryanoosh F, Dashtiyan Aa, Taghi Mm, Jamhiri I. Impact of 6 Weeks of Intensive Intermittent Training with Taking Vitamin E on P53 Changes in Blood Serum Levels and Visceral Adipose Tissue in Sprague–Dawley Rats. Sport Sci 2017; 10: 98-103. (Persian)
36- Tabatabaipana A, Akbarzadeh R, Kodahi Z, Ghaderyan M. Increasing Oxidative Stress and Expression of P53, Bax and Bcl2 Genes in Patients with Myocardial Infarction. Daneshvar Med J 2016; 23(120): 1-10. (Persian)
37- Shirpour Sb, Azarbayjani Ma, Peeri M, Farzanegi P. Effect of High Intensity Interval Training with Curcumin on Gene Expression of Bax, Bcl-2, and Caspase-3 in Aged Female Rat Hepatocytes. Rep Health Care 2017; 3(3): 8-14. (Persian)
38- Sadighi A, Abdi A, Azarbayjani M A, Barari A. Effect of Aerobic Exercise on Some Factors of Cardiac Apoptosis in Male Rats. Feyz J Kashan Uni Med Sci 2019; 23(5): 495-502. (Persian)
39- Kazemi A, Mirzazadeh E. The Effect of Endurance Training on Tumor Tissue Levels of Caspase-3 and Caspase-9 in Mice with Breast Cancer. IJBD 2018; 11(3): 32-43. (Persian)
40- Li F, Shi W, Zhao Ey, Geng X, Li X, Peng C, et al. Enhanced Apoptosis from Early Physical Exercise Rehabilitation Following Ischemic Stroke. J Neurosci Res 2017; 95(4): 1017-24.
41- Akbari M, Moradi L, Abbassi Daloii A. The Effect of Endurance Training and Ziziphus Jujube Extract Consumption on Apoptosis of Cardiac Tissue in Male Wistar Rats. Feyz J Kashan Uni Med Sci 2018; 22(6): 547-54. (Persian)
42- Shokri S, Aitken Rj, Abdolvahhabi M, Abolhasani F, Ghasemi Fm, Kashani I, et al. Exercise and Supraphysiological Dose of Nandrolone Deconoate Increase Apoptosis in Spermatogenic Cells. Basic Clin Pharmacol Toxicol 2010; 106(4): 324-30.
43- Seo H, Park Ch, Choi S, Kim W, Jeon Bd, Ryu S. Effects of Voluntary Exercise on Apoptosis and Cortisol after Chronic Restraint Stress in Mice. J Exerc Nutrition Biochem 2016; 20(3): 16-23.
44- Kim Kb, Kim Ya, Park Jj. Effects of 8-Week Exercise on Bcl-2, Bax, Caspase-8, Caspase-3 and Hsp70 in Mouse Gastrocnemius Muscle. J Life Sci 2010; 20(9): 1409-14.
45- Koçtürk S, Kayatekin Bm, Resmi H, Açıkgöz O, Kaynak C, Özer E. The Apoptotic Response to Strenuous Exercise of the Gastrocnemius and Solues Muscle Fibers in Rats. Eur J Appl Physiol 2008 Mar 1; 102(5): 515-24.
46- Mcmillan Em, Graham Da, Rush Jw, Quadrilatero J. Decreased Dna Fragmentation and Apoptotic Signaling in Soleus Muscle of Hypertensive Rats Following 6 Weeks of Treadmill Training. J Appl Physiol 2012; 113(7): 1048-57.
47- Alway Se, Siu Pm. Nuclear Apoptosis Contributes To Sarcopenia. Exerc Spor Sci Rev 2008; 36(2): 51-7.
48- Speidel D. Transcription-Independent P53 Apoptosis: An Alternative Route to Death. Trends Cell Biol 2010; 20(1): 14-24.
49- Brentnall M, Rodriguez-Menocal L, Guevara Rl, Cepero E, Boise Lh. Caspase-9, Caspase-3 and Caspase-7 Have Distinct Roles during Intrinsic Apoptosis. BMC Cell Biol 2013; 14: 32.
50- Parrish AB, Freel CD, Kornbluth S. Cellular Mechanisms Controlling Caspase Activation and Function. Cold Spring Harb Perspect Biol 2013; 5(6): A008672.
51- Würstle Ml, Laussmann Ma, Rehm M. The Central Role of Initiator Caspase-9 in Apoptosis Signal Transduction and the Regulation of Its Activation and Activity on the Apoptosome. Exp Cell Res 2012; 318(11): 1213-20.
52- Tian Xf, Cui Mx, Yang Sw, Zhou Yj, Hu Dy. Cell Death, Dysglycemia and Myocardial Infarction (Review). Biomed Rep 2013; 1(3): 341-6.
1- Mukhopadhyay S, Panda Pk, Sinha N, Das Dn, Bhutia Sk. Autophagy and Apoptosis: Where Do They Meet? Apoptosis 2014; 19(4): 555-66.
2- Surget S, Khoury Mp, Bourdon Jc. Uncovering the Role of P53 Splice Variants in Human Malignancy: A Clinical Perspective. Onco Targets Ther 2013; 7: 57-68.
3- Chavali V, Tyagi Sc, Mishra Pk. Predictors and Prevention of Diabetic Cardiomyopathy. Diabetes Metab Syndr Obes 2013; 6: 151-60.
4- Huynh K, Bernardo Bc, Mcmullen Jr, Ritchie Rh. Diabetic Cardiomyopathy: Mechanisms and New Treatment Strategies Targeting Antioxidant Signaling Pathways. Pharmacol Ther 2014; 142(3): 375-415.
5- Boudina S, Abel Ed. Diabetic Cardiomyopathy, Causes and Effects. Rev Endocr Metab Disord 2010; 11(1): 31-9.
6- Huynh K, Kiriazis H, Du Xj, Love Je, Gray Sp, Jandeleit-Dahm Ka, et al. Targeting the Upregulation of Reactive Oxygen Species Subsequent to Hyperglycemia Prevents Type 1 Diabetic Cardiomyopathy in Mice. Free Radic Biol Med 2013; 60: 307-17.
7- Varma A, Das A, Hoke NN, Durrant DE, Salloum FN, Kukreja Rc. Anti-Inflammatory and Cardioprotective Effects of Tadalafil in Diabetic Mice. Plos One 2012; 7(9): E45243.
8- Sari Fr, Watanabe K, Thandavarayan Ra, Harima M, Zhang S, Muslin Aj, et al. 14-3-3 Protein Protects Against Cardiac Endoplasmic Reticulum Stress (Ers) and Ers-Initiated Apoptosis in Experimental Diabetes. J Pharmacol Sci 2010; 113(4): 325-34.
9- Ares-Carrasco S, Picatoste B, Benito-Martin A, Zubiri I, Sanz Ab, Sanchez-Nino Md, et al. Myocardial Fibrosis and Apoptosis, but Not Inflammation, are Present in Long-Term Experimental Diabetes. Am J Physiol Heart Circ Physiol 2009; 297(6): H2109-19.
10- Flusberg Da, Sorger Pk. Surviving Apoptosis: Life–Death Signaling in Single Cells. Trends Cell Biol 2015; 25(8): 446-58.
11- Surget S, Khoury Mp, Bourdon Jc. Uncovering the Role of P53 Splice Variants in Human Malignancy: A Clinical Perspective. Oncotargets Ther 2013; 7: 57.
12- Phesse Tj, Myant Kb, Cole Am, Ridgway Ra, Pearson H, Muncan V, et al. Endogenous C-Myc is Essential for P53-Induced Apoptosis in Response to Dna Damage in Vivo. Cell Death Differ 2014; 21(6): 956-66.
13- Mcilwain Dr, Berger T, Mak Tw. Caspase Functions in Cell Death and Disease. Cold Spring Harb Perspect Biol 2013; 5(4): A008656.
14- Morales-Cano D, Calviño E, Rubio V, Herráez A, Sancho P, Tejedor Mc, et al. Apoptosis Induced by Paclitaxel Via Bcl-2, Bax and Caspases 3 and 9 Activation in Nb4 Human Leukaemia Cells is Not Modulated by Erk Inhibition. Exp Toxicol Pathol 2013; 65(7-8): 1101-8.
15- Tanoorsaz S, Behpour N, Tadibi V. Investigating the Effect of Mid-Term of Aerobic Exercise on Apoptosis Biomarkers in the Cardiomyocytes of Streptozotocin-Induced Diabetic Rats. J Fasa Univ Med Sci 2018; 7(4): 488-97. (Persian)
16- Kanter M, Aksu F, Takir M, Kostek O, Kanter B, Oymagil A. Effects of Low Intensity Exercise Against Apoptosis and Oxidative Stress in Streptozotocin-Induced Diabetic Rat Heart. Expl Clin Endocrinol Diabetes 2017; 125(09): 583-91.
17- Guleria Rs, Choudhary R, Tanaka T, Baker Km, Pan J. Retinoic Acid Receptor‐Mediated Signaling Protects Cardiomyocytes from Hyperglycemia Induced Apoptosis: Role of the Renin‐Angiotensin System. J Cell Physiol 2011; 226(5): 1292-307.
18- Fisher G, Schwartz DD, Quindry J, Barberio MD, Foster EB, Jones KW, et al. Lymphocyte Enzymatic Antioxidant Responses to Oxidative Stress Following High-Intensity Interval Exercise. J Appl Physiol 2010; 110(3): 730-7.
19- Mirdar Sh, Moghadasi N, Hamidain G. Effect of High Intensity Interval Training on Heart Apoptosis of Young Ratsthe Effect of High Intensity Interval Training on Heart Apoptosis of Young Rats. Harakat 2019; 11(1): 49-61. (Persian)
20- Seyedgomi F, Bashiri J, Gholami F. Effect of High Intensity Endurance Training on P53 and Cytochrome-C Gene Expression in Male Rat Soleus Muscle. Armaghane-Danesh 2017; 22(5): 608-22. (Persian)
21- Ranjbar K, Nazem F, Nazari A, Golami MR. Effect of 10 Weeks Aerobic Exercise Training on Left Ventricular Systolic Function, Caspase-3 and Infarction Size in Myocardial Infarction Rat. J Know Health 2015; 10(3): 16-24. (Persian)
22- Thakur V, Gonzalez M, Pennington K, Nargis S, Chattopadhyay M. Effect of Exercise on Neurogenic Inflammation in Spinal Cord of Type 1 Diabetic Rats. Brain Res 2016; 1642: 87-94.
23- Moradi M, Ravasi A, Khalafi M, Talebi V. The Effect of a High Intensity Interval Exercise (Hiie) on Hypothalamic Nesfatin-1 Gene Expression of Diabetic Male Rats. Iran J Diabetes Metabol 2018; 17(3): 117-24. (Persian)
24- Sherafati Moghadam M, Salesi M, Daryanoosh F, Hemati Nafar M, Fallahi A. The Effect of 4 Weeks of High Intensity Interval Training on the Content of Akt1, Mtor, P70s6k1 and 4e-Bp1 in Soleus Skeletal Muscle of Rats with Type 2 Diabetes: An Experimental Study. JRUMS 2018; 17(9): 843-54. (Persian)
25- Garcia Nf, Sponton Ac, Delbin Ma, Parente Jm, Castro Mm, Zanesco A, et al. Metabolic Parameters and Responsiveness of Isolated Iliac Artery in Ldlr-/-Mice: Role of Aerobic Exercise Training. Am J Cardiovasc Dis 2017; 7(2): 64.
26- Shadmehri S, Sherafati Moghadam M, Daryanoosh F, Jahani Golbar Sh, Tanideh N. The Effect 8 Weeks of Endurance Exercise on the Content of Total and Phosphorylated Akt1, Mtor, P70s6k1 and 4e-Bp1 in Skeletal Muscle Fhl of Rats with Type 2 Diabetes. J Shahid Sadoughi Uni Med Sci 2019; 26(12): 1063-74. (Persian)
27- Khani M, Motamedi P, Dehkhoda Mr, Nikukheslat Sd, Karimi P. Effect of Thyme Extract Supplementation on Lipid Peroxidation, Antioxidant Capacity, Pgc-1α Content and Endurance Exercise Performance in Rats. J the International Society of Sports Nutrition 2017; 14(1): 1-8.
28- Miki T, Yuda S, Kouzu H, Miura T. Diabetic Cardiomyopathy: Pathophysiology and Clinical Features. Heart Fail Rev 2013; 18(2): 149-66.
29- Ward Ml, Crossman DJ. Mechanisms Underlying the Impaired Contractility of Diabetic Cardiomyopathy. World J Cardiol 2014; 6(7): 577-84.
30- Tarquini R, Lazzeri C, Pala L, Rotella Cm, Gensini Gf. The Diabetic Cardiomyopathy. Acta Diabetol 2011; 48(3): 173-81.
31- Hassanpour G, Azarbayjani Ma, Shakeri N, Abednazari H. The Effect of Interval and Continued Trainings with Crocin on Apoptotic Markers in the Heart Tissue of High-Fat Diet and Streptozotocin Induced Type 2 Diabetic Rats. Rep Health Care 2017; 3(3): 58-70. (Persian)
32- Marzetti E, Lawler Jm, Hiona A, Manini T, Seo Ay, Leeuwenburgh C. Modulation of Age-Induced Apoptotic Signaling and Cellular Remodeling by Exercise and Calorie Restriction in Skeletal Muscle. Free Radic Biol Med 2008; 44(2): 160-8.
33- Sharafi H, Rahimi R. The Effect of Resistance Exercise on P53, Caspase-9, and Caspase-3 in Trained and Untrained Men. J Strength Cond Re 2012; 26(4): 1142-8.
34- Wackerhage H. Molecular Exercise Physiology: An Introduction. First Published. New York. Routledge; 2014. 133-156.
35- Moradpour P, Daryanoosh F, Dashtiyan Aa, Taghi Mm, Jamhiri I. Impact of 6 Weeks of Intensive Intermittent Training with Taking Vitamin E on P53 Changes in Blood Serum Levels and Visceral Adipose Tissue in Sprague–Dawley Rats. Sport Sci 2017; 10: 98-103. (Persian)
36- Tabatabaipana A, Akbarzadeh R, Kodahi Z, Ghaderyan M. Increasing Oxidative Stress and Expression of P53, Bax and Bcl2 Genes in Patients with Myocardial Infarction. Daneshvar Med J 2016; 23(120): 1-10. (Persian)
37- Shirpour Sb, Azarbayjani Ma, Peeri M, Farzanegi P. Effect of High Intensity Interval Training with Curcumin on Gene Expression of Bax, Bcl-2, and Caspase-3 in Aged Female Rat Hepatocytes. Rep Health Care 2017; 3(3): 8-14. (Persian)
38- Sadighi A, Abdi A, Azarbayjani M A, Barari A. Effect of Aerobic Exercise on Some Factors of Cardiac Apoptosis in Male Rats. Feyz J Kashan Uni Med Sci 2019; 23(5): 495-502. (Persian)
39- Kazemi A, Mirzazadeh E. The Effect of Endurance Training on Tumor Tissue Levels of Caspase-3 and Caspase-9 in Mice with Breast Cancer. IJBD 2018; 11(3): 32-43. (Persian)
40- Li F, Shi W, Zhao Ey, Geng X, Li X, Peng C, et al. Enhanced Apoptosis from Early Physical Exercise Rehabilitation Following Ischemic Stroke. J Neurosci Res 2017; 95(4): 1017-24.
41- Akbari M, Moradi L, Abbassi Daloii A. The Effect of Endurance Training and Ziziphus Jujube Extract Consumption on Apoptosis of Cardiac Tissue in Male Wistar Rats. Feyz J Kashan Uni Med Sci 2018; 22(6): 547-54. (Persian)
42- Shokri S, Aitken Rj, Abdolvahhabi M, Abolhasani F, Ghasemi Fm, Kashani I, et al. Exercise and Supraphysiological Dose of Nandrolone Deconoate Increase Apoptosis in Spermatogenic Cells. Basic Clin Pharmacol Toxicol 2010; 106(4): 324-30.
43- Seo H, Park Ch, Choi S, Kim W, Jeon Bd, Ryu S. Effects of Voluntary Exercise on Apoptosis and Cortisol after Chronic Restraint Stress in Mice. J Exerc Nutrition Biochem 2016; 20(3): 16-23.
44- Kim Kb, Kim Ya, Park Jj. Effects of 8-Week Exercise on Bcl-2, Bax, Caspase-8, Caspase-3 and Hsp70 in Mouse Gastrocnemius Muscle. J Life Sci 2010; 20(9): 1409-14.
45- Koçtürk S, Kayatekin Bm, Resmi H, Açıkgöz O, Kaynak C, Özer E. The Apoptotic Response to Strenuous Exercise of the Gastrocnemius and Solues Muscle Fibers in Rats. Eur J Appl Physiol 2008 Mar 1; 102(5): 515-24.
46- Mcmillan Em, Graham Da, Rush Jw, Quadrilatero J. Decreased Dna Fragmentation and Apoptotic Signaling in Soleus Muscle of Hypertensive Rats Following 6 Weeks of Treadmill Training. J Appl Physiol 2012; 113(7): 1048-57.
47- Alway Se, Siu Pm. Nuclear Apoptosis Contributes To Sarcopenia. Exerc Spor Sci Rev 2008; 36(2): 51-7.
48- Speidel D. Transcription-Independent P53 Apoptosis: An Alternative Route to Death. Trends Cell Biol 2010; 20(1): 14-24.
49- Brentnall M, Rodriguez-Menocal L, Guevara Rl, Cepero E, Boise Lh. Caspase-9, Caspase-3 and Caspase-7 Have Distinct Roles during Intrinsic Apoptosis. BMC Cell Biol 2013; 14: 32.
50- Parrish AB, Freel CD, Kornbluth S. Cellular Mechanisms Controlling Caspase Activation and Function. Cold Spring Harb Perspect Biol 2013; 5(6): A008672.
51- Würstle Ml, Laussmann Ma, Rehm M. The Central Role of Initiator Caspase-9 in Apoptosis Signal Transduction and the Regulation of Its Activation and Activity on the Apoptosome. Exp Cell Res 2012; 318(11): 1213-20.
52- Tian Xf, Cui Mx, Yang Sw, Zhou Yj, Hu Dy. Cell Death, Dysglycemia and Myocardial Infarction (Review). Biomed Rep 2013; 1(3): 341-6.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1398/5/7 | پذیرش: 1400/11/15 | انتشار: 1400/11/15
دریافت: 1398/5/7 | پذیرش: 1400/11/15 | انتشار: 1400/11/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







