دوره 28، شماره 4 - ( تیر 1399 )
جلد 28 شماره 4 صفحات 2546-2533 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hajipour N, Mortazavian A M, Homayouni rad A. Challenges of Probiotics Microencapsulation by Spray Drying Method. JSSU 2020; 28 (4) :2533-2546
URL: http://jssu.ssu.ac.ir/article-1-4847-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4847-fa.html
حاجی پور ندا، مرتضویان امیرمحمد، همایونی راد عزیز. چالشهای ریزپوشانی پروبیوتیکها به روش خشککن افشانی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (4) :2533-2546
متن کامل [PDF 891 kb]
(1077 دریافت)
| چکیده (HTML) (9414 مشاهده)
References:
1-Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et al. Expert Consensus Document: the International Scientific Association for Probiotics and Prebiotics Consensus Statement on the Scope And Appropriate Use of the Term Probiotic. Nat Rev Gastroenterol Hepatol 2014;11(8): 506-14.
2-Homayouni A, Azizi A, Ehsani M, Yarmand M, Razavi S. Effect of Microencapsulation and Resistant Starch on the Probiotic Survival and Sensory Properties of Synbiotic Ice Cream. Food Chem 2008;111: 50-55.
3-Hajipour N, Homayouni-Rad A. Response to the Paper the Effect of Prebiotics on the Viability of Encapsulated Probiotic Bacteria. LWT- Food Science and Technology 2018; 90: 606.
4-Corona Hernandez RI, Álvarez Parrilla E, Lizardi Mendoza J, Islas Rubio AR, Rosa L, Wall Medrano A, et al. Structural Stability and Viability of Microencapsulated Probiotic Bacteria: A Review. Comprehensive Rev in Food Sci Food Safety 2013; 12(6): 614-628.
5-Schuck P, Jeantet R, Bhandari B, Chen XD, Perrone ÍT, de Carvalho AF, et al. Recent Advances in Spray Drying Relevant to the Dairy Industry: A Comprehensive Critical Review. Drying Technology 2016; 34(15): 1773-90.
6-Peighambardoust S, Tafti AG, Hesari J. Application of Spray Drying for Preservation of Lactic Acid Starter Cultures: A review. Trends in Food Science & Technology 2011; 22(5): 215-24.
7-Broeckx G, Vandenheuvel D, Claes IJ, Lebeer S, Kiekens F. Drying Techniques of Probiotic Bacteria as an Important Step Towards the Development of Novel Pharmabiotics. International J Pharmaceutics 2016; 505: 303-18.
8-Santivarangkna C, Kulozik U, Foerst P. Inactivation Mechanisms of Lactic Acid Starter Cultures Preserved by Drying Processes. J Appl Microbiol 2008; 105(1): 1-13.
9-Falentin H, Deutsch S-M, Jan G, Loux V, Thierry A, Parayre S, et al. The Complete Genome of Propionibacterium Freudenreichii CIRM-BIA1T, A Hardy Actinobacterium with Food and Probiotic Applications. PloS One 2010; 5(7): e11748.
10-Sazawal S, Dhingra U, Sarkar A, Dhingra P, Deb S, Marwah D, et al. Efficacy of Milk Fortified with a Probiotic Bifidobacterium Lactis (DR-10) and Prebiotic Galacto-Oligosaccharides in Prevention of Morbidity and on Nutritional Status. Asia Pacific J Clin Nutr 2004;13: PS28-S28.
11-Kearney N, Meng X, Stanton C, Kelly J, Fitzgerald G, Ross R. Development of a Spray Dried Probiotic Yoghurt Containing Lactobacillus Paracasei NFBC 338. International Dairy J 2009; 19(11): 684-9.
12-Mille Y, Beney L, Gervais P. Compared Tolerance to Osmotic Stress Invarious Microorganisms: Towards a Survival Prediction Test. Biotechnol bioeng 2005; 92(4): 479-84.
13-Lebeer S, Vanderleyden J, De Keersmaecker SC. Genes And Molecules Of Lactobacilli Supporting Probiotic Action. Microbiol Mol Biol Rev 2008; 72(4): 728-64.
14-Zhang Y, Lin J, Zhong Q. Effects of Media, Heat Adaptation, and Outlet Temperature on the Survival of Lactobacillus Salivarius NRRL B-30514 after Spray Drying And Subsequent Storage. LWT 2016; 74: 441-7.
15-Desmond C, Ross R, O'callaghan E, Fitzgerald G, Stanton C. Improved Survival of Lactobacillus Paracasei NFBC 338 in Spray Dried Powders Containing Gum Acacia. J Appl Microbiol 2002; 93(6): 1003-11.
16-Huang S, Cauty C, Dolivet A, Le Loir Y, Chen XD, Schuck P, et al. Double Use of Highly Concentrated Sweet Whey to Improve the Biomass Production and Viability of Spray-Dried Probiotic Bacteria. J Functional Foods 2016; 23: 453-63.
17-Prasad J, McJarrow P, Gopal P. Heat and Osmotic Stress Responses of Probiotic Lactobacillus Rhamnosus HN001 (DR20) in Relation to Viability after Drying. Appl Environ Microbiol 2003; 69(2): 917-25.
18-Morgan CA, Herman N, White P, Vesey G. Preservation of Micro-Organisms by Drying; A Review. J Microbiol Method 2006; 66(2): 183-93.
19-Linders L, Meerdink G, Van ‘t Riet K. Effect of Growth Parameters on the Residual Activity of Lactobacillus Plantarum after Drying. J Appl Microbiol 1997; 82(6): 683-8.
20-Lavari L, Páez R, Cuatrin A, Reinheimer J, Vinderola G. Use of Cheese whey for Biomass Production and Spray Drying of Probiotic Lactobacilli. J Dairy Res 2014; 81(3): 267-74.
21-Carvalho AS, Silva J, Ho P, Teixeira P, Malcata FX, Gibbs P. Effects of Various Sugars Added to Growth and Drying Media upon Thermotolerance and Survival Throughout Storage of Freeze Dried Lactobacillus Delbrueckii Ssp. Bulgaricus. Biotechnol Prog 2004; 20(1): 248-54.
22-Silva J, Carvalho A, Ferreira R, Vitorino R, Amado F, Domingues P, et al. Effect of the Ph of Growth on the Survival of Lactobacillus Delbrueckii Subsp. Bulgaricus to Stress Conditions During Spray Drying. J Appl Microbiol 2005; 98(3): 775-82.
23-Baker-Austin C, Dopson M. Life in Acid: Ph Homeostasis in Acidophiles. Trends Microbiol 2007;15(4): 165-71.
24-Silva J, Carvalho A, Teixeira P, Gibbs P. Bacteriocin Production by Spray Dried Lactic Acid Bacteria. Letters in Appl Microbiol 2002; 34: 77-81.
25-Corcoran B, Ross R, Fitzgerald G, Stanton C. Comparative Survival of Probiotic Lactobacilli Spray Dried in the Presence of Prebiotic Substances. J Appl Microbiol 2004; 96(5): 1024-39.
26-Hussain I, Ahsan M, Saleem M, Ahmad A. Gene Action Studies for Agronomic Traits in Maize under Normal and Water Stress Conditions. Pak J Agri Sci 2009; 46(2): 107-12.
27-Santivarangkna C, Kulozik U, Foerst P. Alternative Drying Processes for the Industrial Preservation of Lactic Acid Starter Cultures. Biotechnol Prog 2007; 23(2): 302-15.
28-Schuck P, le Floch-Fouere C, Jeantet R. Changes in Functional Properties of Milk Protein Powders: Effects of Vacuum Concentration and Drying. Drying Technol 2013; 31(13-14): 1578-91.
29-Fu N, Woo MW, Selomulya C, Chen XD. Inactivation of Lactococcus Lactis Ssp. Cremoris Cells in a Droplet During Convective Drying. Biochem Engineer J 2013; 79: 46-56.
30-Anandharamakrishnan C, Ishawarya P. Spray Drying Techniques for Food Ingredient Encapsulation: UK. John Wiley & Sons; 2015; 72: 107-15.
31-Cal K, Sollohub K. Spray Drying Technique. I: Hardware and Process Parameters. J Pharmaceutical Sci 2010; 99(2): 575-86.
32-Patel R, Patel M, Suthar A. Spray Drying Technology: An Overview. Indian J Sci Technol 2009; 2(10): 44-7.
33-Gharsallaoui A, Roudaut G, Chambin O, Voilley A, Saurel R. Applications of Spray-Drying in Microencapsulation of food Ingredients: An overview. Food Res Inter 2007; 40(9): 1107-21.
34-Rosolen MD, Bordini FW, de Oliveira PD, Conceição FR, Pohndorf RS, Fiorentini ÂM, et al. Symbiotic Microencapsulation of Lactococcus Lactis Subsp. Lactis R7 Using whey and Inulin by Spray Drying. LWT 2019; 115: 108411.
35-Rajam R, Karthik P, Parthasarathi S, Joseph G, Anandharamakrishnan C. Effect of Whey Protein–Alginate Wall Systems on Survival of Microencapsulated Lactobacillus Plantarum in Simulated Gastrointestinal Conditions. J Functional Foods 2012; 4(4): 891-8.
36-Pérez-Chabela ML, Lara-Labastida R, Rodriguez-Huezo E, Totosaus A. Effect of Spray Drying Encapsulation of Thermotolerant Lactic Acid Bacteria on Meat Batters Properties. Food Bioprocess Technol 2013; 6: 1505-15.
37-Arslan S, Erbas M, Tontul I, Topuz A. Microencapsulation of Probiotic Saccharomyces Cerevisiae Var. Boulardii with Different Wall Materials by Spray Drying. LWT- Food Sci Technol 2015; 63(1): 685-90.
38-Bustamante M, Villarroel M, Rubilar M, Shene C. Lactobacillus Acidophilus La-05 Encapsulated by Spray Drying: Effect of Mucilage and Protein from Flaxseed (Linum Usitatissimum L.). LWT-Food Sci Technol 2015; 62(2): 1162-8.
39-Golowczyc MA, Silva J, Abraham AG, De Antoni GL, Teixeira P. Preservation of Probiotic Strains Isolated from Kefir by Spray Drying. Letters Appl Microbiol 2010; 50(1): 7-12.
40-Braber NV, Vergara LD, Rossi Y, Aminahuel C, Mauri A, Cavaglieri L, et al. Effect of Microencapsulation in Whey Protein and Water-Soluble Chitosan Derivative on the Viability of the Probiotic Kluyveromyces Marxianus VM004 During Storage and in Simulated Gastrointestinal Conditions. LWT 2020; 118: 108844.
41-Tao T, Ding Z, Hou D, Prakash S, Zhao Y, Fan Z, et al. Influence of Polysaccharide as Co-Encapsulant on Powder Characteristics, Survival and Viability of Microencapsulated Lactobacillus Paracasei Lpc-37 by Spray Drying. J Food Engineering 2019; 252: 10-7.
42-Gbassi GK, Vandamme T. Probiotic Encapsulation Technology: From Microencapsulation to Release Into the Gut. Pharmaceutics 2012; 411: 49-63.
43-Rathore S, Desai PM, Liew CV, Chan LW, Heng PWS. Microencapsulation of Microbial Cells. J Food Engineer 2013; 116: 369-81.
44-Fu N, Chen XD. Towards A Maximal Cell Survival in Convective Thermal Drying Processes. Food Res Int 2011; 44(5): 1127-49.
45-Pérez-Gago MB, Krochta JM. Lipid Particle Size Effect on Water Vapor Permeability and Mechanical Properties of whey Protein/Beeswax Emulsion Films. J Agric Food Chem 2001; 49(2): 996-1002.
46-Matsuno R, Adachi S. Lipid Encapsulation Technology-Techniques and Applications to Food. Trends in Food Sci Technol 1993; 4(8): 256-61.
47-De Castro-Cislaghi FP, Carina Dos Reis ES, Fritzen-Freire CB, Lorenz JG, Sant’Anna ES. Bifidobacterium Bb-12 Microencapsulated by Spray Drying with Whey: Survival Under Simulated Gastrointestinal Conditions, Tolerance to Nacl, and Viability During Storage. J Food Engineer 2012; 13(2): 186-193.
48-Homayouni Rad A. Therapeutical Effects of Functional Probiotic, Prebiotic and Synbiotic Foods. Tabriz: Tabriz University of Medical Sci; 2008: 146.
49-Rajam R, Anandharamakrishnan C. Microencapsulation of Lactobacillus Plantarum (MTCC 5422) with Fructooligosaccharide as Wall Material by Spray Drying. LWT-Food Sci Technol 2015; 60(2): 773-80.
50-Bustamante M, Oomah BD, Rubilar M, Shene C. Effective Lactobacillus Plantarum and Bifidobacterium Infantis Encapsulation with Chia Seed (Salvia Hispanica L.) and Flaxseed (Linum Usitatissimum L.) Mucilage and Soluble Protein by Spray Drying. Food Chem 2017; 216: 97-105.
51-Vinderola G, Binetti A, Burns P, Reinheimer J. Cell Viability And Functionality of Probiotic Bacteria in Dairy Products. Frontiers in Microbiol 2011; 2: 70.
52-Association of Official Analytical Chemists, Association of Official Agricultural Chemists (US). Official methods of analysis of the Association of Official Analytical Chemists. Association of Official Analytical Chemists; 1920.
53-Lakkis JM. Encapsulation and Controlled Release Technologies in Food Systems. UK, John Wiley & Sons; 2008; 87.
54-Pérez-Masiá R, López-Nicolás R, Periago MJ, Ros G, Lagaron JM, López-Rubio A. Encapsulation of Folic Acid in Food Hydrocolloids Through Nanospray Drying and Electrospraying for Nutraceutical Applications. Food Chem 2015; 168: 124-33
متن کامل: (2958 مشاهده)
مقدمه
در سالهای اخیر، بررسی تعداد باکتریهایی که توان و ویژگیهای باکتریهای پروبیوتیک را دارند؛ افزایش یافته است. باکتریهای پروبیوتیک باکتریهایی هستند که اگر در حالت زنده و بهتعداد کافی مصرف شوند؛ میتوانند خواص سلامتبخشی را ایجاد کنند. تاثیرات سودمند باکتریهای پروبیوتیک بستگی به نوع سویه، میزان دوز مصرفی و زندهمانی باکتری مصرف شدهدارد (3-1). فدراسیون بینالمللی لبنیات (IDF) وجود حداقل میزان 107 باکتری پروبیوتیک زنده در هر گرم یا میلیلیتر از محصول غذایی را در هنگام مصرف پیشنهاد نمودهاست. بنابراین زندهمانی تعداد کافی از باکتری و تضمین حفظ خواص آنها طی دوره نگهداری محصول از پیشنیازهای مصرف آنهاست (4). خشک کردن یک از فرایندهایی است که بهطور گسترده برای نگهداری غذا و افزایش مدت زمان نگهداری محصول و پایداری آن، کاهش هزینههای حمل و نقل و سهولت تجارت انجام میگردد. در میان روشهای مختلف خشککردن، خشککردن افشانی یکی از روشهای پرکاربرد در صنعت لبنیات میباشد (5). سایز ذرات تغذیه شونده به دستگاه با این روش بین 10 تا 150 میکرون بوده که با جریانی از هوای داغ و خشک با دمای 150-250 درجه سانتیگراد روبرو میگردند. افزایش فضای تماس هوا-مایع پس از اسپری نمودن ماده ورودی، سبب افزایش چشمگیر در کینتیکهای خشک شدن میگردد که سبب وقوع خشک شدن در چندین ثانیه میگردد. خشککن افشانی در مقایسه با خشککن انجمادی، هزینه انرژی کمتری دربر داشته و بهرهوری بالاتری را نیز دارد. با این وجود هنوز چالش استفاده از روش خشککن افشانی برای سویههای حساس پروبیوتیک وجود دارد (7, 6).
1-مرحله پیش از خشک کردن
عوامل بسیاری در میزان مقاومت و زندهمانی باکتری پروبیوتیک در برابر شرایط خشک کردن با خشککن افشانی موثر هستند. در این بخش ابتدا به عوامل موثر قبل از ورود به خشککن افشانی که مربوط به کشت باکتریایی میباشد؛ میپردازیم.
1-1 انتخاب سویه باکتریایی
در اغلب تحقیقات، خشک کردن باکتریهای پروبیوتیک لاکتوکوکوس، لاکتوباسیلوس و سویههای مختلف بیفیدوباکتریوم مورد بررسی قرار گرفتهاند. اغلب باکتریهای پروبیوتیک با استفاده از روش خشککن افشانی بهدلیل متحمل شدن شرایط سختی که طی این فرایند بر باکتری غالب میگردد، زندهمانی خوبی را نخواهند داشت. ویژگی مقاومت در این باکتریها باید معیار و ملاک انتخاب آنها برای خشککردن باشد تا زندهمانی آنها در پودر بهدست آمده با این روش بیشتر باشد. حرارت، اسمز، اکسیداسیون و استرس خشک کردن بهعنوان مکانیسمهای مهم که سبب غیرفعال شدن باکتری طی دوره خشک کردن افشانی و پس از آن میگردد، در نظر گرفته شدهاند (8). در تحقیقات مختلف، گزارش شده است که سویه یا گونههای مختلف باکتریایی، ممکن است تحمل متفاوتی برای این شرایط از خود نشان دهند. مقایسه بین باکتریهای پروبیوتیک لاکتوباسیلوس، لاکتوکوکوس و بیفیدوباکتریومها نشان داد که پروپیونی باکتریومها به دلیل توانایی بالاتر آنها در تطابق با محیط تحمل و مقاومت بالاتری را نشان دادند (9). دلیل این امر میتواند ناشی از متابولیسم آنها یا پاسخهای چندگانه تحملی آنها باشد. با این وجود مطالعات مربوط به خشک کردن پروپیونی باکتریومها اندک میباشد. استرپتوکوکوسها نیز در مقایسه با لاکتوباسیلوسها تحمل و مقاومت بالاتری حین خشک کردن با خشککن افشانی از خود نشان دادند. حد آستانه دمایی که سبب آسیب بهسلولهای میکروبی میگردد اغلب حد بالای دمای رشد گونههای باکتریایی میباشد. دلیل مقاومت حرارتی بالاتر باکتریهای استرپتوکوکوس ترموفیلوس نسبت به لاکتوباسیلوسها نیز میتواند ناشی از همین علت باشد اگرچه در گزارش کارنی و همکاران (2009) سویه لاکتوباسیلوس کازئی NFBC 338پس از خشک شدن با روش خشککن افشانی، زندهمانی مشابه با استرپتوکوکوس ترموفیلوس از خود نشان داد (11, 10). مایل و همکاران (2005) به این نتیجه دست یافتند که تحمل فشار اسمزی لاکتوباسیلوس پلانتاروم عموماً از اشرشیاکلای، لاکتوباسیلوس بولگاریکوس و در برخی موارد از مخمرها نیز بیشتر میباشد. در سایر گونههای لاکتوباسیلوس همانند کازئی، پاراکازئی، اسیدوفیلوس و سالیواریوس میزان تحمل و مقاومت به استرسها وابسته به سویه میباشد. در بررسی 17 سویه از بیفیدوباکتریومها مشخص گردید که سویههای مقاوم به حرارت و اکسیژن، زندهمانی بهتری پس از خشک شدن با روش خشککن افشانی داشتند. مورد مشابه با این موضوع، در ارتباط با لاکتوکوکوس لاکتیس و لاکتوباسیلوس رامنوسوس گزارش شدهاست (12). اگرچه عموماً گونههای باکتریایی، نمایانگر مقاومت ظاهری باکتریهای مختلف میباشند اما بهنظر میرسد که توان باکتریهای پروبیوتیک طی خشککردن با خشککن افشانی وابسته به نژاد آنها باشد. برخی تغییرپذیریها اغلب مربوط به محیط زیست اولیه و منبع جداسازی باکتری، حضور وجود ژنهای خاص، واکنش با ماتریکس خارج سلولی و یا توانایی برای انباشته نمودن پلیفسفات داخل سلولی و تولید اگزوپلیساکارید میباشد (13).
2-1 پاسخ به استرسهای سلولی
شرایط رشد سلول بهعنوان فاکتور مهمی برای تحمل باکتریایی بر شرایط استرس باکتریایی در نظر گرفته شده است. در واقع باکتریهای پروبیوتیک همانند سایر باکتریها، توانایی مقابله و منطبق شدن با محیطهای نامساعد و محیطهای دارای استرس همانند استرس اسمزی و یا دمای بالا را دارند. این کار از طریق فعالسازی سیستم پاسخ استرسی سلولی انجام میگردد که میتواند تحمل باکتریهای پروبیوتیک طی دوره خشککردن با خشککن افشانی را مشخص کند. این سیستم عموماً از طریق مواجهه با دوزهای پایینتر از حد کشندگی استرسها تحریک میگردد (14). اگرچه بهبود در زندهمانی پروبیوتیکها با روش خشککن افشانی همانند منطبق شدن با گرما و یا نمک موثر نیست، اما مواجهه باکتری با هیدروژن پراکسید 0/003 مولار برای 30 دقیقه و یا نمکهای صفراوی 0/1 وزنی/ حجمی برای 30 دقیقه میتواند زندهمانی باکتری طی خشک کردن با خشککن افشانی را بهبود بخشد. در برخی موارد نیز پیشتیمار باکتری با فشار بالا سبب افزایش مقاومت بهگرما شده است. شرایط قحطی و کمبود به ویژه کمبود گلوکز نیز میتواند تحمل باکتری به استرسهای اسمزی و حرارتی را تحریک نماید. در برخی تحقیقات، گزارش شده است که تغییرات و بهبود ژنتیکی به کمک مهندسی ژنتیک توانسته است 5 تا 50 برابر سبب افزایش مقاومت باکتری در برابر شرایط استرسزای حرارتی گردد و در برخی موارد نیز بدون تاثیر بوده است (16, 15). پراساد و همکاران (2003) دریافتند که پیشتیمار در شرایط شوک حرارتی با دمای 50 درجه سانتیگراد و سدیمکلرید با غلظت 0/6 مولار، سبب افزایش معنادار زندهمانی در سویه لاکتوباسیلوس رامنوسوس HN001 در مقایسه با نمونه کنترل شد. بررسیها توسط الکتروفورز ژل نشان داد که میزان یازده نوع پروتئین از جمله پروتئینهای شوک حرارتی GroEL و ِDnaK افزایش یافتند.
میزان آنزیمهای لاکتات دهیدروژناز، انولاز، فسفوگلیسرات کیناز، تریوز فسفات ایزومراز نیز در نمونه پیشتیمار شده بیش از نمونه کنترل گزارش شد. همچنین در آنالیز کربوهیدرات محتوای سیتوپلاسمی نشانگر وجود ساکاریدهای بهبود یافته با گلیسرول در نمونه پیشتیمار شده بود (17). بهطور کلی در اغلب موارد تحمل شرایط خشککن افشانی تحت تاثیر این که کشت باکتریایی چگونه انجام و تولید شدهاست، قرار میگیرد. بهعلاوه برخی باکتریها نیازی به ساخت پروتئین به منظور بهبود و ترمیم پس از آسیب ناشی از خشک کردن ندارند و برخی نیز توانایی لازم برای سنتز این پروتئینها را نداشته که در این مورد تولید زیاد پروتئینهای پاسخ استرسی پیش از خشککردن، میتواند تاثیر مفیدی بر محافظت باکتری از آسیب خشک شدن داشته باشند. در این بخش پروتئینها و بهویژه پروتئینهای محافظتی همراه، وظیفه ممانعت یا ترمیم پلیپپتیدهای با پیچخوردگیهای اشتباه ( mis-folding) را برعهده دارند (18).
3-1 شرایط رشد و آمادهسازی ماده تزریق شونده
1-3-1محیطکشت
در تعداد اندکی از مطالعات ذکر شدهاست که محیط کشت میتواند چه تاثیراتی بر زندهمانی پرویوتیکها پس از خشکشدن بگذارد. در اغلب تستهای آزمایشگاهی، از محیط کشت MRS broth استفاده میگردد که محیط کشت نسبتاً گران قیمت برای مصارف صنعتی و از درجه غیرغذایی میباشد. رشد لاکتوباسیلوس پلانتاروم در محیط کشت MRS broth رقیق سبب دریافت کمتر بتائن و کارنتین توسط باکتری شده که خود باعث افزایش زندهمانی باکتری پس از خشک شدن میگردد (19). در برخی تحقیقات از ترکیبات لبنی همانند آب پنیر و یا شیر بدون چربی، برای کشت باکتری استفاده شده است که ارزانتر بوده، خوراکی بوده و به آسانی برای تولید سلول باکتری پروبیوتیک قابل استفاده میباشد. همچنین این ترکیبات میتواند فرایندهای پس از تولید همانند خشک شدن را بهبود بخشند. زمانی که باکتری با کاهش فعالیت آبی مواجه میشود سعی میکند تا با فشار اسمزی آن را جبران کند و بنابراین با تجمع حل شوندههای سازگار همانند آمینواسیدها و آمینهای چهارم و یا کربوهیدراتها، سعی دارد تا زندهمانی خود را حفظ تماید. این روش نیز میتواند راه حلی برای افزایش زندهمانی پروبیوتیکها طی شرایط خشک کردن باشد. البته لازم بهذکر است با توجه به مطالعات انجام شده بر روی نژادهای متفاوت، این روش الزاما سبب افزایش تحمل گرمایی طی خشککردن نمیگردد. ساخت این ترکیبات حل شونده در لاکتیک اسید باکتریها، وابسته به وجود پیشساز آنها در محیطکشت است. با توجه به کوتاه بودن مدت زمان روش خشککن افشانی بهتر است که ترکیبات حلشونده سازگار و پیشسازها به محیط کشت باکتری افزوده شوند (20, 16). کاروالو و همکاران (2004) دریافتند که لاکتوباسیلوس بولگاریکوس رشد یافته در محیطکشت غنیشده با لاکتوز، توان تحمل حرارتی بیشتری را دارند (21) .
2-3-1 pH رشد
pH محیط رشد باکتری میتواند بر زندهمانی و مقاومت آن طی خشک شدن تاثیرگذار باشد. سلولها ممکن است بر اثر ماندن در pH پایین بهمدت طولانی، توانایی حفظ pH بین سلولی نزدیک بهخنثی را نداشته باشند که سبب کاهش زندهمانی و فعالیت باکتری پروبیوتیک در این شرایط میگردد. توانایی باقی ماندن در هموستاز pHبین سلولی در بین نژادهای مختلف متفاوت است. این امر میتواند وابسته بهتوانایی نژاد باکتری برای تطابق با اسید باشد که محافظت تقاطعی در طی خشک کردن را تحریک میکند. چون استرس اسیدی سلولها را تحت تاثیر قرار میدهد، pHنهایی کشت، زمان برداشت و یا نگهداری ماده ورودی به خشککن پیش از خشک کردن باید در نظر گرفته شود (23, 22). در گزارش سیلوا و همکاران (2002) تاثیر pH بر زندهمانی سلولهای لاکتوباسیلوس بولگاریکوس پس از خشک شدن با خشککن افشانی مشخص گردید. آنها دریافتند که سلولهای رشد یافته در pH کنترل نشده در مقایسه با سلولهای رشد یافته در pH کنترل شده 6/5، زندهمانی بهتری از خود نشان دادند (24).
3-3-1 فاز رشد
باکتریهای پروبیوتیک اغلب در انتهای فاز رشد لگاریتمی و یا ابتدای فاز سکون برداشت میگردند تا بالاترین بازده بدست آید. البته اغلب فاز سکون برای این کار انتخاب میگردد زیرا سلولها طی این دوره مقاومت بیشتری در برابر خشک شدن از خود نشان میدهند. در واقع مقاوت به استرسهای مختلف طی فاز سکون افزایش مییابد. دلیل این امر ایجاد شرایط دشوار و چالشبرانگیز بوده که سبب رهاسازی پاسخهای سریع میشود. این امر نیازمند پروتئینهای استرس کلی و فاکتورهای جایگزین سیگما میگردد که منجر به تحملهای چندگانه استرسی میشود (26،25،6). کورکوران و همکاران (2004) با برداشت سلولهای لاکتوباسیلوس رامنوسوس در فاز تاخیر، ابتدای فاز رشد و ابتدای فاز سکون و خشک نمودن سلولها در خشککن افشانی، زندهمانی بعداز خشک کردن برای سلولهای برداشت شده در ابتدای فاز سکون و رشد را به ترتیب بیش از 50 درصد و 14 درصد گزارش نمودند.
4-3-1 تکنیک برداشت سلول
سانتریفیوژ یکی از روشهای متداول و پرکاربرد برداشت سلول میباشد که بهعنوان روش با کارایی بالا لحاظ شده است. اغلب دمای برداشت سلول در سانتریفیوژ 4 درجه سانتیگراد میباشد. در برخی موارد این دما بر خشک شدن سلول تاثیرگذار گزارش شدهاست. روشهایی مانند فیلتراسیون غشایی نیز مورد بررسی قرار گرفتهاند که البته این روش برای خشک کردن باکتری با روش خشککن افشانی مورد استفاده قرار نگرفتهاست (27). جداسازی باکتری از محیطکشت می تواند سبب از دست رفتن مواد و انرژی قابلملاحظهای گردد. بنابراین اغلب در مقیاس بزرگ ترجیح بر حفظ محیط کشت و خشک کردن مستقیم باکتری با محیط کشت میباشد. بهعلاوه برخی اسیدهای چرب و ویتامینها و باکتریوسینها که در محیط کشت ایجاد و حفظ شدهاند، میتوانند پودر باکتری تولید شده را غنی و باارزشتر بسازند. با این روش، محیط کشت هم به عنوان محیط رشد باکتری و هم بهعنوان محیط خشک کردن افشانی باکتری مورد استفاده قرار میگیرد. با توجه به نوع مصرف باکتریها (در صورتیکه برای موادغذایی استفاده شوند)، ترکیبات محیط کشت باید از درجه غذایی باشند. مشکل اصلی این روش این است که محیط همتوان (isotonic) رشد باکتری اغلب باید محتوای جامد کم و در حدود 5-10 درصد داشته باشد. در حالی که اغلب برای بهرهوری بالا و حفظ انرژی لازم است که محتوای جامد محیط، بالاتر از این مقدار باشد. این حالت با افزایش پودر بیشتر به محیط کشت یا کاربرد روشهای تغلیظی بهدست میآید. لازم به ذکر است که مراحل بینابینی (همانند افزودن پودر به محیطکشت در مراحل ثانویه) احتمال کاهش زندهمانی و ریسک آلودگی را افزایش میدهد (28, 16). 2- مرحله خشک شدن با خشککن افشانی
آسیب به سلول باکتری طی مرحله خشککن افشانی تنها بهدلیل تاثیر دمای بالا و تغییر دمایی نبوده، بلکه مربوط به از دست رفتن آب پیوسته در سطح سلول نیز میباشد. یکی از نقاط حساس به آسیب سلول، غشای سیتوپلاسمی میباشد که طی فرایند خشککن افشانی، این آسیب اغلب رخ میدهد. در واقع حذف آب منجر به تغییر وضعیت فسفولیپیدهای دولایه از حالت لایهای به فاز ژلی و یا هگزاگونال میگردد. این تغییرات در زنجیره فسفولیپیدها باعث بهدست آمدن ساختار کاملاً گسترده و سخت میگردد. تاثیر دیگر میتواند بر نوکلئیکاسید و ریبوزومها بهدلیل استرس ناشی از آبزدایی اعمال گردد که به دلیل از دست رفتن+Mg 2 به دلیل آسیب گرمایی در غشای سلولی رخ دهد (29).
3- روش خشککن افشانی
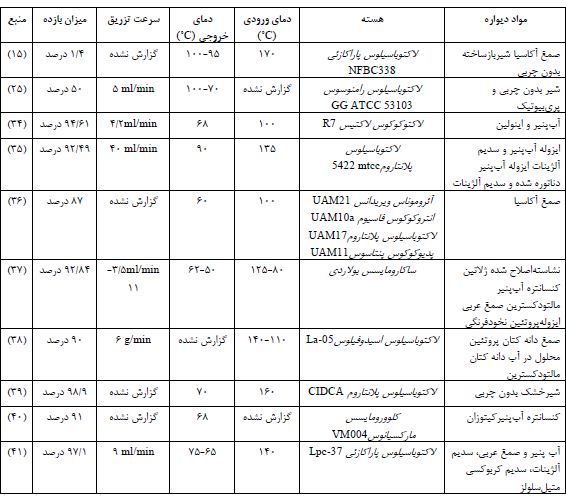
در بین روشهای بسیاری که برای ریزپوشانی انجام میگردد، روش خشککن افشانی روشی معروف بوده که در صنعت غذا موفقیتهای بسیاری را کسب نموده است. مراحل خشککن افشانی شامل 4 مرحله اسپری نمودن، تماس با هوای داغ، تبخیر رطوبت و جداسازی ذرات نهایی میباشد (30). پارامترهای مهم در مرحله اسپری نمودن شامل فشار اسپری نمودن، ویسکوزیته ماده ورودی یا تغذیه شونده (feed) بهدستگاه، سرعت جریان ماده ورودی و کشش سطحی ماده ورودی به دستگاه میباشد که بر کیفیت محصول نهایی تاثیرگذار میباشد. افزایش فشار اسپری نمودن (atomization)، مستقل از نوع مواد ورودی و نوع نازل، سبب کاهش اندازه ذرات میگردد. در اسپری نمودن نمونه با فشار ثابت، افزایش سرعت جریان سبب افزایش سایز ذرات میگردد. همچنین این پارامتر وابسته به سرعت پمپ پریستالتیک میباشد. ویسکوزیته ماده ورودی تاثیر مستقیمی بر سایز ذرات دارد. اسپری نمودن مایع ورودی با کششسطحی بالا، دشوار میباشد. این مشکل میتواند با افزودن امولسیفایر و یا هوموژنیزاسیون ماده ورودی پیش از خشککن افشانی مرتفع گردد (32, 31). پارامترهایی که در بخش تماس با هوای داغ و تبخیر باید مورد توجه قرارگیرند شامل دمای ورودی و خروجی و دمای انتقال شیشهای Tg میباشد. دمای ورودی باید به حدی بالا باشد که منجر به باقی ماندن حداقل رطوبت در محصول شده و حداکثر میزان محصول خروجی را تولید کند. به دلیل آنکه دمای خروجی تعادلی از گرما و جرم در محفظه خشککن میباشد، تنظیم دقیق آن ممکن نمیباشد. این پارامتر بر میزان رطوبت و شکل و ویژگی سطح ذرات محصول نهایی تاثیرگذار میباشد. دمای انتقال شیشهای، نقطهای است که ماتریکس از حالت ساختار شیشهای بهحالت لاستیکی تغییر میکند. دمای انتقال شیشهای وابسته بهچسبندگی محصول به دیواره محفظه خشککن میباشد. این دما وابسته به مواد ورودی و تغذیه شونده به دستگاه میباشد که هر چه ترکیبات ورودی به دستگاه وزن مولکولی بالاتری را داشته باشند، سبب تودهای و یا کلوخهای شدن بیشتر محصول خروجی از خشککن افشانی بهویژه پس از بستهبندی محصول میگردد. کنترل میزان آب محلول ورودی میتواند Tg را کنترل نماید. دمای خشک کردن باید پایینتر از دمای Tg ترکیب باشد تا مانع از چسبندگی در محفظه خشککن افشانی گردد. زمان باقی ماندن ذرات در سیکلون مرتبط با خشک شدن کلی ذرات تغذیه شونده و کنترل دمای ذرات به منظور کاهش تجزیه حرارتی میباشد. حد وسط زمان باقی ماندن در محفظه خشککن 35-25 ثانیه میباشد که با هدف رسیدن به حداقل میزان رطوبت در محصول، تغییر میکند (33،32،30). در جدول 1 برخی از گزارشات ریزپوشانی پروبیوتیکها با روش خشککن افشانی بهطور خلاصه مرور گشته است.
.jpg)
شکل 1: نمایی از خشککن افشانی و مراحل آن
جدول1: مروری بر شرایط ریزپوشانی پروبیوتیکها بهروش خشککن افشانی
4- معیارهای مهم در انتخاب ماده دیواره ریزپوشانه
در اغلب ریزپوشانیها از ترکیبات کربوهیدرات، پروتئین و لیپیدها بهمنظور ماده دیواره و محافظ هسته ریزپوشانه استفاده میگردد (شکل 2). موادی که برای ریزپوشانی پروبیوتیکها استفاده میگردند، باید شامل شرایط خاصی باشند که شامل پیشنیازهای زیر میباشد.
• غیرسمی باشند و در عین حال زندهمانی سلول ها را حفظ نمایند. در واقع نباید فعالیت ضدمیکروبی داشتهباشند. بهعنوان مثال کیتوزان به دلیل بار مثبت ناشی از گروههای آمین که با ترکیبات پلیآنیونی دیواره سلولهای باکتریایی واکنش میدهد، سبب تاثیر منفی بر باکتریها میگردد (42).
• حلالیت بالایی در آب داشتهباشد در واقع، قابلیت نفوذ بالا در متابولیتها و مواد مغذی با وزن مولکولی پایین که برای زندهمانی سلولهای ریزپوشانی شده ضروری هستند را داشته باشد (43).
• ویژگی محافظت حرارتی را به منظور افزایش زندهمانی طی دوره خشککردن افشانی و دوره نگهداری داشته باشد.
• دمای انتقال شیشهای بالایی را داشته باشد. تفاوت زیاد و یا افت شدید از دمای ذره به دمای Tg، سبب افزایش احتمال ازدست رفتن یکپارچگی غشای سلول بهدلیل انتقال از حالت کریستالی به فاز لاستیکی میگردد که این اتفاق سبب افزایش سیالیت غشای سلول و در نهایت مرگ سلول میگردد (44).
• نسبت به انتشار اکسیژن از میان ماتریکس ماده دیواره مقاوم باشد. بدین طریق که انرژی فعالسازی (Ea) بالایی در طی فرایند خشکشدن، نیاز داشته باشد (45).
• منحنی خشک کردن آن بهگونهای باشد که در ابتدا نرخ کاهشی داشته باشد. در حالی که تبخیر آب توسط پدیده انتشار کنترل میگردد، برخی از مواد گزینه خوبی برای محافظت در برابر اکسیداسیون لیپیدها میباشند (46).
• مقاومت به شرایط اسیدی بخش بالایی دستگاه گوارش داشتهباشد. بهعنوان مثال آب پنیر مقاومت خوبی در برابر شرایط اسیدی معده از خود نشان میدهد. این بدین دلیل است که دناتوراسیون حرارتی و تجمع پروتئینهای آب پنیر طی مرحله خشککن افشانی سبب افزایش خاصیت امولسیونی آن میگردد که سبب بهبود جذب پروتئینهای آب پنیر در سطح بین سلولها و ماتریکس ماده دیواره شده و باعث تشکیل لایه نازک ژل مانند شده، که سبب افزایش زندهمانی سلولهای پروبیوتیک طی مرحله خشککردن و نگهداری میگردد (47).
• در pH بالای 6 ناپایدار باشد. به منظور نفوذ و رهاسازی سلولها در روده بزرگ که محل کاربردی پروبیوتیکها در مسیر دستگاه گوارش میباشد، این امر ضروری است (48). لازم بهذکر است که ماده انتخابی برای دیوارهی ریزپوشانه باید بهگونهای باشد که این روش را روش غیروابسته به سویه گرداند. در واقع بزرگترین چالش برای استفاده موفقیتآمیز از روش خشککن افشانی برای ریزپوشانی سلولهای باکتریایی وابستگی روش به نوع سویه میباشد. توانایی ماده دیواره برای تشکیل ماتریکس شیشهای با ویسکوزیته بالا به منظور پایداری سلولهای باکتری طی مرحله خشککن افشانی و پس از خشک کردن مهم میباشد. واکنش انتشار کنترل شده موادشیمیایی در فاز شیشهای متوقف شده که سبب بهبود پایداری سلول طی مرحله خشککن افشانی و دوره نگهداری میگردد. مواد پلیمری استفاده شده برای دیواره با وزن مولکولی بالا بهدلیل ایجاد فاصله بین سلولها سبب افزایش استحکام ماتریکس میگردند و از طرفی نیز بهدلیل وزن مولکولی بالا قابلیت نفوذ به فضای داخلی غشای سلولی را ندارند (30). از طرفی ترکیبات با وزن مولکولی پایین میتوانند به محض آمادهسازی محلول تغذیه شونده به خشککن افشانی به فضای داخلی غشای سلولها نفوذ کرده و به فاز شیشهای طی روند فرایند آبزدایی (کمبود آب) انتقال یابد. فاز شیشهای، مقاومت مکانیکی به غشای دولایه را بهبود میبخشد. مثال مناسب این ترکیبات، ترهالوز میباشد که یک دیساکارید بوده و محافظ خوبی در برابر استرسهای اسمزی و حرارتی میباشد (25).
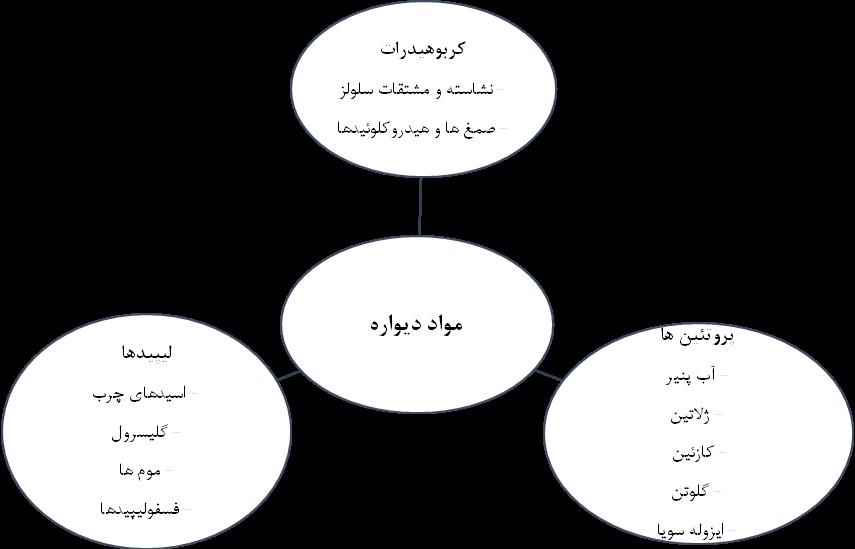
شکل 2: مواد مورد استفاده برای دیواره ریزپوشانهها
5- آزمونهای آنالیزی بر روی محصول پروبیوتیک ریزپوشانی شده با روش خشککن افشانی
1-5 بازدهی سلول های پروبیوتیک ریزپوشانی شده
تخمین میزان بازدهی پروبیوتیکهای ریزپوشانی شده شامل محاسبه میزان زندهمانی سلولهای پروبیوتیک قبل و بعد از خشککن افشانی میباشد. این روش اغلب از طریق شمارش استاندارد کلنیها بر روی محیطکشتMRS agar انجام میگیرد. نکته مهم در این بخش آزادسازی و رهایش صحیح سلولها از میکروکپسولها به داخل محیط رشد میباشد که بستگی به شرایط آبگیری مجدد مواد دیواره ریزپوشانه دارد. نمونههایی از میزان بازدهی سلولهای پروبیوتیک ریزپوشانی شده با روش خشککن افشانی در جدول (1) آورده شدهاست. دما و زمان آبگیری مجدد به عنوان فاکتورهای مهم این بخش لحاظ شدهاند. بهترین دمای آبگیری مجدد بین 30 تا 37 درجه سانتیگراد و بهترین زمان بین 15-30 دقیقه درنظر گرفته شدهاست. بغیر از از دما و زمان، گاهی اوقات نیاز هست که pH محیط نمکی نیز تنظیم گردد، که در این موارد محیط بهعنوان محیط بازسازیشده (reconstitute) درنظر گرفته میشود. بدین ترتیب پس از تهیه سریال رقت از محصول ریزپوشانی شده با روش خشککن افشانی، بهروش پورپلیت یا کشت سطحی بر روی محیطکشت MRS agar شمارش میکروبی انجام شده و سپس در دمای 37 درجه سانتیگراد به مدت 24-72 ساعت داخل انکوباتور قرار میگیرد. سپس تعداد سلولهای زنده به صورت CFU در واحد گرم از پودر خشک ریزپوشانی شده و یا میلیلیتر از محلول آبگیریشده گزارش میگردد (2, 37, 49).
2-5 بررسی پایداری و زندهمانی ریزپوشانه در شرایط شبیهسازی شده دستگاه گوارش
بررسی برونتنی پایداری سلولهای پروبیوتیک بهمنظور بررسی کارایی ماده دیوارهی ریزپوشانه و پارامترهای فرایند خشککن افشانی،در شرایط شبیهسازی شده روده و معده انسان انجام میگیرد. شرایط شبیهسازی شده معده، نیازمند ترکیبی از کلسیمکلرید(CaCl2) سدیم کلرید (NaCl)، پتاسیم کلرید (KCl)، سدیم بیکربنات (NaHCO3) و پپسین میباشد که pH آن بهکمک اسید هیدروکلریدریک (اغلب یک مولار) در حدود 9/1 تا 5/2 تنظیم میگردد. سپس وزن مشخصی از پودر ریزپوشانی شده داخل این محیط با دمای 37 درجه سانتیگراد و همزن با دور ثابت قرار میگیرد. سپس در فواصل زمانی مشخص نمونهبرداری شده و شمارش میکروبی انجام میگردد. پس از اتمام زمان قرارگیری در شرایط معده، نمونه سانتریفیوژ شده و مجدد در محیط MRS broth حاوی صفرا که pH آن در حدود 4/7 تنظیم شده است، وارد میگردد. این شرایط، شرایط شبیهسازی روده میباشد. سپس نمونه داخل این محیط در دمای 37 درجه سانتیگراد و همزن با دور ثابت قرار میگیرد. سپس در فواصل زمانی مشخص نمونهبرداری شده و شمارش میکروبی انجام میگردد (51،50،38).
3-5 بررسی میزان محتوای رطوبتی
با توجه به اهمیت پایین بودن رطوبت در نمونه خشک شده بهدلیل حفظ ماندگاری و افزایش طولعمر محصول، یکی از فاکتورهایی که در نمونههای ریزپوشانی شده با خشککن افشانی مورد بررسی قرار میگیرند، فاکتور محتوای رطوبتی میباشد. تعیین میزان محتوای رطوبتی بر اساس روشهای مختلف وزنسنجی، تیتراسیون، انکسارسنجی، روش هدایت الکتریکی و سایر روشها انجام میگیرد. برای نمونههای ریزپوشانی شده با روش خشککن افشانی اغلب از روش وزنسنجی قبل و بعد از خشک کردن استفاده میشود. بدین شکل که وزن مشخصی از نمونه خشک شده داخل ظرف آلومینیومی بهخوبی پخش شده و داخل آون با هوای داغ (اغلب دمای 105 درجه سانتیگراد) به مدت 24 ساعت قرار میگیرد. سپس اختلاف وزن قبل و بعد از خشک شدن نمونه گزارش میگردد. برای نمونههایی که ماده دیواره آنها حاوی ترکیبات فرار و یا مواد با پایه قندی بوده و یا برای ریزپوشانههای با هسته حساس به حرارت، استفاده از آون خلاء با دمای 70 درجه سانتیگراد و بهمدت 24 ساعت توصیه میگردد. روشهای سریعی همچون آنالیز رطوبت با آنالیزکننده مادونقرمز وجود دارد. ولی همواره صحت این روشهای سریع باید با روش آون خلاء تایید گردد (52،30).
4-5 شکل و اندازه سلولهای ریزپوشانی شده
اغلب ویژگی ساختاری ریزپوشانههای حاصل از روش خشککن افشانی به کمک الکترون میکروسکوپی مورد بررسی قرار میگیرند. سایز ذرات ریزپوشانه به دلیل تاثیر بر ویژگیهای عملکردی محصولات ریزپوشانی شده، مورد توجه میباشد. روشهای متفاوتی برای اندازهگیری سایز ذرات همانند انکسار نور لیزر Laser diffraction ، تفرق نور Dynamic light scattering و یا آنالیز تصویر وجود دارد. اغلب از روش انکسار نور لیزر برای اندازه گیری سایز ذرات استفاده میگردد. در این روش سایز ذرات با اندازهگیری تفاوت در تغییرات زاویهای در شدت نور پراکنده پرتو لیزر از میان نمونه پراکنده شده، مشخص میگردد. تفاوت در شدت نور پراکنده شده، بهعنوان تفاوت در سایز ذرات عنوان میگردد. لازم به ذکر است که نمونه در ابتدا باید با یک حلال مناسب مخلوط و در حلال پراکنده گردد (53،30).
1-4-5 روش اسکن میکروسکوپ الکترونی (SEM)
در این روش پرتو باریکی از الکترونها به سرعت، سطح نمونه را اسکن میکنند. این نتایج در بارانی از الکترونهای ثانویه که توسط ماده براقی که سیگنالهای الکترونی تولید میکند، از سطح نمونه، جمع شده و شناسایی میگردد. سیگنالها سپس شناسایی و تقویت شده تا تصویری بر روی لامپ اشعه کاتدی ایجاد کند. مشکل این روش هزینه بالای آن، عملکرد در خلاء زیاد و نیازمند رسانایی و هدایت بالای نمونه میباشد (54).
نتیجه گیری
در حال حاضر صنایع مختلف غذایی و دارویی در حال استفاده از روش خشککن افشانی بهمنظور ریزپوشانی برخی از ترکیبات و ماده موثره و ترکیبات عملگرا همانند پروبیوتیکها میباشند. در رابطه با ریزپوشانی پروبیوتیکها توجه به بهینه بودن شرایط رشد، بهینه بودن شرایط برداشت سلول و استفاده از بهترین و سازگارترین ترکیبات دیواره با باکتری و شرایط خشککن افشانی بسیار مهم میباشد. بهینه بودن تمامی این شرایط سبب افزایش زندهمانی باکتری حین خشک کردن، طی دوره نگهداری و حین عبور از دستگاه گوارش میگردد. اگرچه حرارت و دمای بالا اغلب برای باکتریهای پروبیوتیک عامل کشنده میباشد ولی با توجه به مزایای زیاد این روش، تمایل به استفاده از آن زیاد میباشد. لازم بهذکر است که توجه به پارامترهای خشککن افشانی میتواند بر زندهمانی و عملکرد سلولهای پروبیوتیک ریزپوشانی شده، تاثیر چشمگیری داشته باشد. همواره آزمونهای خاصی بهمنظور بررسی زندهمانی و عملکرد پروبیوتیکهای ریزپوشانی شده با این روش، بر روی ریزپوشانهها انجام میگردد ولی با توجه به پیشرفت علم، دقیقترین و سریعترین روشها بهمنظور انجام این آزمونها در حال بررسی میباشند.
تعارض در منافع: وجود ندارد.
در سالهای اخیر، بررسی تعداد باکتریهایی که توان و ویژگیهای باکتریهای پروبیوتیک را دارند؛ افزایش یافته است. باکتریهای پروبیوتیک باکتریهایی هستند که اگر در حالت زنده و بهتعداد کافی مصرف شوند؛ میتوانند خواص سلامتبخشی را ایجاد کنند. تاثیرات سودمند باکتریهای پروبیوتیک بستگی به نوع سویه، میزان دوز مصرفی و زندهمانی باکتری مصرف شدهدارد (3-1). فدراسیون بینالمللی لبنیات (IDF) وجود حداقل میزان 107 باکتری پروبیوتیک زنده در هر گرم یا میلیلیتر از محصول غذایی را در هنگام مصرف پیشنهاد نمودهاست. بنابراین زندهمانی تعداد کافی از باکتری و تضمین حفظ خواص آنها طی دوره نگهداری محصول از پیشنیازهای مصرف آنهاست (4). خشک کردن یک از فرایندهایی است که بهطور گسترده برای نگهداری غذا و افزایش مدت زمان نگهداری محصول و پایداری آن، کاهش هزینههای حمل و نقل و سهولت تجارت انجام میگردد. در میان روشهای مختلف خشککردن، خشککردن افشانی یکی از روشهای پرکاربرد در صنعت لبنیات میباشد (5). سایز ذرات تغذیه شونده به دستگاه با این روش بین 10 تا 150 میکرون بوده که با جریانی از هوای داغ و خشک با دمای 150-250 درجه سانتیگراد روبرو میگردند. افزایش فضای تماس هوا-مایع پس از اسپری نمودن ماده ورودی، سبب افزایش چشمگیر در کینتیکهای خشک شدن میگردد که سبب وقوع خشک شدن در چندین ثانیه میگردد. خشککن افشانی در مقایسه با خشککن انجمادی، هزینه انرژی کمتری دربر داشته و بهرهوری بالاتری را نیز دارد. با این وجود هنوز چالش استفاده از روش خشککن افشانی برای سویههای حساس پروبیوتیک وجود دارد (7, 6).
1-مرحله پیش از خشک کردن
عوامل بسیاری در میزان مقاومت و زندهمانی باکتری پروبیوتیک در برابر شرایط خشک کردن با خشککن افشانی موثر هستند. در این بخش ابتدا به عوامل موثر قبل از ورود به خشککن افشانی که مربوط به کشت باکتریایی میباشد؛ میپردازیم.
1-1 انتخاب سویه باکتریایی
در اغلب تحقیقات، خشک کردن باکتریهای پروبیوتیک لاکتوکوکوس، لاکتوباسیلوس و سویههای مختلف بیفیدوباکتریوم مورد بررسی قرار گرفتهاند. اغلب باکتریهای پروبیوتیک با استفاده از روش خشککن افشانی بهدلیل متحمل شدن شرایط سختی که طی این فرایند بر باکتری غالب میگردد، زندهمانی خوبی را نخواهند داشت. ویژگی مقاومت در این باکتریها باید معیار و ملاک انتخاب آنها برای خشککردن باشد تا زندهمانی آنها در پودر بهدست آمده با این روش بیشتر باشد. حرارت، اسمز، اکسیداسیون و استرس خشک کردن بهعنوان مکانیسمهای مهم که سبب غیرفعال شدن باکتری طی دوره خشک کردن افشانی و پس از آن میگردد، در نظر گرفته شدهاند (8). در تحقیقات مختلف، گزارش شده است که سویه یا گونههای مختلف باکتریایی، ممکن است تحمل متفاوتی برای این شرایط از خود نشان دهند. مقایسه بین باکتریهای پروبیوتیک لاکتوباسیلوس، لاکتوکوکوس و بیفیدوباکتریومها نشان داد که پروپیونی باکتریومها به دلیل توانایی بالاتر آنها در تطابق با محیط تحمل و مقاومت بالاتری را نشان دادند (9). دلیل این امر میتواند ناشی از متابولیسم آنها یا پاسخهای چندگانه تحملی آنها باشد. با این وجود مطالعات مربوط به خشک کردن پروپیونی باکتریومها اندک میباشد. استرپتوکوکوسها نیز در مقایسه با لاکتوباسیلوسها تحمل و مقاومت بالاتری حین خشک کردن با خشککن افشانی از خود نشان دادند. حد آستانه دمایی که سبب آسیب بهسلولهای میکروبی میگردد اغلب حد بالای دمای رشد گونههای باکتریایی میباشد. دلیل مقاومت حرارتی بالاتر باکتریهای استرپتوکوکوس ترموفیلوس نسبت به لاکتوباسیلوسها نیز میتواند ناشی از همین علت باشد اگرچه در گزارش کارنی و همکاران (2009) سویه لاکتوباسیلوس کازئی NFBC 338پس از خشک شدن با روش خشککن افشانی، زندهمانی مشابه با استرپتوکوکوس ترموفیلوس از خود نشان داد (11, 10). مایل و همکاران (2005) به این نتیجه دست یافتند که تحمل فشار اسمزی لاکتوباسیلوس پلانتاروم عموماً از اشرشیاکلای، لاکتوباسیلوس بولگاریکوس و در برخی موارد از مخمرها نیز بیشتر میباشد. در سایر گونههای لاکتوباسیلوس همانند کازئی، پاراکازئی، اسیدوفیلوس و سالیواریوس میزان تحمل و مقاومت به استرسها وابسته به سویه میباشد. در بررسی 17 سویه از بیفیدوباکتریومها مشخص گردید که سویههای مقاوم به حرارت و اکسیژن، زندهمانی بهتری پس از خشک شدن با روش خشککن افشانی داشتند. مورد مشابه با این موضوع، در ارتباط با لاکتوکوکوس لاکتیس و لاکتوباسیلوس رامنوسوس گزارش شدهاست (12). اگرچه عموماً گونههای باکتریایی، نمایانگر مقاومت ظاهری باکتریهای مختلف میباشند اما بهنظر میرسد که توان باکتریهای پروبیوتیک طی خشککردن با خشککن افشانی وابسته به نژاد آنها باشد. برخی تغییرپذیریها اغلب مربوط به محیط زیست اولیه و منبع جداسازی باکتری، حضور وجود ژنهای خاص، واکنش با ماتریکس خارج سلولی و یا توانایی برای انباشته نمودن پلیفسفات داخل سلولی و تولید اگزوپلیساکارید میباشد (13).
2-1 پاسخ به استرسهای سلولی
شرایط رشد سلول بهعنوان فاکتور مهمی برای تحمل باکتریایی بر شرایط استرس باکتریایی در نظر گرفته شده است. در واقع باکتریهای پروبیوتیک همانند سایر باکتریها، توانایی مقابله و منطبق شدن با محیطهای نامساعد و محیطهای دارای استرس همانند استرس اسمزی و یا دمای بالا را دارند. این کار از طریق فعالسازی سیستم پاسخ استرسی سلولی انجام میگردد که میتواند تحمل باکتریهای پروبیوتیک طی دوره خشککردن با خشککن افشانی را مشخص کند. این سیستم عموماً از طریق مواجهه با دوزهای پایینتر از حد کشندگی استرسها تحریک میگردد (14). اگرچه بهبود در زندهمانی پروبیوتیکها با روش خشککن افشانی همانند منطبق شدن با گرما و یا نمک موثر نیست، اما مواجهه باکتری با هیدروژن پراکسید 0/003 مولار برای 30 دقیقه و یا نمکهای صفراوی 0/1 وزنی/ حجمی برای 30 دقیقه میتواند زندهمانی باکتری طی خشک کردن با خشککن افشانی را بهبود بخشد. در برخی موارد نیز پیشتیمار باکتری با فشار بالا سبب افزایش مقاومت بهگرما شده است. شرایط قحطی و کمبود به ویژه کمبود گلوکز نیز میتواند تحمل باکتری به استرسهای اسمزی و حرارتی را تحریک نماید. در برخی تحقیقات، گزارش شده است که تغییرات و بهبود ژنتیکی به کمک مهندسی ژنتیک توانسته است 5 تا 50 برابر سبب افزایش مقاومت باکتری در برابر شرایط استرسزای حرارتی گردد و در برخی موارد نیز بدون تاثیر بوده است (16, 15). پراساد و همکاران (2003) دریافتند که پیشتیمار در شرایط شوک حرارتی با دمای 50 درجه سانتیگراد و سدیمکلرید با غلظت 0/6 مولار، سبب افزایش معنادار زندهمانی در سویه لاکتوباسیلوس رامنوسوس HN001 در مقایسه با نمونه کنترل شد. بررسیها توسط الکتروفورز ژل نشان داد که میزان یازده نوع پروتئین از جمله پروتئینهای شوک حرارتی GroEL و ِDnaK افزایش یافتند.
میزان آنزیمهای لاکتات دهیدروژناز، انولاز، فسفوگلیسرات کیناز، تریوز فسفات ایزومراز نیز در نمونه پیشتیمار شده بیش از نمونه کنترل گزارش شد. همچنین در آنالیز کربوهیدرات محتوای سیتوپلاسمی نشانگر وجود ساکاریدهای بهبود یافته با گلیسرول در نمونه پیشتیمار شده بود (17). بهطور کلی در اغلب موارد تحمل شرایط خشککن افشانی تحت تاثیر این که کشت باکتریایی چگونه انجام و تولید شدهاست، قرار میگیرد. بهعلاوه برخی باکتریها نیازی به ساخت پروتئین به منظور بهبود و ترمیم پس از آسیب ناشی از خشک کردن ندارند و برخی نیز توانایی لازم برای سنتز این پروتئینها را نداشته که در این مورد تولید زیاد پروتئینهای پاسخ استرسی پیش از خشککردن، میتواند تاثیر مفیدی بر محافظت باکتری از آسیب خشک شدن داشته باشند. در این بخش پروتئینها و بهویژه پروتئینهای محافظتی همراه، وظیفه ممانعت یا ترمیم پلیپپتیدهای با پیچخوردگیهای اشتباه ( mis-folding) را برعهده دارند (18).
3-1 شرایط رشد و آمادهسازی ماده تزریق شونده
1-3-1محیطکشت
در تعداد اندکی از مطالعات ذکر شدهاست که محیط کشت میتواند چه تاثیراتی بر زندهمانی پرویوتیکها پس از خشکشدن بگذارد. در اغلب تستهای آزمایشگاهی، از محیط کشت MRS broth استفاده میگردد که محیط کشت نسبتاً گران قیمت برای مصارف صنعتی و از درجه غیرغذایی میباشد. رشد لاکتوباسیلوس پلانتاروم در محیط کشت MRS broth رقیق سبب دریافت کمتر بتائن و کارنتین توسط باکتری شده که خود باعث افزایش زندهمانی باکتری پس از خشک شدن میگردد (19). در برخی تحقیقات از ترکیبات لبنی همانند آب پنیر و یا شیر بدون چربی، برای کشت باکتری استفاده شده است که ارزانتر بوده، خوراکی بوده و به آسانی برای تولید سلول باکتری پروبیوتیک قابل استفاده میباشد. همچنین این ترکیبات میتواند فرایندهای پس از تولید همانند خشک شدن را بهبود بخشند. زمانی که باکتری با کاهش فعالیت آبی مواجه میشود سعی میکند تا با فشار اسمزی آن را جبران کند و بنابراین با تجمع حل شوندههای سازگار همانند آمینواسیدها و آمینهای چهارم و یا کربوهیدراتها، سعی دارد تا زندهمانی خود را حفظ تماید. این روش نیز میتواند راه حلی برای افزایش زندهمانی پروبیوتیکها طی شرایط خشک کردن باشد. البته لازم بهذکر است با توجه به مطالعات انجام شده بر روی نژادهای متفاوت، این روش الزاما سبب افزایش تحمل گرمایی طی خشککردن نمیگردد. ساخت این ترکیبات حل شونده در لاکتیک اسید باکتریها، وابسته به وجود پیشساز آنها در محیطکشت است. با توجه به کوتاه بودن مدت زمان روش خشککن افشانی بهتر است که ترکیبات حلشونده سازگار و پیشسازها به محیط کشت باکتری افزوده شوند (20, 16). کاروالو و همکاران (2004) دریافتند که لاکتوباسیلوس بولگاریکوس رشد یافته در محیطکشت غنیشده با لاکتوز، توان تحمل حرارتی بیشتری را دارند (21) .
2-3-1 pH رشد
pH محیط رشد باکتری میتواند بر زندهمانی و مقاومت آن طی خشک شدن تاثیرگذار باشد. سلولها ممکن است بر اثر ماندن در pH پایین بهمدت طولانی، توانایی حفظ pH بین سلولی نزدیک بهخنثی را نداشته باشند که سبب کاهش زندهمانی و فعالیت باکتری پروبیوتیک در این شرایط میگردد. توانایی باقی ماندن در هموستاز pHبین سلولی در بین نژادهای مختلف متفاوت است. این امر میتواند وابسته بهتوانایی نژاد باکتری برای تطابق با اسید باشد که محافظت تقاطعی در طی خشک کردن را تحریک میکند. چون استرس اسیدی سلولها را تحت تاثیر قرار میدهد، pHنهایی کشت، زمان برداشت و یا نگهداری ماده ورودی به خشککن پیش از خشک کردن باید در نظر گرفته شود (23, 22). در گزارش سیلوا و همکاران (2002) تاثیر pH بر زندهمانی سلولهای لاکتوباسیلوس بولگاریکوس پس از خشک شدن با خشککن افشانی مشخص گردید. آنها دریافتند که سلولهای رشد یافته در pH کنترل نشده در مقایسه با سلولهای رشد یافته در pH کنترل شده 6/5، زندهمانی بهتری از خود نشان دادند (24).
3-3-1 فاز رشد
باکتریهای پروبیوتیک اغلب در انتهای فاز رشد لگاریتمی و یا ابتدای فاز سکون برداشت میگردند تا بالاترین بازده بدست آید. البته اغلب فاز سکون برای این کار انتخاب میگردد زیرا سلولها طی این دوره مقاومت بیشتری در برابر خشک شدن از خود نشان میدهند. در واقع مقاوت به استرسهای مختلف طی فاز سکون افزایش مییابد. دلیل این امر ایجاد شرایط دشوار و چالشبرانگیز بوده که سبب رهاسازی پاسخهای سریع میشود. این امر نیازمند پروتئینهای استرس کلی و فاکتورهای جایگزین سیگما میگردد که منجر به تحملهای چندگانه استرسی میشود (26،25،6). کورکوران و همکاران (2004) با برداشت سلولهای لاکتوباسیلوس رامنوسوس در فاز تاخیر، ابتدای فاز رشد و ابتدای فاز سکون و خشک نمودن سلولها در خشککن افشانی، زندهمانی بعداز خشک کردن برای سلولهای برداشت شده در ابتدای فاز سکون و رشد را به ترتیب بیش از 50 درصد و 14 درصد گزارش نمودند.
4-3-1 تکنیک برداشت سلول
سانتریفیوژ یکی از روشهای متداول و پرکاربرد برداشت سلول میباشد که بهعنوان روش با کارایی بالا لحاظ شده است. اغلب دمای برداشت سلول در سانتریفیوژ 4 درجه سانتیگراد میباشد. در برخی موارد این دما بر خشک شدن سلول تاثیرگذار گزارش شدهاست. روشهایی مانند فیلتراسیون غشایی نیز مورد بررسی قرار گرفتهاند که البته این روش برای خشک کردن باکتری با روش خشککن افشانی مورد استفاده قرار نگرفتهاست (27). جداسازی باکتری از محیطکشت می تواند سبب از دست رفتن مواد و انرژی قابلملاحظهای گردد. بنابراین اغلب در مقیاس بزرگ ترجیح بر حفظ محیط کشت و خشک کردن مستقیم باکتری با محیط کشت میباشد. بهعلاوه برخی اسیدهای چرب و ویتامینها و باکتریوسینها که در محیط کشت ایجاد و حفظ شدهاند، میتوانند پودر باکتری تولید شده را غنی و باارزشتر بسازند. با این روش، محیط کشت هم به عنوان محیط رشد باکتری و هم بهعنوان محیط خشک کردن افشانی باکتری مورد استفاده قرار میگیرد. با توجه به نوع مصرف باکتریها (در صورتیکه برای موادغذایی استفاده شوند)، ترکیبات محیط کشت باید از درجه غذایی باشند. مشکل اصلی این روش این است که محیط همتوان (isotonic) رشد باکتری اغلب باید محتوای جامد کم و در حدود 5-10 درصد داشته باشد. در حالی که اغلب برای بهرهوری بالا و حفظ انرژی لازم است که محتوای جامد محیط، بالاتر از این مقدار باشد. این حالت با افزایش پودر بیشتر به محیط کشت یا کاربرد روشهای تغلیظی بهدست میآید. لازم به ذکر است که مراحل بینابینی (همانند افزودن پودر به محیطکشت در مراحل ثانویه) احتمال کاهش زندهمانی و ریسک آلودگی را افزایش میدهد (28, 16). 2- مرحله خشک شدن با خشککن افشانی
آسیب به سلول باکتری طی مرحله خشککن افشانی تنها بهدلیل تاثیر دمای بالا و تغییر دمایی نبوده، بلکه مربوط به از دست رفتن آب پیوسته در سطح سلول نیز میباشد. یکی از نقاط حساس به آسیب سلول، غشای سیتوپلاسمی میباشد که طی فرایند خشککن افشانی، این آسیب اغلب رخ میدهد. در واقع حذف آب منجر به تغییر وضعیت فسفولیپیدهای دولایه از حالت لایهای به فاز ژلی و یا هگزاگونال میگردد. این تغییرات در زنجیره فسفولیپیدها باعث بهدست آمدن ساختار کاملاً گسترده و سخت میگردد. تاثیر دیگر میتواند بر نوکلئیکاسید و ریبوزومها بهدلیل استرس ناشی از آبزدایی اعمال گردد که به دلیل از دست رفتن+Mg 2 به دلیل آسیب گرمایی در غشای سلولی رخ دهد (29).
3- روش خشککن افشانی
در بین روشهای بسیاری که برای ریزپوشانی انجام میگردد، روش خشککن افشانی روشی معروف بوده که در صنعت غذا موفقیتهای بسیاری را کسب نموده است. مراحل خشککن افشانی شامل 4 مرحله اسپری نمودن، تماس با هوای داغ، تبخیر رطوبت و جداسازی ذرات نهایی میباشد (30). پارامترهای مهم در مرحله اسپری نمودن شامل فشار اسپری نمودن، ویسکوزیته ماده ورودی یا تغذیه شونده (feed) بهدستگاه، سرعت جریان ماده ورودی و کشش سطحی ماده ورودی به دستگاه میباشد که بر کیفیت محصول نهایی تاثیرگذار میباشد. افزایش فشار اسپری نمودن (atomization)، مستقل از نوع مواد ورودی و نوع نازل، سبب کاهش اندازه ذرات میگردد. در اسپری نمودن نمونه با فشار ثابت، افزایش سرعت جریان سبب افزایش سایز ذرات میگردد. همچنین این پارامتر وابسته به سرعت پمپ پریستالتیک میباشد. ویسکوزیته ماده ورودی تاثیر مستقیمی بر سایز ذرات دارد. اسپری نمودن مایع ورودی با کششسطحی بالا، دشوار میباشد. این مشکل میتواند با افزودن امولسیفایر و یا هوموژنیزاسیون ماده ورودی پیش از خشککن افشانی مرتفع گردد (32, 31). پارامترهایی که در بخش تماس با هوای داغ و تبخیر باید مورد توجه قرارگیرند شامل دمای ورودی و خروجی و دمای انتقال شیشهای Tg میباشد. دمای ورودی باید به حدی بالا باشد که منجر به باقی ماندن حداقل رطوبت در محصول شده و حداکثر میزان محصول خروجی را تولید کند. به دلیل آنکه دمای خروجی تعادلی از گرما و جرم در محفظه خشککن میباشد، تنظیم دقیق آن ممکن نمیباشد. این پارامتر بر میزان رطوبت و شکل و ویژگی سطح ذرات محصول نهایی تاثیرگذار میباشد. دمای انتقال شیشهای، نقطهای است که ماتریکس از حالت ساختار شیشهای بهحالت لاستیکی تغییر میکند. دمای انتقال شیشهای وابسته بهچسبندگی محصول به دیواره محفظه خشککن میباشد. این دما وابسته به مواد ورودی و تغذیه شونده به دستگاه میباشد که هر چه ترکیبات ورودی به دستگاه وزن مولکولی بالاتری را داشته باشند، سبب تودهای و یا کلوخهای شدن بیشتر محصول خروجی از خشککن افشانی بهویژه پس از بستهبندی محصول میگردد. کنترل میزان آب محلول ورودی میتواند Tg را کنترل نماید. دمای خشک کردن باید پایینتر از دمای Tg ترکیب باشد تا مانع از چسبندگی در محفظه خشککن افشانی گردد. زمان باقی ماندن ذرات در سیکلون مرتبط با خشک شدن کلی ذرات تغذیه شونده و کنترل دمای ذرات به منظور کاهش تجزیه حرارتی میباشد. حد وسط زمان باقی ماندن در محفظه خشککن 35-25 ثانیه میباشد که با هدف رسیدن به حداقل میزان رطوبت در محصول، تغییر میکند (33،32،30). در جدول 1 برخی از گزارشات ریزپوشانی پروبیوتیکها با روش خشککن افشانی بهطور خلاصه مرور گشته است.
.jpg)
شکل 1: نمایی از خشککن افشانی و مراحل آن
جدول1: مروری بر شرایط ریزپوشانی پروبیوتیکها بهروش خشککن افشانی

4- معیارهای مهم در انتخاب ماده دیواره ریزپوشانه
در اغلب ریزپوشانیها از ترکیبات کربوهیدرات، پروتئین و لیپیدها بهمنظور ماده دیواره و محافظ هسته ریزپوشانه استفاده میگردد (شکل 2). موادی که برای ریزپوشانی پروبیوتیکها استفاده میگردند، باید شامل شرایط خاصی باشند که شامل پیشنیازهای زیر میباشد.
• غیرسمی باشند و در عین حال زندهمانی سلول ها را حفظ نمایند. در واقع نباید فعالیت ضدمیکروبی داشتهباشند. بهعنوان مثال کیتوزان به دلیل بار مثبت ناشی از گروههای آمین که با ترکیبات پلیآنیونی دیواره سلولهای باکتریایی واکنش میدهد، سبب تاثیر منفی بر باکتریها میگردد (42).
• حلالیت بالایی در آب داشتهباشد در واقع، قابلیت نفوذ بالا در متابولیتها و مواد مغذی با وزن مولکولی پایین که برای زندهمانی سلولهای ریزپوشانی شده ضروری هستند را داشته باشد (43).
• ویژگی محافظت حرارتی را به منظور افزایش زندهمانی طی دوره خشککردن افشانی و دوره نگهداری داشته باشد.
• دمای انتقال شیشهای بالایی را داشته باشد. تفاوت زیاد و یا افت شدید از دمای ذره به دمای Tg، سبب افزایش احتمال ازدست رفتن یکپارچگی غشای سلول بهدلیل انتقال از حالت کریستالی به فاز لاستیکی میگردد که این اتفاق سبب افزایش سیالیت غشای سلول و در نهایت مرگ سلول میگردد (44).
• نسبت به انتشار اکسیژن از میان ماتریکس ماده دیواره مقاوم باشد. بدین طریق که انرژی فعالسازی (Ea) بالایی در طی فرایند خشکشدن، نیاز داشته باشد (45).
• منحنی خشک کردن آن بهگونهای باشد که در ابتدا نرخ کاهشی داشته باشد. در حالی که تبخیر آب توسط پدیده انتشار کنترل میگردد، برخی از مواد گزینه خوبی برای محافظت در برابر اکسیداسیون لیپیدها میباشند (46).
• مقاومت به شرایط اسیدی بخش بالایی دستگاه گوارش داشتهباشد. بهعنوان مثال آب پنیر مقاومت خوبی در برابر شرایط اسیدی معده از خود نشان میدهد. این بدین دلیل است که دناتوراسیون حرارتی و تجمع پروتئینهای آب پنیر طی مرحله خشککن افشانی سبب افزایش خاصیت امولسیونی آن میگردد که سبب بهبود جذب پروتئینهای آب پنیر در سطح بین سلولها و ماتریکس ماده دیواره شده و باعث تشکیل لایه نازک ژل مانند شده، که سبب افزایش زندهمانی سلولهای پروبیوتیک طی مرحله خشککردن و نگهداری میگردد (47).
• در pH بالای 6 ناپایدار باشد. به منظور نفوذ و رهاسازی سلولها در روده بزرگ که محل کاربردی پروبیوتیکها در مسیر دستگاه گوارش میباشد، این امر ضروری است (48). لازم بهذکر است که ماده انتخابی برای دیوارهی ریزپوشانه باید بهگونهای باشد که این روش را روش غیروابسته به سویه گرداند. در واقع بزرگترین چالش برای استفاده موفقیتآمیز از روش خشککن افشانی برای ریزپوشانی سلولهای باکتریایی وابستگی روش به نوع سویه میباشد. توانایی ماده دیواره برای تشکیل ماتریکس شیشهای با ویسکوزیته بالا به منظور پایداری سلولهای باکتری طی مرحله خشککن افشانی و پس از خشک کردن مهم میباشد. واکنش انتشار کنترل شده موادشیمیایی در فاز شیشهای متوقف شده که سبب بهبود پایداری سلول طی مرحله خشککن افشانی و دوره نگهداری میگردد. مواد پلیمری استفاده شده برای دیواره با وزن مولکولی بالا بهدلیل ایجاد فاصله بین سلولها سبب افزایش استحکام ماتریکس میگردند و از طرفی نیز بهدلیل وزن مولکولی بالا قابلیت نفوذ به فضای داخلی غشای سلولی را ندارند (30). از طرفی ترکیبات با وزن مولکولی پایین میتوانند به محض آمادهسازی محلول تغذیه شونده به خشککن افشانی به فضای داخلی غشای سلولها نفوذ کرده و به فاز شیشهای طی روند فرایند آبزدایی (کمبود آب) انتقال یابد. فاز شیشهای، مقاومت مکانیکی به غشای دولایه را بهبود میبخشد. مثال مناسب این ترکیبات، ترهالوز میباشد که یک دیساکارید بوده و محافظ خوبی در برابر استرسهای اسمزی و حرارتی میباشد (25).

شکل 2: مواد مورد استفاده برای دیواره ریزپوشانهها
5- آزمونهای آنالیزی بر روی محصول پروبیوتیک ریزپوشانی شده با روش خشککن افشانی
1-5 بازدهی سلول های پروبیوتیک ریزپوشانی شده
تخمین میزان بازدهی پروبیوتیکهای ریزپوشانی شده شامل محاسبه میزان زندهمانی سلولهای پروبیوتیک قبل و بعد از خشککن افشانی میباشد. این روش اغلب از طریق شمارش استاندارد کلنیها بر روی محیطکشتMRS agar انجام میگیرد. نکته مهم در این بخش آزادسازی و رهایش صحیح سلولها از میکروکپسولها به داخل محیط رشد میباشد که بستگی به شرایط آبگیری مجدد مواد دیواره ریزپوشانه دارد. نمونههایی از میزان بازدهی سلولهای پروبیوتیک ریزپوشانی شده با روش خشککن افشانی در جدول (1) آورده شدهاست. دما و زمان آبگیری مجدد به عنوان فاکتورهای مهم این بخش لحاظ شدهاند. بهترین دمای آبگیری مجدد بین 30 تا 37 درجه سانتیگراد و بهترین زمان بین 15-30 دقیقه درنظر گرفته شدهاست. بغیر از از دما و زمان، گاهی اوقات نیاز هست که pH محیط نمکی نیز تنظیم گردد، که در این موارد محیط بهعنوان محیط بازسازیشده (reconstitute) درنظر گرفته میشود. بدین ترتیب پس از تهیه سریال رقت از محصول ریزپوشانی شده با روش خشککن افشانی، بهروش پورپلیت یا کشت سطحی بر روی محیطکشت MRS agar شمارش میکروبی انجام شده و سپس در دمای 37 درجه سانتیگراد به مدت 24-72 ساعت داخل انکوباتور قرار میگیرد. سپس تعداد سلولهای زنده به صورت CFU در واحد گرم از پودر خشک ریزپوشانی شده و یا میلیلیتر از محلول آبگیریشده گزارش میگردد (2, 37, 49).
2-5 بررسی پایداری و زندهمانی ریزپوشانه در شرایط شبیهسازی شده دستگاه گوارش
بررسی برونتنی پایداری سلولهای پروبیوتیک بهمنظور بررسی کارایی ماده دیوارهی ریزپوشانه و پارامترهای فرایند خشککن افشانی،در شرایط شبیهسازی شده روده و معده انسان انجام میگیرد. شرایط شبیهسازی شده معده، نیازمند ترکیبی از کلسیمکلرید(CaCl2) سدیم کلرید (NaCl)، پتاسیم کلرید (KCl)، سدیم بیکربنات (NaHCO3) و پپسین میباشد که pH آن بهکمک اسید هیدروکلریدریک (اغلب یک مولار) در حدود 9/1 تا 5/2 تنظیم میگردد. سپس وزن مشخصی از پودر ریزپوشانی شده داخل این محیط با دمای 37 درجه سانتیگراد و همزن با دور ثابت قرار میگیرد. سپس در فواصل زمانی مشخص نمونهبرداری شده و شمارش میکروبی انجام میگردد. پس از اتمام زمان قرارگیری در شرایط معده، نمونه سانتریفیوژ شده و مجدد در محیط MRS broth حاوی صفرا که pH آن در حدود 4/7 تنظیم شده است، وارد میگردد. این شرایط، شرایط شبیهسازی روده میباشد. سپس نمونه داخل این محیط در دمای 37 درجه سانتیگراد و همزن با دور ثابت قرار میگیرد. سپس در فواصل زمانی مشخص نمونهبرداری شده و شمارش میکروبی انجام میگردد (51،50،38).
3-5 بررسی میزان محتوای رطوبتی
با توجه به اهمیت پایین بودن رطوبت در نمونه خشک شده بهدلیل حفظ ماندگاری و افزایش طولعمر محصول، یکی از فاکتورهایی که در نمونههای ریزپوشانی شده با خشککن افشانی مورد بررسی قرار میگیرند، فاکتور محتوای رطوبتی میباشد. تعیین میزان محتوای رطوبتی بر اساس روشهای مختلف وزنسنجی، تیتراسیون، انکسارسنجی، روش هدایت الکتریکی و سایر روشها انجام میگیرد. برای نمونههای ریزپوشانی شده با روش خشککن افشانی اغلب از روش وزنسنجی قبل و بعد از خشک کردن استفاده میشود. بدین شکل که وزن مشخصی از نمونه خشک شده داخل ظرف آلومینیومی بهخوبی پخش شده و داخل آون با هوای داغ (اغلب دمای 105 درجه سانتیگراد) به مدت 24 ساعت قرار میگیرد. سپس اختلاف وزن قبل و بعد از خشک شدن نمونه گزارش میگردد. برای نمونههایی که ماده دیواره آنها حاوی ترکیبات فرار و یا مواد با پایه قندی بوده و یا برای ریزپوشانههای با هسته حساس به حرارت، استفاده از آون خلاء با دمای 70 درجه سانتیگراد و بهمدت 24 ساعت توصیه میگردد. روشهای سریعی همچون آنالیز رطوبت با آنالیزکننده مادونقرمز وجود دارد. ولی همواره صحت این روشهای سریع باید با روش آون خلاء تایید گردد (52،30).
4-5 شکل و اندازه سلولهای ریزپوشانی شده
اغلب ویژگی ساختاری ریزپوشانههای حاصل از روش خشککن افشانی به کمک الکترون میکروسکوپی مورد بررسی قرار میگیرند. سایز ذرات ریزپوشانه به دلیل تاثیر بر ویژگیهای عملکردی محصولات ریزپوشانی شده، مورد توجه میباشد. روشهای متفاوتی برای اندازهگیری سایز ذرات همانند انکسار نور لیزر Laser diffraction ، تفرق نور Dynamic light scattering و یا آنالیز تصویر وجود دارد. اغلب از روش انکسار نور لیزر برای اندازه گیری سایز ذرات استفاده میگردد. در این روش سایز ذرات با اندازهگیری تفاوت در تغییرات زاویهای در شدت نور پراکنده پرتو لیزر از میان نمونه پراکنده شده، مشخص میگردد. تفاوت در شدت نور پراکنده شده، بهعنوان تفاوت در سایز ذرات عنوان میگردد. لازم به ذکر است که نمونه در ابتدا باید با یک حلال مناسب مخلوط و در حلال پراکنده گردد (53،30).
1-4-5 روش اسکن میکروسکوپ الکترونی (SEM)
در این روش پرتو باریکی از الکترونها به سرعت، سطح نمونه را اسکن میکنند. این نتایج در بارانی از الکترونهای ثانویه که توسط ماده براقی که سیگنالهای الکترونی تولید میکند، از سطح نمونه، جمع شده و شناسایی میگردد. سیگنالها سپس شناسایی و تقویت شده تا تصویری بر روی لامپ اشعه کاتدی ایجاد کند. مشکل این روش هزینه بالای آن، عملکرد در خلاء زیاد و نیازمند رسانایی و هدایت بالای نمونه میباشد (54).
نتیجه گیری
در حال حاضر صنایع مختلف غذایی و دارویی در حال استفاده از روش خشککن افشانی بهمنظور ریزپوشانی برخی از ترکیبات و ماده موثره و ترکیبات عملگرا همانند پروبیوتیکها میباشند. در رابطه با ریزپوشانی پروبیوتیکها توجه به بهینه بودن شرایط رشد، بهینه بودن شرایط برداشت سلول و استفاده از بهترین و سازگارترین ترکیبات دیواره با باکتری و شرایط خشککن افشانی بسیار مهم میباشد. بهینه بودن تمامی این شرایط سبب افزایش زندهمانی باکتری حین خشک کردن، طی دوره نگهداری و حین عبور از دستگاه گوارش میگردد. اگرچه حرارت و دمای بالا اغلب برای باکتریهای پروبیوتیک عامل کشنده میباشد ولی با توجه به مزایای زیاد این روش، تمایل به استفاده از آن زیاد میباشد. لازم بهذکر است که توجه به پارامترهای خشککن افشانی میتواند بر زندهمانی و عملکرد سلولهای پروبیوتیک ریزپوشانی شده، تاثیر چشمگیری داشته باشد. همواره آزمونهای خاصی بهمنظور بررسی زندهمانی و عملکرد پروبیوتیکهای ریزپوشانی شده با این روش، بر روی ریزپوشانهها انجام میگردد ولی با توجه به پیشرفت علم، دقیقترین و سریعترین روشها بهمنظور انجام این آزمونها در حال بررسی میباشند.
تعارض در منافع: وجود ندارد.
References:
1-Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et al. Expert Consensus Document: the International Scientific Association for Probiotics and Prebiotics Consensus Statement on the Scope And Appropriate Use of the Term Probiotic. Nat Rev Gastroenterol Hepatol 2014;11(8): 506-14.
2-Homayouni A, Azizi A, Ehsani M, Yarmand M, Razavi S. Effect of Microencapsulation and Resistant Starch on the Probiotic Survival and Sensory Properties of Synbiotic Ice Cream. Food Chem 2008;111: 50-55.
3-Hajipour N, Homayouni-Rad A. Response to the Paper the Effect of Prebiotics on the Viability of Encapsulated Probiotic Bacteria. LWT- Food Science and Technology 2018; 90: 606.
4-Corona Hernandez RI, Álvarez Parrilla E, Lizardi Mendoza J, Islas Rubio AR, Rosa L, Wall Medrano A, et al. Structural Stability and Viability of Microencapsulated Probiotic Bacteria: A Review. Comprehensive Rev in Food Sci Food Safety 2013; 12(6): 614-628.
5-Schuck P, Jeantet R, Bhandari B, Chen XD, Perrone ÍT, de Carvalho AF, et al. Recent Advances in Spray Drying Relevant to the Dairy Industry: A Comprehensive Critical Review. Drying Technology 2016; 34(15): 1773-90.
6-Peighambardoust S, Tafti AG, Hesari J. Application of Spray Drying for Preservation of Lactic Acid Starter Cultures: A review. Trends in Food Science & Technology 2011; 22(5): 215-24.
7-Broeckx G, Vandenheuvel D, Claes IJ, Lebeer S, Kiekens F. Drying Techniques of Probiotic Bacteria as an Important Step Towards the Development of Novel Pharmabiotics. International J Pharmaceutics 2016; 505: 303-18.
8-Santivarangkna C, Kulozik U, Foerst P. Inactivation Mechanisms of Lactic Acid Starter Cultures Preserved by Drying Processes. J Appl Microbiol 2008; 105(1): 1-13.
9-Falentin H, Deutsch S-M, Jan G, Loux V, Thierry A, Parayre S, et al. The Complete Genome of Propionibacterium Freudenreichii CIRM-BIA1T, A Hardy Actinobacterium with Food and Probiotic Applications. PloS One 2010; 5(7): e11748.
10-Sazawal S, Dhingra U, Sarkar A, Dhingra P, Deb S, Marwah D, et al. Efficacy of Milk Fortified with a Probiotic Bifidobacterium Lactis (DR-10) and Prebiotic Galacto-Oligosaccharides in Prevention of Morbidity and on Nutritional Status. Asia Pacific J Clin Nutr 2004;13: PS28-S28.
11-Kearney N, Meng X, Stanton C, Kelly J, Fitzgerald G, Ross R. Development of a Spray Dried Probiotic Yoghurt Containing Lactobacillus Paracasei NFBC 338. International Dairy J 2009; 19(11): 684-9.
12-Mille Y, Beney L, Gervais P. Compared Tolerance to Osmotic Stress Invarious Microorganisms: Towards a Survival Prediction Test. Biotechnol bioeng 2005; 92(4): 479-84.
13-Lebeer S, Vanderleyden J, De Keersmaecker SC. Genes And Molecules Of Lactobacilli Supporting Probiotic Action. Microbiol Mol Biol Rev 2008; 72(4): 728-64.
14-Zhang Y, Lin J, Zhong Q. Effects of Media, Heat Adaptation, and Outlet Temperature on the Survival of Lactobacillus Salivarius NRRL B-30514 after Spray Drying And Subsequent Storage. LWT 2016; 74: 441-7.
15-Desmond C, Ross R, O'callaghan E, Fitzgerald G, Stanton C. Improved Survival of Lactobacillus Paracasei NFBC 338 in Spray Dried Powders Containing Gum Acacia. J Appl Microbiol 2002; 93(6): 1003-11.
16-Huang S, Cauty C, Dolivet A, Le Loir Y, Chen XD, Schuck P, et al. Double Use of Highly Concentrated Sweet Whey to Improve the Biomass Production and Viability of Spray-Dried Probiotic Bacteria. J Functional Foods 2016; 23: 453-63.
17-Prasad J, McJarrow P, Gopal P. Heat and Osmotic Stress Responses of Probiotic Lactobacillus Rhamnosus HN001 (DR20) in Relation to Viability after Drying. Appl Environ Microbiol 2003; 69(2): 917-25.
18-Morgan CA, Herman N, White P, Vesey G. Preservation of Micro-Organisms by Drying; A Review. J Microbiol Method 2006; 66(2): 183-93.
19-Linders L, Meerdink G, Van ‘t Riet K. Effect of Growth Parameters on the Residual Activity of Lactobacillus Plantarum after Drying. J Appl Microbiol 1997; 82(6): 683-8.
20-Lavari L, Páez R, Cuatrin A, Reinheimer J, Vinderola G. Use of Cheese whey for Biomass Production and Spray Drying of Probiotic Lactobacilli. J Dairy Res 2014; 81(3): 267-74.
21-Carvalho AS, Silva J, Ho P, Teixeira P, Malcata FX, Gibbs P. Effects of Various Sugars Added to Growth and Drying Media upon Thermotolerance and Survival Throughout Storage of Freeze Dried Lactobacillus Delbrueckii Ssp. Bulgaricus. Biotechnol Prog 2004; 20(1): 248-54.
22-Silva J, Carvalho A, Ferreira R, Vitorino R, Amado F, Domingues P, et al. Effect of the Ph of Growth on the Survival of Lactobacillus Delbrueckii Subsp. Bulgaricus to Stress Conditions During Spray Drying. J Appl Microbiol 2005; 98(3): 775-82.
23-Baker-Austin C, Dopson M. Life in Acid: Ph Homeostasis in Acidophiles. Trends Microbiol 2007;15(4): 165-71.
24-Silva J, Carvalho A, Teixeira P, Gibbs P. Bacteriocin Production by Spray Dried Lactic Acid Bacteria. Letters in Appl Microbiol 2002; 34: 77-81.
25-Corcoran B, Ross R, Fitzgerald G, Stanton C. Comparative Survival of Probiotic Lactobacilli Spray Dried in the Presence of Prebiotic Substances. J Appl Microbiol 2004; 96(5): 1024-39.
26-Hussain I, Ahsan M, Saleem M, Ahmad A. Gene Action Studies for Agronomic Traits in Maize under Normal and Water Stress Conditions. Pak J Agri Sci 2009; 46(2): 107-12.
27-Santivarangkna C, Kulozik U, Foerst P. Alternative Drying Processes for the Industrial Preservation of Lactic Acid Starter Cultures. Biotechnol Prog 2007; 23(2): 302-15.
28-Schuck P, le Floch-Fouere C, Jeantet R. Changes in Functional Properties of Milk Protein Powders: Effects of Vacuum Concentration and Drying. Drying Technol 2013; 31(13-14): 1578-91.
29-Fu N, Woo MW, Selomulya C, Chen XD. Inactivation of Lactococcus Lactis Ssp. Cremoris Cells in a Droplet During Convective Drying. Biochem Engineer J 2013; 79: 46-56.
30-Anandharamakrishnan C, Ishawarya P. Spray Drying Techniques for Food Ingredient Encapsulation: UK. John Wiley & Sons; 2015; 72: 107-15.
31-Cal K, Sollohub K. Spray Drying Technique. I: Hardware and Process Parameters. J Pharmaceutical Sci 2010; 99(2): 575-86.
32-Patel R, Patel M, Suthar A. Spray Drying Technology: An Overview. Indian J Sci Technol 2009; 2(10): 44-7.
33-Gharsallaoui A, Roudaut G, Chambin O, Voilley A, Saurel R. Applications of Spray-Drying in Microencapsulation of food Ingredients: An overview. Food Res Inter 2007; 40(9): 1107-21.
34-Rosolen MD, Bordini FW, de Oliveira PD, Conceição FR, Pohndorf RS, Fiorentini ÂM, et al. Symbiotic Microencapsulation of Lactococcus Lactis Subsp. Lactis R7 Using whey and Inulin by Spray Drying. LWT 2019; 115: 108411.
35-Rajam R, Karthik P, Parthasarathi S, Joseph G, Anandharamakrishnan C. Effect of Whey Protein–Alginate Wall Systems on Survival of Microencapsulated Lactobacillus Plantarum in Simulated Gastrointestinal Conditions. J Functional Foods 2012; 4(4): 891-8.
36-Pérez-Chabela ML, Lara-Labastida R, Rodriguez-Huezo E, Totosaus A. Effect of Spray Drying Encapsulation of Thermotolerant Lactic Acid Bacteria on Meat Batters Properties. Food Bioprocess Technol 2013; 6: 1505-15.
37-Arslan S, Erbas M, Tontul I, Topuz A. Microencapsulation of Probiotic Saccharomyces Cerevisiae Var. Boulardii with Different Wall Materials by Spray Drying. LWT- Food Sci Technol 2015; 63(1): 685-90.
38-Bustamante M, Villarroel M, Rubilar M, Shene C. Lactobacillus Acidophilus La-05 Encapsulated by Spray Drying: Effect of Mucilage and Protein from Flaxseed (Linum Usitatissimum L.). LWT-Food Sci Technol 2015; 62(2): 1162-8.
39-Golowczyc MA, Silva J, Abraham AG, De Antoni GL, Teixeira P. Preservation of Probiotic Strains Isolated from Kefir by Spray Drying. Letters Appl Microbiol 2010; 50(1): 7-12.
40-Braber NV, Vergara LD, Rossi Y, Aminahuel C, Mauri A, Cavaglieri L, et al. Effect of Microencapsulation in Whey Protein and Water-Soluble Chitosan Derivative on the Viability of the Probiotic Kluyveromyces Marxianus VM004 During Storage and in Simulated Gastrointestinal Conditions. LWT 2020; 118: 108844.
41-Tao T, Ding Z, Hou D, Prakash S, Zhao Y, Fan Z, et al. Influence of Polysaccharide as Co-Encapsulant on Powder Characteristics, Survival and Viability of Microencapsulated Lactobacillus Paracasei Lpc-37 by Spray Drying. J Food Engineering 2019; 252: 10-7.
42-Gbassi GK, Vandamme T. Probiotic Encapsulation Technology: From Microencapsulation to Release Into the Gut. Pharmaceutics 2012; 411: 49-63.
43-Rathore S, Desai PM, Liew CV, Chan LW, Heng PWS. Microencapsulation of Microbial Cells. J Food Engineer 2013; 116: 369-81.
44-Fu N, Chen XD. Towards A Maximal Cell Survival in Convective Thermal Drying Processes. Food Res Int 2011; 44(5): 1127-49.
45-Pérez-Gago MB, Krochta JM. Lipid Particle Size Effect on Water Vapor Permeability and Mechanical Properties of whey Protein/Beeswax Emulsion Films. J Agric Food Chem 2001; 49(2): 996-1002.
46-Matsuno R, Adachi S. Lipid Encapsulation Technology-Techniques and Applications to Food. Trends in Food Sci Technol 1993; 4(8): 256-61.
47-De Castro-Cislaghi FP, Carina Dos Reis ES, Fritzen-Freire CB, Lorenz JG, Sant’Anna ES. Bifidobacterium Bb-12 Microencapsulated by Spray Drying with Whey: Survival Under Simulated Gastrointestinal Conditions, Tolerance to Nacl, and Viability During Storage. J Food Engineer 2012; 13(2): 186-193.
48-Homayouni Rad A. Therapeutical Effects of Functional Probiotic, Prebiotic and Synbiotic Foods. Tabriz: Tabriz University of Medical Sci; 2008: 146.
49-Rajam R, Anandharamakrishnan C. Microencapsulation of Lactobacillus Plantarum (MTCC 5422) with Fructooligosaccharide as Wall Material by Spray Drying. LWT-Food Sci Technol 2015; 60(2): 773-80.
50-Bustamante M, Oomah BD, Rubilar M, Shene C. Effective Lactobacillus Plantarum and Bifidobacterium Infantis Encapsulation with Chia Seed (Salvia Hispanica L.) and Flaxseed (Linum Usitatissimum L.) Mucilage and Soluble Protein by Spray Drying. Food Chem 2017; 216: 97-105.
51-Vinderola G, Binetti A, Burns P, Reinheimer J. Cell Viability And Functionality of Probiotic Bacteria in Dairy Products. Frontiers in Microbiol 2011; 2: 70.
52-Association of Official Analytical Chemists, Association of Official Agricultural Chemists (US). Official methods of analysis of the Association of Official Analytical Chemists. Association of Official Analytical Chemists; 1920.
53-Lakkis JM. Encapsulation and Controlled Release Technologies in Food Systems. UK, John Wiley & Sons; 2008; 87.
54-Pérez-Masiá R, López-Nicolás R, Periago MJ, Ros G, Lagaron JM, López-Rubio A. Encapsulation of Folic Acid in Food Hydrocolloids Through Nanospray Drying and Electrospraying for Nutraceutical Applications. Food Chem 2015; 168: 124-33
نوع مطالعه: مروری |
موضوع مقاله:
میکروبیولوژی
دریافت: 1397/12/18 | پذیرش: 1399/4/10 | انتشار: 1399/4/10
دریافت: 1397/12/18 | پذیرش: 1399/4/10 | انتشار: 1399/4/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







