دوره 28، شماره 12 - ( اسفند 1399 )
جلد 28 شماره 12 صفحات 3287-3276 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Eshaghi Z, Habibi A, Fatemi Tabatabaei S R, Goudarzi G. Effect of 6 Weeks of Aerobic Training on the Oxidative Stress Condition of Male Wistar Rats Exposed To Particulate Matter. JSSU 2021; 28 (12) :3276-3287
URL: http://jssu.ssu.ac.ir/article-1-4793-fa.html
URL: http://jssu.ssu.ac.ir/article-1-4793-fa.html
اسحاقی زهرا، حبیبی عبدالحمید، فاطمی طباطبایی سیدرضا، گودرزی غلامرضا. اثر 6 هفته تمرین هوازی بر وضعیت استرس اکسیداتیو موش های صحرایی نر در معرض ریزگردهای محیطی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (12) :3276-3287
واژههای کلیدی: تمرین هوازی، ذرات معلق، مالون دی آلدهید، سوپراکسید دیسموتاز، گلوتاتیون پراکسیداز، کاتالاز
متن کامل [PDF 892 kb]
(519 دریافت)
| چکیده (HTML) (1370 مشاهده)
متن کامل: (1016 مشاهده)
مقدمه
یکی از مشکلات جدی که امروزه در جهان با آن مواجه هستیم بحث آلودگی هوا است که طیف وسیع و متنوعی از آلایندهها را وارد اتمسفر میکند و سبب آسیب رساندن به انسان، دیگر موجودات زنده و محیط زیست میشود (1،2). یکی از مهمترین آلایندههای هوا، ذرات معلق (PM) Particulate Matter میباشد که شامل یک مخلوط ناهمگن از ذرات جامد و مایع در هوا است که بهطور مداوم از لحاظ اندازه و ترکیب شیمیایی در فضا و زمان تغییر میکند و با اثرات نامطلوب بهداشتی کوتاهمدت و طولانیمدت از جمله بیماریهای تنفسی، قلب و عروق و... همراه است (3). ذرات معلق را میتوان با قطر معادل آیرودینامیکی (AED) توصیف کرد. ذرات با قطر بیش از10 میکرومتر نیمهعمر تعلیق نسبتاً کمتری دارند و عمدتاً توسط بینی و راههای هوایی فیلتر میشوند. محققان قطر بین 2/5 تا 10 میکرومتر (PM2.5-10) را بهعنوان درشت، کمتر از 2/5 میکرومتر بهعنوان ریز و کمتر از 0.1 میکرومتر را بهعنوان ذرات فوقالعاده ریز تعریف میکنند، این دانهها میتوانند در لایههای پایینتر ریه نفوذ کرده و در نایژکها قرار گیرند و باعث کاهش اکسیژنرسانی به بافتها شوند. این ذرات برای کودکان به دلیل بالا بودن تعداد تنفس در دقیقه بسیار مضر و خطرناک است، همچنین میتواند برای زنان باردار و جنین آنها به دلیل کاهش اکسیژنرسانی مشکلات جدی ایجادکند. از سوی دیگر این ذرات میتواند با به همراه داشتن یک سری مواد حساسیت زا و فلزات سنگین و سایر آلایندهها موجب تشدید اثرات قبلی شوند. در بیماریهای روحی- روانی مانند افسردگی یا اسکیزوفرنی ردپایی از آلودگی هوا یافت میشود. همچنین آلودگی هوا میتواند علت بیماری کودکان بیشفعال باشد و حتی میتواند روی ضریب هوشی آنان اثر بگذارد (4،5). یکی از حوادث طبیعی که باعث ایجاد غلظت قابلتوجه ذرات معلق در هوا میشود، حوادث گرد و غبار است که معمولاً در مناطق خشک، نیمهخشک و یا بیابانی رخ میدهد (6). کشور ایران به دلیل واقع شدن در کمربند خشک و نیمهخشک کره زمین مکرر در معرض سیستمهای گرد و غبار محلی متعددی میباشد (7،8). خوزستان با بیش از 800 هکتار زمین بیابانی، کمبود فضای سبز و همجواری با کشور عراق از جمله استانهایی است که هر سال بهویژه در فصل تابستان با انتشار شدید گرد و غبارهایی که گاهی به بیش از 20 برابر استاندارد میرسد روبهرو میشود (9). همانطور که گفته شد آلایندههای هوایی عامل اصلی بیماری¬های مزمن (بیماریهای مزمن انسدادی ریوی Chronic obstructive pulmonary disease (COPD)، بیماری¬های قلبی عروقی (CVD)Cardiovascular disease ، آسم، سرطان) و مرگ و میر هستند که در نتیجه بر سلامت مردم تأثیر میگذارند. استرس اکسیداتیو ناشی ازآلودگی هوا، آغازگر یا عامل اصلی ایجاد آسیب در چنین بیماری¬های مزمن به حساب میآید. استرس اکسیداتیو پس از قرار گرفتن در معرض ذرات معلق باعث ایجاد یک واکنش سلولی میشود که شامل فعال شدن عوامل رونویسی و انتشار واسطه¬های التهابی است که در نهایت منجر به آسیب سلولی یا آپوپتوز میشود (10). استرس اکسیداتیو در بیماریهای التهابی (آرتروز، واسکولیت، گلومرولونفریت، لوپوس گلبولهای قرمز، سندرم بیماریهای تنفسی بزرگسالان)، بیماریهای ایسکمیک (بیماری¬های قلبی، سکته، ایسکمی روده)، هموکروماتوز، سندرم نقص ایمنی اکتسابی، فشارخون بالا، اختلال عصبی (بیماری آلزایمر، بیماری پارکینسون،دیستروفی عضلانی)، اعتیاد به الکل، بیماریهای مربوط به سیگار کشیدن و بسیاری دیگر نقش دارد، همچنین استرس اکسیداتیو منجر به اکسیداسیون چربیها وپروتئین¬ها می¬شود، که با تغییر در ساختار و عملکرد آنها همراه است (11). گونه¬های اکسیژن واکنشپذیر (ROS) reactive oxygen species مولکول¬های به شدت واکنشدهنده شامل رادیکالهای آزاد سوپر¬اکسید، هیدروکسیل و پراکسیدهیدروژن می¬باشند. افزایش پاتولوژیک آن میتواند صدماتی به پروتئینهای سلولی، غشا و DNA وارد نماید. ﺩﺭ ﺍﺛﺮ ﻋﺪﻡ ﺗﻌﺎﺩﻝ ﺑﻴﻦ ﺗﻮﻟﻴﺪ ﺷﮑﻞﻫﺎﻱ ﺍﮐﺴﻴﮋﻥ واکنش¬پذیر (ROS) ﻭ ﻋﻮﺍﻣﻞ ﺁﻧﺘﻲ¬ﺍﮐﺴﻴﺪﺍﻥ ﮐﻪ ﺳﺒﺐ ﺣﺬﻑ ROS ﻣﻲﺷﻮﺩ، ﺍﺳﺘﺮﺱ-ﺍﮐﺴﻴﺪﺍﺗﻴﻮ ﺑﻪﻭﺟﻮﺩ ﻣﻲﺁﻳﺪ (12). گونههای فعال اکسیژن توسط سیستمی در داخل بدن که تحتعنوان سیستم ضد¬اکسایشی شناخته میشود خنثی میشوند. این سیستم شامل آنزیمهای ضداکسایشی همچون کاتالاز (CAT) catalase، سوپراکسیددسموتاز ((SOD Superoxide dismutase و گلوتاتیون پراکسیداز (GPX) Glutathione peroxidas میباشد (13). فلزات واسطه موجود در ریزگردهای محیطی، باعث ایجاد استرس¬اکسیداتیو می¬شوند بدین طریق که با ایجاد التهاب باعث تولید گونه¬های اکسیژن فعال (ROS) از فاگوسیت¬ها می¬شود. چندین آزمایش و مطالعات انسانی نشان داده است که افزایش سطح آلودگی هوا موجب آزادسازی رادیکالهای آزاد، بهخصوص اکسیژن واکنشپذیر به صورت سیستمیک یا در اندام¬های مختلف میشود (14). علاوه بر این که استرس¬اکسیداتیو از فعال شدن سلول¬های التهابی ایجاد میشود، ممکن است بهطور مستقیم از سطح ذرات نیز تولید شود (15). در دهه¬های اخیر محققین بهدنبال راهکارهای مناسب برای مهار آثار زیانبار آلودگی هوا بر دستگاههای بدن بهویژه دستگاههای با دفاع ضد اکسایشی ضعیف بودند. پژوهش در زمینه انجام فعالیت¬های منظم بدنی به دلیل آثار تأیید شدهای که برتقویت دستگاه ضد اکسایشی بدن دارد، مورد توجه محققان بوده است. در همین راستا تحقیقات فراوانی جهت تعیین میزان مواد آنتیاکسیدان تولید شده در بدن، درپی فعالیت های ورزشی مختلف انجام شده است. پینهو در مطالعهای ۱۲ هفتهای روی موش¬های ویستار، نوعی سازگاری با تمرین را در مقابل فعالیت اکسایشی مشاهده کرد (16). در حالیکه در تحقیق دیگری که در آن ورزشکاران تحت تمرین-های منظم قرار داشتند، تفاوت معنیداری در میزان فعالیت آنزیمهای آنتیاکسیدانی پلاسما در مقایسه با گروه کنترل گزارش نشد (17)، وینسنت نیز در تحقیقی بر روی موش¬های اسپراگ، اثر ۵ روز دویدن با ۶۵% حداکثر اکسیژن مصرفی را بر میزان فعالیت آنزیم¬های آنتیاکسیدانی بررسی و مشاهده کرد که این نوع تمرین، فعالیت CAT و SOD را بهترتیب ۲۴ و ۲۰% افزایش میدهد (18). مینیی و همکاران در سال ۲۰۰۷ مشاهده کردند که با این که تمرینات هوازی نیاز به مصرف اکسیژن بیشتری نسبت به تمرینات بیهوازی ایجاد میکند، اما تولید گونه های رادیکال آزاد در این نوع تمرینات به نسبت کمتر است (19). بهنظر میرسد شدت، مدت و نوع تمرینات آثار متفاوتی بر فعالیت ضداکسایشی داشته باشد. همچنین دیده شد که به دنبال انجام تمرینات ورزشی، سیستم دفاع سلول سعی در برقراری تعادل و یا افزایش آنزیمهای آنتیاکسیدانی در مقابل فشار اکسیداتیو دارد. در نتیجه، تمرینات ورزشی منظم و مستمر افراد را در مقابل فشار اکسیداتیو مقاومتر ساخته و زندگی سالمتری را تأمین میکند. بنابراین با توجه به اثرات مخرب ریزگردهای موجود در هوا بر سلامتی انسان و همچنین با توجه به موارد مذکور و تاثیر ورزش در سلامت بدن و بهبود شرایط فیزیولوژیک و با توجه به اینکه در استان خوزستان تاکنون تحقیقات پایه در ارتباط با اثرات ریزگردهای موجود در هوا و ارتباط آن با نقش ورزش انجام نگرفته است، لذا پژوهش حاضر بهدنبال پاسخ به این سوال است که آیا تمرینات هوازی بر وضعیت استرس اکسیداتیو موش¬های صحرایی نر در معرض ریزگردهای محیطی اثر دارد یا خیر؟
روش بررسی
این تحقیق از نوع تجربی-آزمایشگاهی بود که در پژوهش حاضر، 32 سر رت نر بالغ 10 هفتهای با میانگین وزن (8/5 ±۲4۵گرم) استفاده شد. موش¬ها پس از انتقال به آزمایشگاه جوندگان بهمدت یک هفته به منظور سازگاری با محیط نگهداری شدند. این حیوانات پس از آشنایی با نحوه فعالیت روی نوار گردان بهصورت تصادفی به چهار گروه تقسیم شدند که عبارت از: گروه کنترل (سرم فیزیولوژی)، تمرین هوازی، دریافتکننده ریزگردهای محیط، تمرین هوازی+ دریافتکننده ریزگردهای محیطی (هر گروه شامل 8 سر موش). تمام حیوانات طی دوره پژوهش بهصورت گروههای چهار سرموش در قفسهای پلیکربنات شفاف در محیطی با دمای 20 تا 22 درجۀ سانتیگراد در شرایط 12 ساعت روشنایی و 12 ساعت تاریکی با رطوبت نسبی 55-45 درصد نگهداری شدند. همچنین، کلیه گروه¬ها به صورت آزاد به آب و غذا دسترسی داشتند.
زمان و محل نمونهبرداری ریزگرد
نمونهبرداری برای مطالعه حاضر در شهر اهواز صورت گرفت، این شهر در یک منطقه خشک واقع در جنوب غرب ایران در استان خوزستان بوده که از جمله خصوصیات این منطقه میتوان به پوشش گیاهی پایین، بادهای سطحی قوی و نیز دما و رطوبت بسیار بالا اشاره کرد. در پیرامون این منطقه (خصوصاً در غرب آن و در کشورهایی چون عراق و عربستان) بیابانهای وسیعی وجود دارد که بهعنوان منابع اصلی وقوع پدیده گرد و غبار شناسایی شدهاند (14،20). در زمان وقوع گرد¬ و غبار به روش نمونهبرداری دستی از روی سطوح صاف نظیر شیشه ماشین¬ها یا پشت بام نسبت به جمع¬آوری غبار اقدام گردید. 5 گرم از این گرد و غبار درون بمب تفلونی ریخته شد و در حرارت ملایم توسط اسید کلریدریک و اسید فلوریدریک هضم گردید. عصاره حاصل توسط دستگاه جذب اتمی یا ICP بهمنظور تعیین غلظت فلزات سنگین شامل کروم، کادمیوم، سرب، نیکل و... مورد استفاده قرار¬گرفت، که نتایج حاصل از آن در جدول 1 قرار دارد.
جدول1: میزان غلظت فلزات کادمیوم، کبالت، کرم، نیکل، سرب، روی و آلومینیم (ug/kg) در ذرات معلق موجود در هوای اهواز

پروتکل تزریق ریزگردها بهمدت 6 هفته و هفته¬ای 5 جلسه اجرا شد. برای تهیه محلول ریزگردها، ابتدا 100 میلیگرم از ذرات با ترازوی با دقت 0/001 وزن شد و در ظرف مدرج قرار داده شد، سپس حجم محلول با سرم فیزیولوژی به تدریج تا 10 سیسی رقیق شد و به صورت سوسپانسیون تهیه گردید، سپس بهوسیله میکروپیپت 30 میکرولیتر به ازای هر موش برداشته شد و در دو گروه دریافتکننده ریزگردها و گروه تمرین+ دریافتکننده ریزگردها از طریق سوراخ بینی به موشها تجویز گردید (21). قبل از اجرای پروتکل تمرینی، موشها بهمدت یک هفته با نحوه انجام فعالیت روی نوار گردان آشنا شدند. برنامه آشنایی شامل 5 جلسه راه رفتن و دویدن با سرعت 5 تا 8 متر در دقیقه و شیب صفر درصد و به مدت 5 الی 10 دقیقه بود. سپس در پایان هفته اول، آزمون حداکثر توان فردی با یک گرم کردن 5 دقیقهای (سرعت 10 متر بر دقیقه) آغاز و سپس به ازای هر دقیقه، یک متر بر دقیقه به سرعت نوارگردان افزوده شد، تا زمانی که موشها بعد از 3 محرک مکانیکی قادر به انجام داوطلبانه نبودند. حداکثر ظرفیت تمرین (100 %) بهعنوان حداکثر سرعت هر حیوان تعیین شد، موشها با شدت کم،50% از حداکثر سرعت اولیه بهدست آمده در تست ورزش، با میانگین سرعت بار گروهی به تمرین پرداختند. آزمون حداکثر توان در پایان تمام هفتهها تکرارشد (21،22). این برنامه بهمدت 6 هفته و هر هفته نیز در 5 جلسه اجرا شد. برای گرم کردن نیز موشها در ابتدای هر جلسه تمرینی بهمدت 3 دقیقه با سرعت 8 متر بر دقیقه دویدند، سپس بهطور تدریجی تا رسیدن بهسرعت مورد نظر بر سرعت تردمیل افزوده شد. برای سردکردن در انتهای هر جلسه تمرینی سرعت نوارگردان بهصورت معکوس کاهش یافت تا به سرعت اولیه برسد. کل برنامه تمرینی روی نوارگردان بدون شیب انجام شد. از تمامی گروهها 24 ساعت پس از آخرین جلسه تمرین نمونهگیری به عمل آمد، در ابتدا پس از بیهوشی حیوانات توسط مخلوط داروی کتامین و زایلازین هیدروکلراید به ترتیب 100 و 10 میلی گرم به ازای هر کیلوگرم وزن بدن از طریق داخل صفاقی، در همه گروهها تزریق شد. پس از بیهوشی، با تشریح حیوان نمونههای خون مستقیماً از ﻗﻠﺐ موشها ﺟﻤﻊآوری ﺷﺪ. نمونههای سرم ﭘﺲ از سانتریفیوژ با 3000 دور در دﻗﻴﻘﻪ ﺑﻪ ﻣﺪت 15دﻗﻴﻘﻪ ﺑﻪ آزمایشگاه منتقل شدند. در این مطالعه MDA براساس میزان تولید مواد واکنشگر با تیوباربیتوریک اسید و بر اساس روش شرح داده شده به وسیله Ohkawa و همکاران اندازهگیری شد (23). سنجش فعالیت سوپر¬اکسید¬دیسموتاز (SOD) براساس مهار احیا نیترو بلوتترازولیوم توسط سیستم گزانتینگزانتیناکسیداز بهعنوان تولیدکننده سوپر¬اکسید میباشد. جذب نوری هر نمونه در طول موج نوری ۵۵۰ نانومتر به مدت ۵ دقیقه هر ۳۰ ثانیه یک بار خوانده شد. برای به دست آوردن درصد مهار احیا نیتروبلوتترازولیوم توسط آنزیم SOD، از فرمول مربوط به دستورالعمل کیت رندوکس (rendox)استفاده شد (24). برای سنجش فعالیت گلوتاتیون پراکسیداز (GPX) از کیت رندوکس انگلستان (rendox) استفاده شد. آنزیم GPX در حضور کومنهیدروپراکسید سبب تسریع در اکسیداسیون گلوتاتیون می¬شود. حال درصورت حضور آنزیم گلوتاتیون¬ردوکتاز و نیکوتین¬آمید دی نوکلئوتید فسفات (NADPH)، گلوتاتیون-اکسید شده سریعاً احیا و NADPH به +NADP تبدیل می¬شود. میزان حضور آنزیم GPX با اندازهگیری میزان کاهش رنگ ایجاد شده در طول موج ۳۴۰ نانومتر اشعه فرابنفش طی ۲ دقیقه قرائت شد (24). همچنین برای سنجش CAT براساس روش Koroluk و همکاران اندازهگیری شد (25).
تجزیه و تحلیل آماری
برای محاسبه و تجزیه و تحلیل آماری اطلاعات خام از نرمافزارversion 16 SPSS و برای ترسیم نمودار از نرمافزار Excel استفاده شد. همچنین سطح معنیداری برای تمام روش¬های آماری در سطح احتمال (05/0≤ P) در نظرگرفته شد. برای تعیین توزیع طبیعی دادهها از آزمون شاپیروویلک در سطح معنی¬داری (05/0P ≥) استفاده شد. همچنین برای تجزیه و تحلیل آماری از روش ANOVA یک طرفه و آزمونهای تعقیبی LSD استفاده شد.
ملاحظات اخلاقی
این تحقیق با (کد کمیته اخلاقEE/97.24.3.70352/ scu.ac.ir) در دانشگاه شهید چمران اهواز تایید و انجام شد.
نتاج
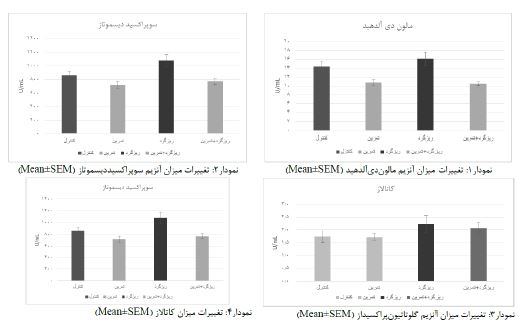
نتایج حاصل از تجزیه و تحلیل داده¬ها در نمودارهای 1 تا 4 نشان داده شده است. نتایج آزمون تعقیبی LSD (جدول 2) نشان داد که پس از 6 هفته تمرین هوازی میزان میانگین غلظت MDA در هر دو گروه تمرین و گروه ترکیبی تمرین و دریافتکننده ریزگردها نسبت به گروه کنترل کاهش معناداری داشته است (p≤ 0/05). غلظت MDA اگر چه در گروه دریافتکننده ریگردها افزایش داشته است اما این افزایش نسبت به گروه کنترل معنادار نبود (P ≥0/05). همچنین دو گروه تمرین و تمرین+ریزگرد نسبت بهگروه آلودگی کاهش معناداری در میزان MDA نشان دادهاند (p≤ 0/05). اما بین دو گروه تمرین و تمرین+ریزگرد تفاوت معنادار نبود (P ≥0/05). میزان میانگین غلظت SOD در دو گروه تمرین و گروه ترکیبی تمرین و دریافتکننده ریزگردها نسبت بهگروه کنترل تفاوت معناداری نداشت. اما میزان این آنزیم در گروه دریافتکننده ریزگردها نسبت به گروه کنترل افزایش معناداری نشان داده است (p≤ 0/05). همچنین گروه دریافتکننده ریزگردها نسبت به دو گروه تمرین و گروه ترکیبی تمرین و ریزگرد افزایش معناداری در غلظت SOD نشان داده است (p≤ 0/05). بین دو گروه تمرین و تمرین+ریزگرد تفاوت معنادار نبود (P ≥0/05)). نتایج حاصل از آزمون تحلیل واریانس یک راهه نشانداد بین هیچیک از گروههای تحقیق در غلظت آنزیم¬های GPX و CAT تفاوت معناداری وجود نداشته است (P ≥0/05)).
جدول2: نتایج تحلیل واریانس یک¬راهه و آزمون تعقیبی LSD در سطوح MDA، SOD، GPX، CAT پس از 6 هفته تمرین هوازی در رتهای در معرض ریزگردهای محیطی

بحث
در مطالعه حاضر به بررسی اثر 6 هفته تمرین هوازی بر وضعیت استرس اکسیداتیو خون موشهای صحرایی نر در معرض ریگردهای محیطی پرداخته شده است. در مطالعه دئول و همکاران در سال 2012 که بر روی موشهای صحرایی نر نژاد ویستار انجام گرفت مشاهده شد که ریزگردها باعث افزایش بیان سوپراکسید دیسموتاز، کاهش بیان نیتریکاکساید و کاهش اتساع عروقی میشود (26). رادمنش و همکاران (1393) در مطالعهای اثر ریزگردهای محیطی به تنهایی و همزمان با وانیلیکاسید بر ویژگیهای الکتروفیزیولوژیک، پارامترهای همودینامیک و استرساکسیداتیو ناشی از ریزگردها در قلب موش صحرائی نر را بررسی کردند، که نتایج آنها افزایش در پراکسیداسیون لیپیدی را در اثر دریافت ریزگردها نشان داد (27). در مطالعه امیلی و همکاران نیز که در سال 2006 بر روی موشها انجام گرفت دیده شد تزریق اینتراتراکئال ریزگردها باعث افزایش سطح استرساکسیداتیو میشود که این نتایج همسو با تحقیق حاضر میباشد (28). شواهد علمی محکمی وجود دارد که نشان میدهد یک شیوه زندگی فعال، تولید ROS را کاهش میدهد (29). کاهش استرساکسیداتیو احتمالاً از طریق بهبود دفاع آنتیاکسیدانی و یا کاهش تشکیل گونههای واکنشپذیر، مکانیسمی است که از طریق آن فعالیت بدنی میتواند خطر بیمارهای مزمن را کاهشدهد (30). انجـام فعالیتهای منظم بدنی بهدلیل آثار تأیید شدهای که برتقویت دستگاه ضد اکسایشی بدن دارد، مورد توجه محققان در سراسر دنیا بوده است. ورزش هوازی اگر به صورت منظم انجام گیرد میتواند استرساکسیداتیو را بهطور سیستماتیک در بیماریهای مختلف مانند بیماری¬های قلبی، دیابت نوع 2، آرتریت روماتوئید و بیماریهای آلزایمر و پارکینسون کاهش دهد (31)، ورزش منظم میتواند باعث جلوگیری از پراکسیداسیون لیپید و افزایش میزان آنتیاکسیدانها شود (32،33،34). 6 هفته تمرین هوازی توانست میزان پراکسیداسیون لیپیدی ناشی از تجویز ریزگردها را بهطور معناداری کاهش دهد. این نتایج با تحقیق حبیبان و همکاران (1392) همسو میباشد آنها در مطالعهای اثر حمایتی تمرینهوازی بر استرساکسیداتیو ناشی از سرب در مخچه موش صحرایی را مورد بررسی قرار دادند، که تیمار مزمن با استات سرب سطوح MDA مخچهای را در موشها افزایش داد، اما اثر متقابل تمرین هوازی و استات سرب سطوح MDA را کاهش داد (35). همچنین در مطالعات، پارکس و همکاران (2016)، پریرار و همکاران (2016) و اعظمیان جزی و همکاران (1395) (36،37،38) نشان دادند که تمرینات منظم هوازی تاثیر مثبت و معناداری بر کاهش سطوح مالوندیآلدهید دارد که با تحقیق ما همسو میباشند. ماروسی و همکاران در سال 2012 تحقیقی با عنوان تاثیر تمرینات بلند مدت هوازی بر کاهش استرساکسیداتیو در هیپوکمپ موشهای سالم را بررسی کردند. که نتایج این تحقیق نشان داد ورزش موجب تنظیم مقادیر آنزیهای SOD و GPX، میشود (39). مطالعات نشان داده تمرین استقامتی بـا افـزایش فعالیت آنزیمهای CAT وGPX فشار اکسایشی را در عـضلات اسکلتی و سایر بافتهای بدن کاهش میدهد (40،41). این درحالی است که در تحقیق حاضر با وجود تغییرات جزئی در میزان آنزیمهای GPX و CAT این تغییرات معنادار نبود. علت عدم تغییر میزان فعالیت آنزیمهای آنتیاکسیدانی بهدنبال تمرین هوازی در این تحقیق را میتوان توسط چند عامل توجیه کرد. این احتمال وجود دارد که شدت تمرین به کارگرفته شده، درحدی نبوده است که میزان تولید گونههای اکسیژن فعال را افزایش داده باشد (42،43). از طرف دیگر، این احتمال وجود دارد که انجام تمرینات منظم با شدتهای کم، سبب ایجاد سازگاری در سیستم ضد اکسایشی بدن شود (44). از این رو میتوان گفت که میزان طبیعی آنزیمهای آنتیاکسیدانی، پاسخگوی مقابله با رادیکالهای تولید شده در اثر این نوع تمرین بودهاند، که میتواند توجیه مناسبی برای عدم تغییر در فعالیت این آنزیمها به حساب آید. همچنین علت عدم تغییر در میزان فعالیت آنزیم GPX میتواند به این علت باشد که آنزیم GPX آخرین آنزیمی است که وارد واکنشهای ضد اکسایشی میشود (45). بهطورکلی، نوع تمرین (مدت و شدت) و بافتی که برای تحقیق به کار گرفته میشود، تأثیر زیادی در نتایج تحقیق دارد.
نتیجهگیری
با توجه به این که آزمودنیها، موشهای آلوده به ریزگردها محیطی، سطوح بالای پراکسیداسیونلیپیدی و دفاع آنتیاکسیدانی پایینتری را نسبت به سایر گروهها نشان دادند. به نظر میرسد 6 هفته تمرینات هوازی موجب کاهش سطوح مالوندیآلدهید میشود و میتواند استرس اکسایشی را کاهش دهد. عدم تغییر در فعالیت آنزیمهای آنتیاکسیدانی، میتواند بهدلیل پایین بودن شدت تمرین و عدم تولید رادیکالهای آزاد بوده باشد. بنابراین میتوان بیان داشت که تمرین هوازی منظم میتواند بهعنوان یک راهبرد درمانی و حمایتی برای افزایش مقاومت در برابر استرس اکسیداتیو ناشی از آلایندههای محیطی عمل کند. هرچند که نکات متعددی دراین ارتباط وجود دارد و در آینده باید مورد مطالعه قرار گیرد.
سپاسگزاری
بدینوسیله از تمامی کسانی که مرا در انجام این تحقیق یاری نمودهاند تشکر میکنم، این مطالعه حاصل پایاننامه ارشد، مصوب دانشگاه شهید چمران اهواز میباشد.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد
یکی از مشکلات جدی که امروزه در جهان با آن مواجه هستیم بحث آلودگی هوا است که طیف وسیع و متنوعی از آلایندهها را وارد اتمسفر میکند و سبب آسیب رساندن به انسان، دیگر موجودات زنده و محیط زیست میشود (1،2). یکی از مهمترین آلایندههای هوا، ذرات معلق (PM) Particulate Matter میباشد که شامل یک مخلوط ناهمگن از ذرات جامد و مایع در هوا است که بهطور مداوم از لحاظ اندازه و ترکیب شیمیایی در فضا و زمان تغییر میکند و با اثرات نامطلوب بهداشتی کوتاهمدت و طولانیمدت از جمله بیماریهای تنفسی، قلب و عروق و... همراه است (3). ذرات معلق را میتوان با قطر معادل آیرودینامیکی (AED) توصیف کرد. ذرات با قطر بیش از10 میکرومتر نیمهعمر تعلیق نسبتاً کمتری دارند و عمدتاً توسط بینی و راههای هوایی فیلتر میشوند. محققان قطر بین 2/5 تا 10 میکرومتر (PM2.5-10) را بهعنوان درشت، کمتر از 2/5 میکرومتر بهعنوان ریز و کمتر از 0.1 میکرومتر را بهعنوان ذرات فوقالعاده ریز تعریف میکنند، این دانهها میتوانند در لایههای پایینتر ریه نفوذ کرده و در نایژکها قرار گیرند و باعث کاهش اکسیژنرسانی به بافتها شوند. این ذرات برای کودکان به دلیل بالا بودن تعداد تنفس در دقیقه بسیار مضر و خطرناک است، همچنین میتواند برای زنان باردار و جنین آنها به دلیل کاهش اکسیژنرسانی مشکلات جدی ایجادکند. از سوی دیگر این ذرات میتواند با به همراه داشتن یک سری مواد حساسیت زا و فلزات سنگین و سایر آلایندهها موجب تشدید اثرات قبلی شوند. در بیماریهای روحی- روانی مانند افسردگی یا اسکیزوفرنی ردپایی از آلودگی هوا یافت میشود. همچنین آلودگی هوا میتواند علت بیماری کودکان بیشفعال باشد و حتی میتواند روی ضریب هوشی آنان اثر بگذارد (4،5). یکی از حوادث طبیعی که باعث ایجاد غلظت قابلتوجه ذرات معلق در هوا میشود، حوادث گرد و غبار است که معمولاً در مناطق خشک، نیمهخشک و یا بیابانی رخ میدهد (6). کشور ایران به دلیل واقع شدن در کمربند خشک و نیمهخشک کره زمین مکرر در معرض سیستمهای گرد و غبار محلی متعددی میباشد (7،8). خوزستان با بیش از 800 هکتار زمین بیابانی، کمبود فضای سبز و همجواری با کشور عراق از جمله استانهایی است که هر سال بهویژه در فصل تابستان با انتشار شدید گرد و غبارهایی که گاهی به بیش از 20 برابر استاندارد میرسد روبهرو میشود (9). همانطور که گفته شد آلایندههای هوایی عامل اصلی بیماری¬های مزمن (بیماریهای مزمن انسدادی ریوی Chronic obstructive pulmonary disease (COPD)، بیماری¬های قلبی عروقی (CVD)Cardiovascular disease ، آسم، سرطان) و مرگ و میر هستند که در نتیجه بر سلامت مردم تأثیر میگذارند. استرس اکسیداتیو ناشی ازآلودگی هوا، آغازگر یا عامل اصلی ایجاد آسیب در چنین بیماری¬های مزمن به حساب میآید. استرس اکسیداتیو پس از قرار گرفتن در معرض ذرات معلق باعث ایجاد یک واکنش سلولی میشود که شامل فعال شدن عوامل رونویسی و انتشار واسطه¬های التهابی است که در نهایت منجر به آسیب سلولی یا آپوپتوز میشود (10). استرس اکسیداتیو در بیماریهای التهابی (آرتروز، واسکولیت، گلومرولونفریت، لوپوس گلبولهای قرمز، سندرم بیماریهای تنفسی بزرگسالان)، بیماریهای ایسکمیک (بیماری¬های قلبی، سکته، ایسکمی روده)، هموکروماتوز، سندرم نقص ایمنی اکتسابی، فشارخون بالا، اختلال عصبی (بیماری آلزایمر، بیماری پارکینسون،دیستروفی عضلانی)، اعتیاد به الکل، بیماریهای مربوط به سیگار کشیدن و بسیاری دیگر نقش دارد، همچنین استرس اکسیداتیو منجر به اکسیداسیون چربیها وپروتئین¬ها می¬شود، که با تغییر در ساختار و عملکرد آنها همراه است (11). گونه¬های اکسیژن واکنشپذیر (ROS) reactive oxygen species مولکول¬های به شدت واکنشدهنده شامل رادیکالهای آزاد سوپر¬اکسید، هیدروکسیل و پراکسیدهیدروژن می¬باشند. افزایش پاتولوژیک آن میتواند صدماتی به پروتئینهای سلولی، غشا و DNA وارد نماید. ﺩﺭ ﺍﺛﺮ ﻋﺪﻡ ﺗﻌﺎﺩﻝ ﺑﻴﻦ ﺗﻮﻟﻴﺪ ﺷﮑﻞﻫﺎﻱ ﺍﮐﺴﻴﮋﻥ واکنش¬پذیر (ROS) ﻭ ﻋﻮﺍﻣﻞ ﺁﻧﺘﻲ¬ﺍﮐﺴﻴﺪﺍﻥ ﮐﻪ ﺳﺒﺐ ﺣﺬﻑ ROS ﻣﻲﺷﻮﺩ، ﺍﺳﺘﺮﺱ-ﺍﮐﺴﻴﺪﺍﺗﻴﻮ ﺑﻪﻭﺟﻮﺩ ﻣﻲﺁﻳﺪ (12). گونههای فعال اکسیژن توسط سیستمی در داخل بدن که تحتعنوان سیستم ضد¬اکسایشی شناخته میشود خنثی میشوند. این سیستم شامل آنزیمهای ضداکسایشی همچون کاتالاز (CAT) catalase، سوپراکسیددسموتاز ((SOD Superoxide dismutase و گلوتاتیون پراکسیداز (GPX) Glutathione peroxidas میباشد (13). فلزات واسطه موجود در ریزگردهای محیطی، باعث ایجاد استرس¬اکسیداتیو می¬شوند بدین طریق که با ایجاد التهاب باعث تولید گونه¬های اکسیژن فعال (ROS) از فاگوسیت¬ها می¬شود. چندین آزمایش و مطالعات انسانی نشان داده است که افزایش سطح آلودگی هوا موجب آزادسازی رادیکالهای آزاد، بهخصوص اکسیژن واکنشپذیر به صورت سیستمیک یا در اندام¬های مختلف میشود (14). علاوه بر این که استرس¬اکسیداتیو از فعال شدن سلول¬های التهابی ایجاد میشود، ممکن است بهطور مستقیم از سطح ذرات نیز تولید شود (15). در دهه¬های اخیر محققین بهدنبال راهکارهای مناسب برای مهار آثار زیانبار آلودگی هوا بر دستگاههای بدن بهویژه دستگاههای با دفاع ضد اکسایشی ضعیف بودند. پژوهش در زمینه انجام فعالیت¬های منظم بدنی به دلیل آثار تأیید شدهای که برتقویت دستگاه ضد اکسایشی بدن دارد، مورد توجه محققان بوده است. در همین راستا تحقیقات فراوانی جهت تعیین میزان مواد آنتیاکسیدان تولید شده در بدن، درپی فعالیت های ورزشی مختلف انجام شده است. پینهو در مطالعهای ۱۲ هفتهای روی موش¬های ویستار، نوعی سازگاری با تمرین را در مقابل فعالیت اکسایشی مشاهده کرد (16). در حالیکه در تحقیق دیگری که در آن ورزشکاران تحت تمرین-های منظم قرار داشتند، تفاوت معنیداری در میزان فعالیت آنزیمهای آنتیاکسیدانی پلاسما در مقایسه با گروه کنترل گزارش نشد (17)، وینسنت نیز در تحقیقی بر روی موش¬های اسپراگ، اثر ۵ روز دویدن با ۶۵% حداکثر اکسیژن مصرفی را بر میزان فعالیت آنزیم¬های آنتیاکسیدانی بررسی و مشاهده کرد که این نوع تمرین، فعالیت CAT و SOD را بهترتیب ۲۴ و ۲۰% افزایش میدهد (18). مینیی و همکاران در سال ۲۰۰۷ مشاهده کردند که با این که تمرینات هوازی نیاز به مصرف اکسیژن بیشتری نسبت به تمرینات بیهوازی ایجاد میکند، اما تولید گونه های رادیکال آزاد در این نوع تمرینات به نسبت کمتر است (19). بهنظر میرسد شدت، مدت و نوع تمرینات آثار متفاوتی بر فعالیت ضداکسایشی داشته باشد. همچنین دیده شد که به دنبال انجام تمرینات ورزشی، سیستم دفاع سلول سعی در برقراری تعادل و یا افزایش آنزیمهای آنتیاکسیدانی در مقابل فشار اکسیداتیو دارد. در نتیجه، تمرینات ورزشی منظم و مستمر افراد را در مقابل فشار اکسیداتیو مقاومتر ساخته و زندگی سالمتری را تأمین میکند. بنابراین با توجه به اثرات مخرب ریزگردهای موجود در هوا بر سلامتی انسان و همچنین با توجه به موارد مذکور و تاثیر ورزش در سلامت بدن و بهبود شرایط فیزیولوژیک و با توجه به اینکه در استان خوزستان تاکنون تحقیقات پایه در ارتباط با اثرات ریزگردهای موجود در هوا و ارتباط آن با نقش ورزش انجام نگرفته است، لذا پژوهش حاضر بهدنبال پاسخ به این سوال است که آیا تمرینات هوازی بر وضعیت استرس اکسیداتیو موش¬های صحرایی نر در معرض ریزگردهای محیطی اثر دارد یا خیر؟
روش بررسی
این تحقیق از نوع تجربی-آزمایشگاهی بود که در پژوهش حاضر، 32 سر رت نر بالغ 10 هفتهای با میانگین وزن (8/5 ±۲4۵گرم) استفاده شد. موش¬ها پس از انتقال به آزمایشگاه جوندگان بهمدت یک هفته به منظور سازگاری با محیط نگهداری شدند. این حیوانات پس از آشنایی با نحوه فعالیت روی نوار گردان بهصورت تصادفی به چهار گروه تقسیم شدند که عبارت از: گروه کنترل (سرم فیزیولوژی)، تمرین هوازی، دریافتکننده ریزگردهای محیط، تمرین هوازی+ دریافتکننده ریزگردهای محیطی (هر گروه شامل 8 سر موش). تمام حیوانات طی دوره پژوهش بهصورت گروههای چهار سرموش در قفسهای پلیکربنات شفاف در محیطی با دمای 20 تا 22 درجۀ سانتیگراد در شرایط 12 ساعت روشنایی و 12 ساعت تاریکی با رطوبت نسبی 55-45 درصد نگهداری شدند. همچنین، کلیه گروه¬ها به صورت آزاد به آب و غذا دسترسی داشتند.
زمان و محل نمونهبرداری ریزگرد
نمونهبرداری برای مطالعه حاضر در شهر اهواز صورت گرفت، این شهر در یک منطقه خشک واقع در جنوب غرب ایران در استان خوزستان بوده که از جمله خصوصیات این منطقه میتوان به پوشش گیاهی پایین، بادهای سطحی قوی و نیز دما و رطوبت بسیار بالا اشاره کرد. در پیرامون این منطقه (خصوصاً در غرب آن و در کشورهایی چون عراق و عربستان) بیابانهای وسیعی وجود دارد که بهعنوان منابع اصلی وقوع پدیده گرد و غبار شناسایی شدهاند (14،20). در زمان وقوع گرد¬ و غبار به روش نمونهبرداری دستی از روی سطوح صاف نظیر شیشه ماشین¬ها یا پشت بام نسبت به جمع¬آوری غبار اقدام گردید. 5 گرم از این گرد و غبار درون بمب تفلونی ریخته شد و در حرارت ملایم توسط اسید کلریدریک و اسید فلوریدریک هضم گردید. عصاره حاصل توسط دستگاه جذب اتمی یا ICP بهمنظور تعیین غلظت فلزات سنگین شامل کروم، کادمیوم، سرب، نیکل و... مورد استفاده قرار¬گرفت، که نتایج حاصل از آن در جدول 1 قرار دارد.
جدول1: میزان غلظت فلزات کادمیوم، کبالت، کرم، نیکل، سرب، روی و آلومینیم (ug/kg) در ذرات معلق موجود در هوای اهواز

پروتکل تزریق ریزگردها بهمدت 6 هفته و هفته¬ای 5 جلسه اجرا شد. برای تهیه محلول ریزگردها، ابتدا 100 میلیگرم از ذرات با ترازوی با دقت 0/001 وزن شد و در ظرف مدرج قرار داده شد، سپس حجم محلول با سرم فیزیولوژی به تدریج تا 10 سیسی رقیق شد و به صورت سوسپانسیون تهیه گردید، سپس بهوسیله میکروپیپت 30 میکرولیتر به ازای هر موش برداشته شد و در دو گروه دریافتکننده ریزگردها و گروه تمرین+ دریافتکننده ریزگردها از طریق سوراخ بینی به موشها تجویز گردید (21). قبل از اجرای پروتکل تمرینی، موشها بهمدت یک هفته با نحوه انجام فعالیت روی نوار گردان آشنا شدند. برنامه آشنایی شامل 5 جلسه راه رفتن و دویدن با سرعت 5 تا 8 متر در دقیقه و شیب صفر درصد و به مدت 5 الی 10 دقیقه بود. سپس در پایان هفته اول، آزمون حداکثر توان فردی با یک گرم کردن 5 دقیقهای (سرعت 10 متر بر دقیقه) آغاز و سپس به ازای هر دقیقه، یک متر بر دقیقه به سرعت نوارگردان افزوده شد، تا زمانی که موشها بعد از 3 محرک مکانیکی قادر به انجام داوطلبانه نبودند. حداکثر ظرفیت تمرین (100 %) بهعنوان حداکثر سرعت هر حیوان تعیین شد، موشها با شدت کم،50% از حداکثر سرعت اولیه بهدست آمده در تست ورزش، با میانگین سرعت بار گروهی به تمرین پرداختند. آزمون حداکثر توان در پایان تمام هفتهها تکرارشد (21،22). این برنامه بهمدت 6 هفته و هر هفته نیز در 5 جلسه اجرا شد. برای گرم کردن نیز موشها در ابتدای هر جلسه تمرینی بهمدت 3 دقیقه با سرعت 8 متر بر دقیقه دویدند، سپس بهطور تدریجی تا رسیدن بهسرعت مورد نظر بر سرعت تردمیل افزوده شد. برای سردکردن در انتهای هر جلسه تمرینی سرعت نوارگردان بهصورت معکوس کاهش یافت تا به سرعت اولیه برسد. کل برنامه تمرینی روی نوارگردان بدون شیب انجام شد. از تمامی گروهها 24 ساعت پس از آخرین جلسه تمرین نمونهگیری به عمل آمد، در ابتدا پس از بیهوشی حیوانات توسط مخلوط داروی کتامین و زایلازین هیدروکلراید به ترتیب 100 و 10 میلی گرم به ازای هر کیلوگرم وزن بدن از طریق داخل صفاقی، در همه گروهها تزریق شد. پس از بیهوشی، با تشریح حیوان نمونههای خون مستقیماً از ﻗﻠﺐ موشها ﺟﻤﻊآوری ﺷﺪ. نمونههای سرم ﭘﺲ از سانتریفیوژ با 3000 دور در دﻗﻴﻘﻪ ﺑﻪ ﻣﺪت 15دﻗﻴﻘﻪ ﺑﻪ آزمایشگاه منتقل شدند. در این مطالعه MDA براساس میزان تولید مواد واکنشگر با تیوباربیتوریک اسید و بر اساس روش شرح داده شده به وسیله Ohkawa و همکاران اندازهگیری شد (23). سنجش فعالیت سوپر¬اکسید¬دیسموتاز (SOD) براساس مهار احیا نیترو بلوتترازولیوم توسط سیستم گزانتینگزانتیناکسیداز بهعنوان تولیدکننده سوپر¬اکسید میباشد. جذب نوری هر نمونه در طول موج نوری ۵۵۰ نانومتر به مدت ۵ دقیقه هر ۳۰ ثانیه یک بار خوانده شد. برای به دست آوردن درصد مهار احیا نیتروبلوتترازولیوم توسط آنزیم SOD، از فرمول مربوط به دستورالعمل کیت رندوکس (rendox)استفاده شد (24). برای سنجش فعالیت گلوتاتیون پراکسیداز (GPX) از کیت رندوکس انگلستان (rendox) استفاده شد. آنزیم GPX در حضور کومنهیدروپراکسید سبب تسریع در اکسیداسیون گلوتاتیون می¬شود. حال درصورت حضور آنزیم گلوتاتیون¬ردوکتاز و نیکوتین¬آمید دی نوکلئوتید فسفات (NADPH)، گلوتاتیون-اکسید شده سریعاً احیا و NADPH به +NADP تبدیل می¬شود. میزان حضور آنزیم GPX با اندازهگیری میزان کاهش رنگ ایجاد شده در طول موج ۳۴۰ نانومتر اشعه فرابنفش طی ۲ دقیقه قرائت شد (24). همچنین برای سنجش CAT براساس روش Koroluk و همکاران اندازهگیری شد (25).
تجزیه و تحلیل آماری
برای محاسبه و تجزیه و تحلیل آماری اطلاعات خام از نرمافزارversion 16 SPSS و برای ترسیم نمودار از نرمافزار Excel استفاده شد. همچنین سطح معنیداری برای تمام روش¬های آماری در سطح احتمال (05/0≤ P) در نظرگرفته شد. برای تعیین توزیع طبیعی دادهها از آزمون شاپیروویلک در سطح معنی¬داری (05/0P ≥) استفاده شد. همچنین برای تجزیه و تحلیل آماری از روش ANOVA یک طرفه و آزمونهای تعقیبی LSD استفاده شد.
ملاحظات اخلاقی
این تحقیق با (کد کمیته اخلاقEE/97.24.3.70352/ scu.ac.ir) در دانشگاه شهید چمران اهواز تایید و انجام شد.
نتاج
نتایج حاصل از تجزیه و تحلیل داده¬ها در نمودارهای 1 تا 4 نشان داده شده است. نتایج آزمون تعقیبی LSD (جدول 2) نشان داد که پس از 6 هفته تمرین هوازی میزان میانگین غلظت MDA در هر دو گروه تمرین و گروه ترکیبی تمرین و دریافتکننده ریزگردها نسبت به گروه کنترل کاهش معناداری داشته است (p≤ 0/05). غلظت MDA اگر چه در گروه دریافتکننده ریگردها افزایش داشته است اما این افزایش نسبت به گروه کنترل معنادار نبود (P ≥0/05). همچنین دو گروه تمرین و تمرین+ریزگرد نسبت بهگروه آلودگی کاهش معناداری در میزان MDA نشان دادهاند (p≤ 0/05). اما بین دو گروه تمرین و تمرین+ریزگرد تفاوت معنادار نبود (P ≥0/05). میزان میانگین غلظت SOD در دو گروه تمرین و گروه ترکیبی تمرین و دریافتکننده ریزگردها نسبت بهگروه کنترل تفاوت معناداری نداشت. اما میزان این آنزیم در گروه دریافتکننده ریزگردها نسبت به گروه کنترل افزایش معناداری نشان داده است (p≤ 0/05). همچنین گروه دریافتکننده ریزگردها نسبت به دو گروه تمرین و گروه ترکیبی تمرین و ریزگرد افزایش معناداری در غلظت SOD نشان داده است (p≤ 0/05). بین دو گروه تمرین و تمرین+ریزگرد تفاوت معنادار نبود (P ≥0/05)). نتایج حاصل از آزمون تحلیل واریانس یک راهه نشانداد بین هیچیک از گروههای تحقیق در غلظت آنزیم¬های GPX و CAT تفاوت معناداری وجود نداشته است (P ≥0/05)).
جدول2: نتایج تحلیل واریانس یک¬راهه و آزمون تعقیبی LSD در سطوح MDA، SOD، GPX، CAT پس از 6 هفته تمرین هوازی در رتهای در معرض ریزگردهای محیطی


بحث
در مطالعه حاضر به بررسی اثر 6 هفته تمرین هوازی بر وضعیت استرس اکسیداتیو خون موشهای صحرایی نر در معرض ریگردهای محیطی پرداخته شده است. در مطالعه دئول و همکاران در سال 2012 که بر روی موشهای صحرایی نر نژاد ویستار انجام گرفت مشاهده شد که ریزگردها باعث افزایش بیان سوپراکسید دیسموتاز، کاهش بیان نیتریکاکساید و کاهش اتساع عروقی میشود (26). رادمنش و همکاران (1393) در مطالعهای اثر ریزگردهای محیطی به تنهایی و همزمان با وانیلیکاسید بر ویژگیهای الکتروفیزیولوژیک، پارامترهای همودینامیک و استرساکسیداتیو ناشی از ریزگردها در قلب موش صحرائی نر را بررسی کردند، که نتایج آنها افزایش در پراکسیداسیون لیپیدی را در اثر دریافت ریزگردها نشان داد (27). در مطالعه امیلی و همکاران نیز که در سال 2006 بر روی موشها انجام گرفت دیده شد تزریق اینتراتراکئال ریزگردها باعث افزایش سطح استرساکسیداتیو میشود که این نتایج همسو با تحقیق حاضر میباشد (28). شواهد علمی محکمی وجود دارد که نشان میدهد یک شیوه زندگی فعال، تولید ROS را کاهش میدهد (29). کاهش استرساکسیداتیو احتمالاً از طریق بهبود دفاع آنتیاکسیدانی و یا کاهش تشکیل گونههای واکنشپذیر، مکانیسمی است که از طریق آن فعالیت بدنی میتواند خطر بیمارهای مزمن را کاهشدهد (30). انجـام فعالیتهای منظم بدنی بهدلیل آثار تأیید شدهای که برتقویت دستگاه ضد اکسایشی بدن دارد، مورد توجه محققان در سراسر دنیا بوده است. ورزش هوازی اگر به صورت منظم انجام گیرد میتواند استرساکسیداتیو را بهطور سیستماتیک در بیماریهای مختلف مانند بیماری¬های قلبی، دیابت نوع 2، آرتریت روماتوئید و بیماریهای آلزایمر و پارکینسون کاهش دهد (31)، ورزش منظم میتواند باعث جلوگیری از پراکسیداسیون لیپید و افزایش میزان آنتیاکسیدانها شود (32،33،34). 6 هفته تمرین هوازی توانست میزان پراکسیداسیون لیپیدی ناشی از تجویز ریزگردها را بهطور معناداری کاهش دهد. این نتایج با تحقیق حبیبان و همکاران (1392) همسو میباشد آنها در مطالعهای اثر حمایتی تمرینهوازی بر استرساکسیداتیو ناشی از سرب در مخچه موش صحرایی را مورد بررسی قرار دادند، که تیمار مزمن با استات سرب سطوح MDA مخچهای را در موشها افزایش داد، اما اثر متقابل تمرین هوازی و استات سرب سطوح MDA را کاهش داد (35). همچنین در مطالعات، پارکس و همکاران (2016)، پریرار و همکاران (2016) و اعظمیان جزی و همکاران (1395) (36،37،38) نشان دادند که تمرینات منظم هوازی تاثیر مثبت و معناداری بر کاهش سطوح مالوندیآلدهید دارد که با تحقیق ما همسو میباشند. ماروسی و همکاران در سال 2012 تحقیقی با عنوان تاثیر تمرینات بلند مدت هوازی بر کاهش استرساکسیداتیو در هیپوکمپ موشهای سالم را بررسی کردند. که نتایج این تحقیق نشان داد ورزش موجب تنظیم مقادیر آنزیهای SOD و GPX، میشود (39). مطالعات نشان داده تمرین استقامتی بـا افـزایش فعالیت آنزیمهای CAT وGPX فشار اکسایشی را در عـضلات اسکلتی و سایر بافتهای بدن کاهش میدهد (40،41). این درحالی است که در تحقیق حاضر با وجود تغییرات جزئی در میزان آنزیمهای GPX و CAT این تغییرات معنادار نبود. علت عدم تغییر میزان فعالیت آنزیمهای آنتیاکسیدانی بهدنبال تمرین هوازی در این تحقیق را میتوان توسط چند عامل توجیه کرد. این احتمال وجود دارد که شدت تمرین به کارگرفته شده، درحدی نبوده است که میزان تولید گونههای اکسیژن فعال را افزایش داده باشد (42،43). از طرف دیگر، این احتمال وجود دارد که انجام تمرینات منظم با شدتهای کم، سبب ایجاد سازگاری در سیستم ضد اکسایشی بدن شود (44). از این رو میتوان گفت که میزان طبیعی آنزیمهای آنتیاکسیدانی، پاسخگوی مقابله با رادیکالهای تولید شده در اثر این نوع تمرین بودهاند، که میتواند توجیه مناسبی برای عدم تغییر در فعالیت این آنزیمها به حساب آید. همچنین علت عدم تغییر در میزان فعالیت آنزیم GPX میتواند به این علت باشد که آنزیم GPX آخرین آنزیمی است که وارد واکنشهای ضد اکسایشی میشود (45). بهطورکلی، نوع تمرین (مدت و شدت) و بافتی که برای تحقیق به کار گرفته میشود، تأثیر زیادی در نتایج تحقیق دارد.
نتیجهگیری
با توجه به این که آزمودنیها، موشهای آلوده به ریزگردها محیطی، سطوح بالای پراکسیداسیونلیپیدی و دفاع آنتیاکسیدانی پایینتری را نسبت به سایر گروهها نشان دادند. به نظر میرسد 6 هفته تمرینات هوازی موجب کاهش سطوح مالوندیآلدهید میشود و میتواند استرس اکسایشی را کاهش دهد. عدم تغییر در فعالیت آنزیمهای آنتیاکسیدانی، میتواند بهدلیل پایین بودن شدت تمرین و عدم تولید رادیکالهای آزاد بوده باشد. بنابراین میتوان بیان داشت که تمرین هوازی منظم میتواند بهعنوان یک راهبرد درمانی و حمایتی برای افزایش مقاومت در برابر استرس اکسیداتیو ناشی از آلایندههای محیطی عمل کند. هرچند که نکات متعددی دراین ارتباط وجود دارد و در آینده باید مورد مطالعه قرار گیرد.
سپاسگزاری
بدینوسیله از تمامی کسانی که مرا در انجام این تحقیق یاری نمودهاند تشکر میکنم، این مطالعه حاصل پایاننامه ارشد، مصوب دانشگاه شهید چمران اهواز میباشد.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد
References:
1- Kim KH, Jahan SA, Kabir E. A Review on Human Health Perspective of Air Pollution with Respect to Allergies and Asthma. Environment International 2013; 59: 41-52.
2- Brauer M, Amann M, Burnett RT, Cohen A, Dentener F, Ezzati M, et al. Exposure Assessment for Estimation of the Global Burden of Disease Attributable to Outdoor Air Pollution. Environ Sci & Techno 2012; 46(2): 652-60.
3- Goudarzi G, Shirmardi M, Khodarahmi F, Hashemi-Shahraki A, Alavi N, Ankali KA, et al. Particulate Matter and Bacteria Characteristics of the Middle East Dust (MED) Storms over Ahvaz, Iran. Aerobiologia 2014; 30(4): 345-56.
4- Griffin DW, Kellogg CA. Dust Storms and their Impact on Ocean and Human Health: Dust in Earth’s Atmosphere. EcoHealth 2004; 1(3): 284-95.
5- Miri A, Ahmadi H, Ghanbari A, Moghaddamnia A. Dust Storms Impacts on Air Pollution and Public Health Under Hot and Dry Climate. Int J Energy Environ 2007; 2(1): 101-5.
6- Shahsavani A, Naddafi K, Haghighifard NJ, Mesdaghinia A, Yunesian M, Nabizadeh R, et al. Characterization of Ionic Composition of TSP and PM 10 During the Middle Eastern Dust (MED) Storms in Ahvaz, Iran. Environmental Monitoring Assessment 2012; 184(11): 6683-92.
7- Shahsavani A, Naddafi K, Haghighifard NJ, Mesdaghinia A, Yunesian M, Nabizadeh R, et al. The evaluation of PM10, PM2. 5 and PM1 concentrations during the Middle Eastern Dust (MED) events in Ahvaz, Iran, from April through September 2010. Journal of arid environments 2012; 77: 72-83.
8- Jones OA, Maguire ML, Griffin JL. Environmental Pollution and Diabetes: A Neglected Association. Lancet 2008; 371(9609): 287-8.
9- Chang CK, Huang HY, Tseng HF, Hsuuw YD, Tso TK. Interaction of Vitamin E and Exercise Training on Oxidative Stress and Antioxidant Enzyme Activities in Rat Skeletal Muscles. J Nutr Biochem 2007; 18(1): 39-45.
10- Ghio AJ, Carraway MS, Madden MC. Composition of Air Pollution Particles and Oxidative Stress in Cells, Tissues, and Living Systems. J Toxicol Environ Health B Crit Rev 2012; 15(1): 1-21.
11- Stefanis L, Burke RE, Greene LA. Apoptosis in Neurodegenerative Disorders. Current Opinion in Neurology1997; 10(4): 299-305.
12- Stirban AO, Tschoepe D. Cardiovascular Complications in Diabetes: Targets and Interventions. Diabetes Care 2008; 31(Supplement 2): S215-21.
13- Link MS, Luttmann-Gibson H, Schwartz J, Mittleman MA, Wessler B, Gold DR, Dockery DW, Laden F. Acute Exposure to Air Pollution Triggers Atrial Fibrillation. J American College of Cardiology 2013; 62(9): 816-25.
14- Kurosaki Y, Mikami M. Recent Frequent Dust Events and their Relation to Surface Wind in East Asia. Geophysical Research Letters 2003; 30(14).
15- Risom L, Møller P, Loft S. Oxidative Stress-Induced DNA Damage by Particulate Air Pollution. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis 2005; 592(1): 119-37.
16- Pinho RA, Andrades ME, Oliveira MR, Pirola AC, Zago MS, Silveira PC, et al. Imbalance in SOD/CAT Activities in Rat Skeletal Muscles Submitted to Treadmill Training Exercise. Cell Biol Int 2006; 30(10): 848-53.
17- Watson TA, Macdonald-Wicks LK, Garg ML. Oxidative Stress and Antioxidants in Athletes Undertaking Regular Exercise Training. Int J Sport Nutr Exerc Metab 2005; 15(2): 131-46.
18- Vincent HK, Powers SK, Stewart DJ, Demirel HA, Shanely RA, Naito H. Short Term Exercise Training Improves Diaphragm Antioxidant Capacity and Endurance. Eur J Appl Physiol 2000; 81(1-2): 67-74.
19- Minyi SHI, Wang X, Yamanka T, Ogita F, Nakatani K, Takeuchi T. Effects of Anaerobic Exercise and Aerobic Exercise on Biomarkers of Oxidative Stress. Environ Health Prev Med 2007; 12(5): 202-8.
20- Shahsavani A, Naddafi K, Haghighifard NJ, Mesdaghinia A, Yunesian M, Nabizadeh R, et al. The Evaluation of PM10, PM2. 5 and PM1 Concentrations During the Middle Eastern Dust (MED) Events in Ahvaz, Iran, From April through September 2010. J Arid Environments 2012; 77: 72-83.
21- Vieira RD, Toledo AC, Silva LB, Almeida FM, Damaceno-Rodrigues NR, Caldini EG, et al. Anti-Inflammatory Effects of Aerobic Exercise in Mice Exposed to Air Pollution. Medicine & Science in Sports & Exercise 2012; 44(7): 1227-34.
22- Vieira RP, Claudino RC, Duarte AC, Santos ÂB, Perini A, Faria Neto HC, et al. Aerobic Exercise Decreases Chronic Allergic Lung Inflammation and Airway Remodeling in Mice. American J Respiratory and Critical Care Medicine 2007; 176(9): 871-7.
23- Ohkawa H, Ohishi N, Yagi K. Assay for Lipid Peroxides in Animal Tissues by Thiobarbituric Acid Reaction. Analytical Biochemistry 1979; 95(2): 351-8.
24- Kakkar P, Das B, Viswanathan PN. A Modified Spectrophotometric Assay of Superoxide Dismutase. Indian J Biochem Boiphys 1984; 21: 130-32.
25- Koroluk MA, Ivanova LI, Maiorova IG. The Method of Definition of the Activeness of Catalase. Laboratorial Work 1988; 1: 16-9.
26- Davel AP, Lemos M, Pastro LM, Pedro SC, De André PA, Hebeda C, et al. Endothelial Dysfunction in the Pulmonary Artery Induced by Concentrated Fine Particulate Matter Exposure is Associated with Local but Not Systemic Inflammation. Toxicology 2012; 295(1-3): 39-46.
27- Dianat M, Radmanesh E, Badavi M, Mard SA, Goudarzi G. Disturbance Effects of PM 10 on Inos and Enos Mrna Expression Levels and Antioxidant Activity Induced by Ischemia–Reperfusion Injury in Isolated Rat Heart: Protective Role of Vanillic Acid. Environmental Science and Pollution Research 2016; 23(6): 5154-65.
28- Cozzi E, Hazarika S, Stallings III HW, Cascio WE, Devlin RB, Lust RM, et al. Ultrafine Particulate Matter Exposure Augments Ischemia-Reperfusion Injury in Mice. American J Physiology-Heart and Circulatory Physiology 2006; 291(2): H894-903.
29- Ghio AJ, Carraway MS, Madden MC. Composition of Air Pollution Particles and Oxidative Stress in Cells, Tissues, and Living Systems. Journal of Toxicology and Environmental Health, Part B 2012; 15(1): 1-21.
30- Anderson JO, Thundiyil JG, Stolbach A. Clearing The Air: A Review of the Effects of Particulate Matter Air Pollution on Human Health. J Medical Toxicology 2012; 8(2): 166-75.
31- Radak Z, Chung HY, Goto S. Systemic Adaptation to Oxidative Challenge Induced by Regular Exercise. Free Radical Biology and Medicine 2008; 44(2): 153-9.
32- Ma J, Liu Z, Ling W. Physical Activity, Diet and Cardiovascular Disease Risks in Chinese Women. Public Health Nutrition 2003; 6(2): 139-46.
33- Karolkiewicz J, Szczesniak L, Deskur-Smielecka E, Nowak A, Stemplewski R, Szeklicki R. Oxidative Stress and Antioxidant Defense System in Healthy, Elderly Men: Relationship to Physical Activity. The Aging Male 2003; 6(2): 100-5.
34- Mezzani A, Corrà U, Baroffio C, Bosimini E, Giannuzzi P. Habitual Activities and Peak Aerobic Capacity in Patients with Asymptomatic and Symptomatic Left Ventricular Dysfunction. Chest 2000; 117(5): 1291-9.
35- Habibian M, Dabidi Roshan V, Moosavi SJ, Mahmoody SA. Neuroprotective Effect of Aerobic Training against Leadinduced Oxidative Stress in Rat Cerebellum. J Gorgan University of Medical Sciences 2013; 15(3). [Persian]
36- Park SY, Kwak YS. Impact of Aerobic and Anaerobic Exercise Training on Oxidative Stress and Antioxidant Defense in Athletes. J Exercise Rehabilitation 2016; 12(2): 113.
37- Pereira AD, Spagnol AR, Luciano E, Leme JA. Influence of Aerobic Exercise Training on Serum Markers of Oxidative Stress in Diabetic Rats. Journal of Physical Education 2016; 27.
38- Azamian Jazi A, Shokouhi R. The Effect of an Eight Week Combined Exercise Training on Oxidative Stress and Lipid Peroxidation in Postmenopausal Women with Type 2 Diabetes. SSU_Journals 2016; 24(8): 667-78. [Persian]
39- Marosi K, Bori Z, Hart N, Sárga L, Koltai E, Radák Z, Nyakas C. Long-Term Exercise Treatment Reduces Oxidative Stress in the Hippocampus of Aging Rats. Neuroscience 2012; 226: 21-8.
40- Lambertucci RH, Levada-Pires AC, Rossoni LV, Curi R, Pithon-Curi TC. Effects of Aerobic Exercise Training on Antioxidant Enzyme Activities and Mrna Levels in Soleus Muscle from Young and Aged Rats. Mechanisms of Ageing and Development 2007; 128(3): 267-75.
41- Pepe H. The Effects of Gender and Exercise on Malondialdehyde, Nitric Oxide and Total Glutathione Levels in Rat Liver. African J Pharmacy Pharmacology 2011; 5(4): 515-21.
42- Gomes EC, Silva AN, Oliveira MR. Oxidants, Antioxidants, and the Beneficial Roles of Exercise-Induced Production of Reactive Species. Oxidative Medicine and Cellular Longevity 2012; 2012.
43- Berzosa C, Cebrian I, Fuentes-Broto L, Gomez-Trullen E, Piedrafita E, Martinez-Ballarin E, et al. Acute Exercise Increases Plasma Total Antioxidant Status and Antioxidant Enzyme Activities in Untrained Men. Biomed Research International 2011; 2011.
44- Tong TK, Lin H, Lippi G, Nie J, Tian Y. Serum Oxidant and Antioxidant Status in Adolescents Undergoing Professional Endurance Sports Training. Oxidative Medicine and Cellular Longevity 2012; 2012.
45- Schneider CD, Barp J, Ribeiro JL, Belló-Klein A, Oliveira AR. Oxidative Stress after Three Different Intensities of Running. Canadian J Applied Physiology 2005; 30(6): 723-34.
2- Brauer M, Amann M, Burnett RT, Cohen A, Dentener F, Ezzati M, et al. Exposure Assessment for Estimation of the Global Burden of Disease Attributable to Outdoor Air Pollution. Environ Sci & Techno 2012; 46(2): 652-60.
3- Goudarzi G, Shirmardi M, Khodarahmi F, Hashemi-Shahraki A, Alavi N, Ankali KA, et al. Particulate Matter and Bacteria Characteristics of the Middle East Dust (MED) Storms over Ahvaz, Iran. Aerobiologia 2014; 30(4): 345-56.
4- Griffin DW, Kellogg CA. Dust Storms and their Impact on Ocean and Human Health: Dust in Earth’s Atmosphere. EcoHealth 2004; 1(3): 284-95.
5- Miri A, Ahmadi H, Ghanbari A, Moghaddamnia A. Dust Storms Impacts on Air Pollution and Public Health Under Hot and Dry Climate. Int J Energy Environ 2007; 2(1): 101-5.
6- Shahsavani A, Naddafi K, Haghighifard NJ, Mesdaghinia A, Yunesian M, Nabizadeh R, et al. Characterization of Ionic Composition of TSP and PM 10 During the Middle Eastern Dust (MED) Storms in Ahvaz, Iran. Environmental Monitoring Assessment 2012; 184(11): 6683-92.
7- Shahsavani A, Naddafi K, Haghighifard NJ, Mesdaghinia A, Yunesian M, Nabizadeh R, et al. The evaluation of PM10, PM2. 5 and PM1 concentrations during the Middle Eastern Dust (MED) events in Ahvaz, Iran, from April through September 2010. Journal of arid environments 2012; 77: 72-83.
8- Jones OA, Maguire ML, Griffin JL. Environmental Pollution and Diabetes: A Neglected Association. Lancet 2008; 371(9609): 287-8.
9- Chang CK, Huang HY, Tseng HF, Hsuuw YD, Tso TK. Interaction of Vitamin E and Exercise Training on Oxidative Stress and Antioxidant Enzyme Activities in Rat Skeletal Muscles. J Nutr Biochem 2007; 18(1): 39-45.
10- Ghio AJ, Carraway MS, Madden MC. Composition of Air Pollution Particles and Oxidative Stress in Cells, Tissues, and Living Systems. J Toxicol Environ Health B Crit Rev 2012; 15(1): 1-21.
11- Stefanis L, Burke RE, Greene LA. Apoptosis in Neurodegenerative Disorders. Current Opinion in Neurology1997; 10(4): 299-305.
12- Stirban AO, Tschoepe D. Cardiovascular Complications in Diabetes: Targets and Interventions. Diabetes Care 2008; 31(Supplement 2): S215-21.
13- Link MS, Luttmann-Gibson H, Schwartz J, Mittleman MA, Wessler B, Gold DR, Dockery DW, Laden F. Acute Exposure to Air Pollution Triggers Atrial Fibrillation. J American College of Cardiology 2013; 62(9): 816-25.
14- Kurosaki Y, Mikami M. Recent Frequent Dust Events and their Relation to Surface Wind in East Asia. Geophysical Research Letters 2003; 30(14).
15- Risom L, Møller P, Loft S. Oxidative Stress-Induced DNA Damage by Particulate Air Pollution. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis 2005; 592(1): 119-37.
16- Pinho RA, Andrades ME, Oliveira MR, Pirola AC, Zago MS, Silveira PC, et al. Imbalance in SOD/CAT Activities in Rat Skeletal Muscles Submitted to Treadmill Training Exercise. Cell Biol Int 2006; 30(10): 848-53.
17- Watson TA, Macdonald-Wicks LK, Garg ML. Oxidative Stress and Antioxidants in Athletes Undertaking Regular Exercise Training. Int J Sport Nutr Exerc Metab 2005; 15(2): 131-46.
18- Vincent HK, Powers SK, Stewart DJ, Demirel HA, Shanely RA, Naito H. Short Term Exercise Training Improves Diaphragm Antioxidant Capacity and Endurance. Eur J Appl Physiol 2000; 81(1-2): 67-74.
19- Minyi SHI, Wang X, Yamanka T, Ogita F, Nakatani K, Takeuchi T. Effects of Anaerobic Exercise and Aerobic Exercise on Biomarkers of Oxidative Stress. Environ Health Prev Med 2007; 12(5): 202-8.
20- Shahsavani A, Naddafi K, Haghighifard NJ, Mesdaghinia A, Yunesian M, Nabizadeh R, et al. The Evaluation of PM10, PM2. 5 and PM1 Concentrations During the Middle Eastern Dust (MED) Events in Ahvaz, Iran, From April through September 2010. J Arid Environments 2012; 77: 72-83.
21- Vieira RD, Toledo AC, Silva LB, Almeida FM, Damaceno-Rodrigues NR, Caldini EG, et al. Anti-Inflammatory Effects of Aerobic Exercise in Mice Exposed to Air Pollution. Medicine & Science in Sports & Exercise 2012; 44(7): 1227-34.
22- Vieira RP, Claudino RC, Duarte AC, Santos ÂB, Perini A, Faria Neto HC, et al. Aerobic Exercise Decreases Chronic Allergic Lung Inflammation and Airway Remodeling in Mice. American J Respiratory and Critical Care Medicine 2007; 176(9): 871-7.
23- Ohkawa H, Ohishi N, Yagi K. Assay for Lipid Peroxides in Animal Tissues by Thiobarbituric Acid Reaction. Analytical Biochemistry 1979; 95(2): 351-8.
24- Kakkar P, Das B, Viswanathan PN. A Modified Spectrophotometric Assay of Superoxide Dismutase. Indian J Biochem Boiphys 1984; 21: 130-32.
25- Koroluk MA, Ivanova LI, Maiorova IG. The Method of Definition of the Activeness of Catalase. Laboratorial Work 1988; 1: 16-9.
26- Davel AP, Lemos M, Pastro LM, Pedro SC, De André PA, Hebeda C, et al. Endothelial Dysfunction in the Pulmonary Artery Induced by Concentrated Fine Particulate Matter Exposure is Associated with Local but Not Systemic Inflammation. Toxicology 2012; 295(1-3): 39-46.
27- Dianat M, Radmanesh E, Badavi M, Mard SA, Goudarzi G. Disturbance Effects of PM 10 on Inos and Enos Mrna Expression Levels and Antioxidant Activity Induced by Ischemia–Reperfusion Injury in Isolated Rat Heart: Protective Role of Vanillic Acid. Environmental Science and Pollution Research 2016; 23(6): 5154-65.
28- Cozzi E, Hazarika S, Stallings III HW, Cascio WE, Devlin RB, Lust RM, et al. Ultrafine Particulate Matter Exposure Augments Ischemia-Reperfusion Injury in Mice. American J Physiology-Heart and Circulatory Physiology 2006; 291(2): H894-903.
29- Ghio AJ, Carraway MS, Madden MC. Composition of Air Pollution Particles and Oxidative Stress in Cells, Tissues, and Living Systems. Journal of Toxicology and Environmental Health, Part B 2012; 15(1): 1-21.
30- Anderson JO, Thundiyil JG, Stolbach A. Clearing The Air: A Review of the Effects of Particulate Matter Air Pollution on Human Health. J Medical Toxicology 2012; 8(2): 166-75.
31- Radak Z, Chung HY, Goto S. Systemic Adaptation to Oxidative Challenge Induced by Regular Exercise. Free Radical Biology and Medicine 2008; 44(2): 153-9.
32- Ma J, Liu Z, Ling W. Physical Activity, Diet and Cardiovascular Disease Risks in Chinese Women. Public Health Nutrition 2003; 6(2): 139-46.
33- Karolkiewicz J, Szczesniak L, Deskur-Smielecka E, Nowak A, Stemplewski R, Szeklicki R. Oxidative Stress and Antioxidant Defense System in Healthy, Elderly Men: Relationship to Physical Activity. The Aging Male 2003; 6(2): 100-5.
34- Mezzani A, Corrà U, Baroffio C, Bosimini E, Giannuzzi P. Habitual Activities and Peak Aerobic Capacity in Patients with Asymptomatic and Symptomatic Left Ventricular Dysfunction. Chest 2000; 117(5): 1291-9.
35- Habibian M, Dabidi Roshan V, Moosavi SJ, Mahmoody SA. Neuroprotective Effect of Aerobic Training against Leadinduced Oxidative Stress in Rat Cerebellum. J Gorgan University of Medical Sciences 2013; 15(3). [Persian]
36- Park SY, Kwak YS. Impact of Aerobic and Anaerobic Exercise Training on Oxidative Stress and Antioxidant Defense in Athletes. J Exercise Rehabilitation 2016; 12(2): 113.
37- Pereira AD, Spagnol AR, Luciano E, Leme JA. Influence of Aerobic Exercise Training on Serum Markers of Oxidative Stress in Diabetic Rats. Journal of Physical Education 2016; 27.
38- Azamian Jazi A, Shokouhi R. The Effect of an Eight Week Combined Exercise Training on Oxidative Stress and Lipid Peroxidation in Postmenopausal Women with Type 2 Diabetes. SSU_Journals 2016; 24(8): 667-78. [Persian]
39- Marosi K, Bori Z, Hart N, Sárga L, Koltai E, Radák Z, Nyakas C. Long-Term Exercise Treatment Reduces Oxidative Stress in the Hippocampus of Aging Rats. Neuroscience 2012; 226: 21-8.
40- Lambertucci RH, Levada-Pires AC, Rossoni LV, Curi R, Pithon-Curi TC. Effects of Aerobic Exercise Training on Antioxidant Enzyme Activities and Mrna Levels in Soleus Muscle from Young and Aged Rats. Mechanisms of Ageing and Development 2007; 128(3): 267-75.
41- Pepe H. The Effects of Gender and Exercise on Malondialdehyde, Nitric Oxide and Total Glutathione Levels in Rat Liver. African J Pharmacy Pharmacology 2011; 5(4): 515-21.
42- Gomes EC, Silva AN, Oliveira MR. Oxidants, Antioxidants, and the Beneficial Roles of Exercise-Induced Production of Reactive Species. Oxidative Medicine and Cellular Longevity 2012; 2012.
43- Berzosa C, Cebrian I, Fuentes-Broto L, Gomez-Trullen E, Piedrafita E, Martinez-Ballarin E, et al. Acute Exercise Increases Plasma Total Antioxidant Status and Antioxidant Enzyme Activities in Untrained Men. Biomed Research International 2011; 2011.
44- Tong TK, Lin H, Lippi G, Nie J, Tian Y. Serum Oxidant and Antioxidant Status in Adolescents Undergoing Professional Endurance Sports Training. Oxidative Medicine and Cellular Longevity 2012; 2012.
45- Schneider CD, Barp J, Ribeiro JL, Belló-Klein A, Oliveira AR. Oxidative Stress after Three Different Intensities of Running. Canadian J Applied Physiology 2005; 30(6): 723-34.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1397/10/25 | پذیرش: 1398/3/25 | انتشار: 1399/12/10
دریافت: 1397/10/25 | پذیرش: 1398/3/25 | انتشار: 1399/12/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







