دوره 31، شماره 10 - ( دی 1402 )
جلد 31 شماره 10 صفحات 7128-7117 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Bahrami M, Haghighi A H, Asadi-Shekaari M, Shahrabadi H, Shafiei A. Effect of Eight Weeks of High Intensity Interval Training on Tissue Changes and Gene Expression of APP and Tau Indices in the Hippocampus of Rats Addicted to Methamphetamine. JSSU 2024; 31 (10) :7117-7128
URL: http://jssu.ssu.ac.ir/article-1-6063-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6063-fa.html
بهرامی مینا، حقیقی امیرحسین، اسدی شکاری مجید، شهرآبادی هادی، شفیعی احد. اثر هشت هفته تمرین تناوبی شدید بر تغییرات بافتی و بیان ژنی شاخص های APP و Tau در هیپوکامپ موشهای صحرائی وابسته به متآمفتامین. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (10) :7117-7128
متن کامل [PDF 1246 kb]
(137 دریافت)
| چکیده (HTML) (200 مشاهده)
متن کامل: (106 مشاهده)
مقدمه
متآمفتامین (Methamphetamine) دارویی اعتیادآور و محرک است که بـه دلیـل دارا بـودن احســاس لــذت و سرخوشــی مــورد توجــه اکثــر مــردم بهویــژه جوانــان و نوجوانــان بــوده اســت (1). هــر چنــد مکانیسـمهای تخریـب سـلولهای عصبـی در نتیجـه مصـرف متآمفتامین در سیســتم عصبــی مرکــزی بــهطــور دقیــق مشـخص نشـده اسـت امـا تحقیقـات نشـان دادهاند کـه اسـترس اکسیــداتیو، القای آپوپتوز، فعالسازی میکروگلیا، هیپرترمــی و غیره در ایــن امــر دخیــل میباشــند (2,3). در واقــع متآمفتامین از طریـق بهـم ریختـن سیسـتم آنتیاکسـیدانی سـلولهای عصبـی منجـر بـه ایجـاد اسـترس اکسـیداتیو و در نهایــت مــرگ ســلولی میشــود (4,5). آنزیمهای کلیدی این سیســتم شامل سوپراکسید دیسموتاز (Superoxide dismutase)،کاتالاز (Catalase) و گلوتاتیون پراکســیداز (glutathione peroxidase) میباشند و خصوصیت مهم این آنزیمها، قابل القاء بودن آنها تحت شرایط استرس اکسیداتیو است (6,7). آلفا-سینوکلئین (α-synuclein)، پروتئینی غنی شده میباشد؛ که در پایانههای پیشسیناپسی عصبی و در میتوکندری وجود دارند. در چندین بیماری تخریب عصبی شامل زوال عقل با اجسام لویی (Dementia with Lewy bodies) ، آتروفی سیستم چندگانه (Multiple system atrophy) و بیماری آلزایمر(Alzheimer disease) و پارکینسون (Parkinson disease) نقش مهمی دارد (8). آلفاسینوکلئین (α-syn) پس از مسمومیت با METH در هیپوکامپ و ماده سیاه (Substantia nigra) تجمع مییابد. برخی تغییرات خاص پس از ترجمه از جمله فسفوریلاسیون، فراگیر شدن سمیت و نیتروسیلاسیون α-syn ممکن است باعث جمع شدن آنها شود (9). α-syn که توسط سلولهای عصبی ترشح میشود، ممکن است سلول¬های میکروگلیا را در درجات مختلف فعال کند (10). پاتولوژیک α- syn و فعالشدن میکروگلیایی با تقویت یکدیگر میتوانند منجر به تخریب عصبی شوند (11). با اینحال، اثرات METH در مسیر سیگنالینگ انسولین و بیان پروتئینهای پاتولوژیک مرتبط با بیماری آلزایمر (AD)، از جمله پروتئین پیشساز آمیلوئید (APP) وp-tau ، بهخوبی شناخته شده نیست (12). با اتصال METH به گیرنده انسولین، فعالیت تیروزینکینازی زیر واحد بتا آغاز و به دنبال آن مسیرهای پایین دستی Akt و PI3K غیرفعال میشوند. عدم فعال شدن آنها باعث افزایش GSK-3β شده و این مسیر باعث افزایش پروتئین پیشساز آمیلوئید (APP)و p-tau میشود که در نهایت کاهش عملکرد شناختی (حافظه و یادگیری) را بهدنبال دارد (2,13). با این حال، نقش التهاب عصبی به واسطه α-syn ناشی از METH نیاز به مطالعه بیشتر دارد. یک فرضیه بیان میکند که تجمع α-syn ناشی از METH ممکن است بهطور مستقیم منجر به آسیب میتوکندری، تخریب غلاف میلین و نارسایی تشکیل وزیکولهای سیناپسی شده و اثر غیرمستقیم میتواند از طریق فعالکردن بیش اندازه CDK5 و GSK-3β منجر به فسفوریلاسیون تائوp-tau) ) و بلوکه کردن اتوفاژی شود. هر دو مسیر بهطور همافزایی می¬توانند باعث افزایش تحلیل سلولهای عصبی ناشی ازMETH شوند (14). سمیت در سلولهای عصبی به واسطه متآمفتامین می تواند منجر به تخریب عصبی و در نهایت بهوجود آورنده بیماری آلزایمر در افراد شود. لذا جلوگیری از ایجاد بیماری آلزایمر در اثر متآمفتامین از اهمیت بالایی برخودار است. از بین راهکارهای درمانی که برای اثرات نوروتوکسیک مت¬آمفتامین ، مطرح شده است و در این زمینه، مطالعات نشان میدهد که ورزش و فعالیت بدنی پایدار میتواند به عنوان یک مداخله برای کاهش اثرات مخرب مت-آمفتامین مورد استفاده قرار گیرد. بنابراین، به نظر میرسد که متآمفتامین عملکرد طبیعی مغز را مختل میکند و ورزش از این اختلال جلوگیری یا آن را کاهش میدهد. تجمع آلفا سینوکلئین به طور قابل توجهی باعث وجود نقصهای حرکتی می شود؛ که اصلیترین علامت بیماری پارکینسون است، یافتهها نشان میدهد که تمرین استقامتی سطح α-Syn را کاهش داده، که متعاقباً باعث از بین رفتن نورونهای دوپامینرژیک (DAergic) و مرگ سلولی (آپوپتوز با واسطه(α-Syn میشود (15). میناکاکا و همکاران (2019) در مطالعهای اثر 4 هفته تمرین استقامتی سبک را در موشهای بدون ضایعه (اختلال در مسیر اتوفاژی- لیزوزوم (Autophagy-lysosomal pathway) را مورد بررسی قرار دادند. یافتهها نشان داد تمرینات استقامتی باعث افزایش فعالیت و پایداری در حین راه رفتن میشود و هومئوستاز دوپامینرژیک و آلفا سینوکلئین را بهبود، بدون آنکه باعث تحریک مسیر اتوفاژی-لیزوزوم مغزی شود (16). شفیعی و همکاران (2022) اثر تمرینات تناوبی با شدت متوسط بر وضعیت آنزیمهای آنتیاکسیدانی در بافت هیپوکامپ موشهای صحرائی وابسته به متآمفتامین مورد بررسی قرار دادند و نتایج آنها نشان داد تمرینات ورزشی باعث کاهش اثرات مخرب ناشی از تزریق متآمفتامین میشود (17). در حال حاضر، مطالعات محدودی اثر تمرینات تناوبی و شاخصهای موثر بر بیماری آلزایمر در موشهای وابسته به متآمفتامین که اثرات مخربی بر هیپوکامپ میگذارد را مورد سنجش قرار دادهاند. آیا تمرین تناوبی شدید به عنوان یک عامل پیشگیریکننده یا درمانی برای بهبود اثرات مخرب متآمفتامین بر نورونهای سیستم عصبی مرکزی (هیپوکامپ) موثر است؟
روش بررسی
در این پژوهش تجربی - آزمایشگاهی، 32 سر موش صحرائینر ویستار با میانگین وزنی20±180 گرم از مرکز آزمایشگاه حیوانات دانشگاه علوم پزشکی کرمان خریداری و تحت چرخه خواب و بیداری (12ساعت روشنایی و 12 ساعت تاریکی) و رطوبت 40 تا 60 درصد و درجه حرارت 2±21 درجه سانتیگراد نگهداری شدند. موشها در طول دورههای تزریق و تمرین ورزشی دسترسی آزاد به آب و غذا داشتند. موشها با روش تصادفی ساده به چهار گروه 8 تایی شامل گروه سالین (Saline)، گروه متآمفتامین اولیه (METH-1)، گروه مت¬آمفتامین + تمرین تناوبی شدید (METH+HIT) و گروه متآمفتامین ثانویه (METH-2) تقسیم شدند. البته گروه متآمفتامین ثانویه (METH-2) جهت بررسی اثر زمان در دوره تمرین وجود داشت. سپس، رتها بهمدت یک هفته دوره آشنایی با محیط آزمایشگاه و نوارگردان را انجام دادند. تزریق درون صفاقی محلول سالین (0/9 درصد تزریقی) و مت-آمفتامین هیدروکلراید (خلوص< 96 درصد مرکز ملی مواد مخدر کرمان، ایران) بهترتیب در گروههای سالین، METH- 1 ,2 وMETH+HIT انجام شد. METH با دوز 5 میلی¬گرم بر کیلوگرم وزن بدن روزانه یکبار بهمدت 21 روز (دوز کلی تزریق 105 میلیگرم بر کیلوگرم) القاء شد (17). موشهای صحرائی 24 ساعت بعد از آخرین جلسه تزریق (انتهای 21 روز) گروه¬های سالین و METH-1 و تمرین (انتهای 8 هفته) گروههای METH-2 وMETH+HIT، با گاز CO2 بیهوش و سپس آتانازی شدند.
پروتکل تمرین: قبل از اجرای برنامه تمرینی، موشهای صحرایی آزمون ورزشی فزاینده را تا مرز خستگی انجام دادند. در ابتدا، 5 دقیقه گرم کردن بهصورت خیلی آهسته صورت گرفت که تقریباً معادل با 8 متر در دقیقه بر روی تردمیل بود، بعد از گرمکردن، آزمون ورزشی فزاینده تا مرز خستگی با سرعت ده متر در دقیقه شروع شد و به ازای هر دو دقیقه، سه متر بر سرعت تردمیل افزوده شد تا حیوانات، دیگر قادر به دویدن نباشند (18). سپس، میانگین سرعت بیشینه موش-های صحرایی در گروه METH+HIT برای طراحی برنامه تمرین محاسبه شد. تمرینات گروه METH+HIT بهمدت 8 هفته و 5 روز در هفته بر روی نوارگردان مخصوص جوندگان در ساعت مشخصی در طول روز انجام شد (18). تمرینات تناوبی با شدت متوسط (85 الی90% سرعت بیشینه) با شیب صفر انجام شد و مدت تمرین در هر جلسه 36 دقیقه بود که شامل 6 دقیقه گرمکردن و سردکردن با شدت 25% سرعت بیشینه بود و برنامه اصلی از دو بخش تناوب شدید 85 الی 90% سرعت بیشینه (4 تناوب، 2 دقیقهای) و تناوب سبک با شدت 30% سرعت بیشینه (4 تناوب، 2 تا 4 دقیقهای) اجرا شد (جدول 1).
جدول1: پروتکل تمرین تناوبی شدید (HIT)

تغییرات پاتولوژیک: مغز موشهای صحرایئ با دقت و بدون آسیب از جمجمــه خــارج و در فرمالدئیــد 10 درصد (MERCK, Germany) قــرار داده شــد. پــس از انجـام مراحـل پـردازش بافتـی، مقاطـع بافتـی بـا ضخامـت 5 میکـرون تهیـه و توسـط هماتوکسـیلین و ائوزیـن رنگآمیـزی شـد. عکسهای هیپوکامـپ توسـط میکروسـکوپ نوری (Olympus CX21FS1, Japan) مجهــز بــه دوربیــن عکس¬برداری (Cannon, Japan) تصویربــرداری شــد. مطالعه تصاویـر توسـط عدسـی شـیئی بـا بزرگنمایـی40 انجـام شـد. تراکـم نورونـی (N/mm3) منطقه CA1 هیپوکامــپ توســط روش دایســکتور محاســبه شد. روش دایســکتور بــه ایــن صــورت اســت کــه در یــک چهــارچــوب مرجــع نورونهــا شــمارش میشــوند، اگــر نورونــی در هــر دو چهــار چــوب باشــد در شــمارش محسـوب نمیشـود، امـا اگـر نورونـی در چهـار چـوب مرجـع باشـد ولـی در چهـار چـوب بعـدی نباشـد، شـمارش می-شـود (تعــداد نمونههای شــمارش شده، n=5 بــرای تمــام گروهها)(19).
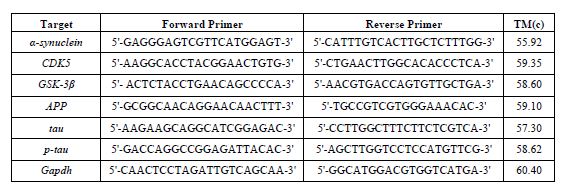
سنجش بیان ژنها: 50 میلیگرم بافت هیپوکامپ برای استخراج RNA با استفاده از محلول ترایزول (یکتا تجهیز آزما) لیز شد و با دستگاه همگنکننده بافت کاملا هموژن شد و براساس دستورالعمل کیت برای جداسازی RNA از کلروفرم و ایزوپروپانول و شستشوی آن، از اتانول 75 درصد استفاده گردید. کل نمونهها با دستگاه پیکودراپ (picodrop limited, Hinxton, United Kingdom) جهت اندازه-گیری RNA و سنجش غلظت در طول موجهای 280/260 و 280/230 مورد سنجش قرار گرفتند. سنتز cDNA با استفاده از کیت cDNA Synthesis (Yektatajhiz) ، به شماره (Cat No: YT4500) و بر اساس پروتکل سنتزcDNA موجود در کیت انجام شد. با اضافه کردن RNase inhibitor جهت از بین بردن آلودگی، سنتز cDNA در دستگاه PCR ساخت شرکت Analitik Jena انجام گردید. به منظور اندازهگیری سطح بیان ژن¬های مربوطه از روش Real Time-PCR (qRT-PCR) با کمک آنزیم Real Q Plus 2x Master Mix Green محصول شرکت (Ampliqon SYBR green Master Mix High ROX) ساخت کشور دانمارک و با استفاده از دستگاه real time PCR مدل Rotor Gene Q ساخت کمپانی QIAGEN صورت گرفت. پروتکل دمایی بهصورت دناتوراسیون اولیه در دمای 95 درجه سانتیگراد بهمدت 15 دقیقه، به دنبال آن 40 چرخه متوالی بهصورت دناتوراسیون در دمای 95 درجه سانتیگراد به مدت 10 ثانیه، 60 درجه سانتیگراد به مدت 20 ثانیه و 72 درجه سانتیگراد به مدت 20 ثانیه انجام شد. توالی پرایمرهای مورد استفاده در این پژوهش توسط نرمافزار آنلاین Primer-BLAST(NCBI) طراحی شدهاند و توالی بازهای پرایمرها در جدول 2 ارائه شده و همچنین از ژن (Gapdh) به عنوان ژن کنترل داخلی استفاده شد. تجزیه و تحلیل دادهها براساس مقایسه چرخه آستانه (CT) انجام میشود. منحنی تکثیر هر واکنش PCR با منحنی تکثیر ژن مرجع Gapdh مربوطه نرمالیزه شد. در این مطالعه، اختلاف CT بهدست آمده از نمونههای مورد آزمایش و نمونههای کنترل محاسبه و با استفاده از فرمول∆∆CT-2 نسبت ژن هدف به ژن مرجع محاسبه شده است.
جدول2: پرایمرهای مورد استفاده در پژوهش
تجزیه و تحلیل آماری
کلیه نتایج بهصورت (انحراف استاندارد ± میانگین) بیان و جهت بررسی توزیع نرمال بودن دادهها از آزمون شاپیروویلک و برای مقایسه تفاوت بین گروهها از آزمون آماری تحلیل واریانس یکطرفه و آزمون تعقیبی توکی در سطح معنیداری (0/05≥P) استفاده شد. کلیه محاسبات آماری از طریق نرمافزار آماری GraphPad Prism نسخه 9 انجام شد.
نتایج
نتایج بیان ژن نشان داد تزریق METH باعث افزایش معنیدار شاخص α-syn به ترتیب در گروههای METH-1,2 نسبت به گروه سالین شد (0/005≥p; P0/001≥, P)؛ همچنین گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/522≥P). تمرینات HIT توانست میزان بیان α-syn بهطور معنیداری نسبت به گروه METH-2 کاهش دهد (0/036≥P) ولی این کاهش در نسبت به گروه METH-1 معنادار نبود (0/111≥P)(شکل1:A). همچنین تزریق METH باعث افزایش معنیدار شاخص GSK-3β به ترتیب در گروههای METH-1,2 نسبت به گروه سالین شد (0/001≥; P0/001≥P) و تمرینات تناوبی شدید توانست میزان بیان GSK-3β بهطور معنی¬داری نسبت به گروه METH-1,2کاهش دهد (0/020≥ ; P0/007≥P). همچنین گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/671≥P)(شکل1:B). تزریق METH باعث افزایش معنیدار شاخص CDK5 به ترتیب در گروه¬های METH-1,2 نسبت به گروه سالین شد (0/001≥; P0/001≥P) و تمرینات HIT توانست میزان بیان CDK5 بهطور معنیداری نسبت به گروه METH-1,2کاهش دهد (0/006≥; P0/034≥P). همچنین گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/250≥P)(شکل1:C). تزریق METH باعث افزایش معنیدار در شاخص APP به ترتیب در گروههای METH-1,2 نسبت به گروه سالین شد (0/006≥; P0/004≥P) و انجام تمرین تناوبی شدید در گروه METH+HIT باعث کاهش معنیدار شاخص APP نسبت به گروه METH-1,2 شد (0/046≥;P0/031≥P). همچنین بیان ژن APP در گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/815≥P)(شکل1:D). نتایج بیان ژنهای Tau و p-Tau به ترتیب نشان داد؛ با تزریق METH افزایش معنیدار در گروههای METH-1,2 نسبت بهگروه سالین داشتند (0/002≥,P0/031≥;P0/002≥,P0/001≥P). تمرینات HIT توانست میزان بیان ژن Tau نسبت به گروه METH-1 به طور معناداری کاهش دهد (0/026≥P)؛ همچنین بیان ژن Tauدر گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/703≥P)(شکل1:E). همچنین تمرینات HIT در گروه METH+HITمیزان بیان ژن p-Tau را نسبت به گروه METH-1,2 کاهش داد (0/036≥; P0/009≥P)؛ اما بیان ژن p-Tauدر گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (655/0≥P) (شکل1:F). نتایج بررسی¬های پاتولوژیک بافت ناحیه CA1 هیپوکامپ حیوانات تحت تیمار با متآمفتامین و ورزش نشان داد که متآمفتامین (METH-1,2) موجب افزایش دژنراسیون نورونی در این ناحیه در مقایسه با گروه سالین شده، بهطوری که شمارش نورونی تفاوت معنیداری را بین این گروهها نشان داد (0/001≥; P0/001≥P). از طرفی تمرینات HIT به ترتیب در گروههای METH-1,2 منجر به کاهش معنادار تعداد نورون دژنره شد(0/029≥p; P0/001≥P) (شکل3).

شکل1: شاخص¬های بیان ژنی α-syn، GSK-3β ، CDK5 ، APP، Tau و p-Tau در موشهای وابسته به متآمفتامین. METH بهطور قابلتوجهی شاخص¬های α-syn، GSK-3β ، CDK5 ، APP، Tau و p-Tau را افزایش داد (A-F)؛ تمرینات (HIT) میزان بیان ژنهای تحقیق حاضر را کاهش داد *p<0.05)؛ **p<0.01؛ .(***p<0.001 دادهها به صورت انحرافمعیار± میانگین در هر گروه(n=8) ؛ ANOVA یک طرفه و به دنبال آن آزمون تعقیبی توکی) نشان داده شده است.
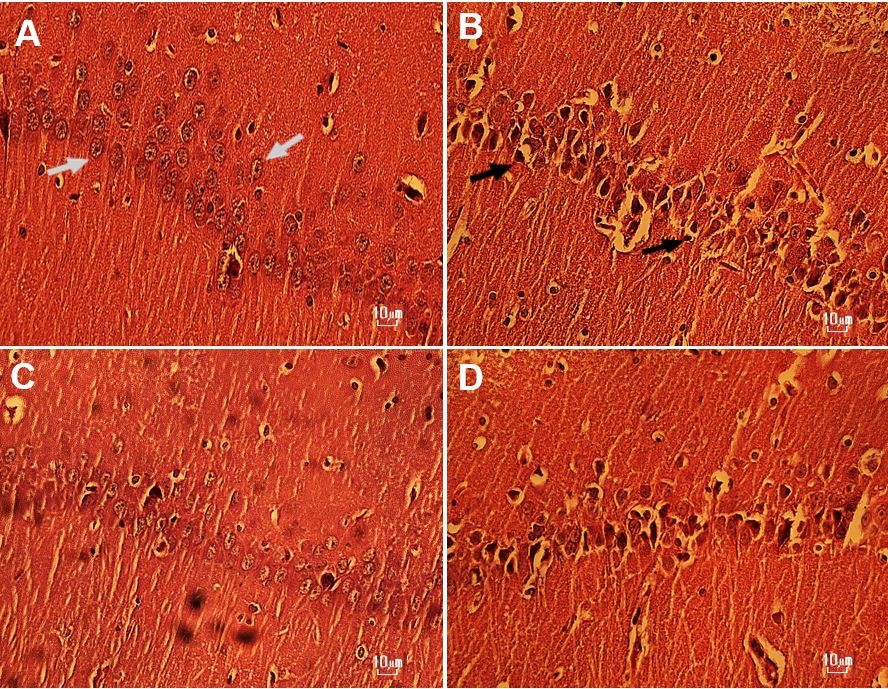
شــکل2: تصویر میکروسکوپی ناحیه CA1 هیپوکامپ گروه¬های سالین(A)، METH-1(B)، METH+HIT (C) و METH-2 (D).
در تصویر ساختار بافتشناسی ناحیه CA1 هیپوکامپ نشان داده شده است و فلش سفید نورون سالم و فلش سیاه نورون دژنره را نشان می¬دهند.
رنگآمیزی: هماتوکسیلین-ائوزین بزرگ نمایی: 40x
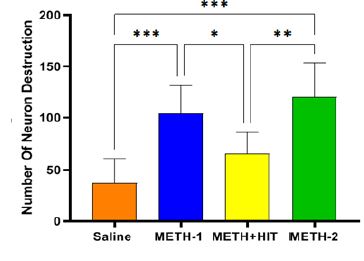
شــکل3: بررسی هیستوپاتولوژیک ناحیه CA1 هیپوکامپ حیوانات وابسته به متآمفتامین.METH بهطور قابلتوجهی نورونهای دژنره شده را افزایش داد. تمرینات HIT بهطور قابلتوجهی نورونهای دژنره شده را کاهش داد *p<0.05)؛ **p<0.01؛ .(***p<0.001دادهها بهصورت انحرافمعیار± میانگین در هر گروه(n=5) ؛ ANOVA یک طرفه و بهدنبال آن آزمون تعقیبی توکی) نشان داده شده است.
بحث
نتایج بیان ژنی در بافت هیپوکامپ نشان داد همراه با تزریقMETH بهطور معناداری بیان شاخصهای α-syn، GSK-3β، CDK5، APP، Tau و p-Tau افزایش مییابد؛ اما تمرینات (HIT) میزان بیان ژنهای تحقیق حاضر را بهطور معناداری کاهش داد؛ همچنین تفاوت معناداری بین شاخصهای تحقیق حاضر در گروه تمرین تناوبی شدید با گروه سالین مشاهده نشد. مطالعــات نشــان دادنــد کــه METH ســبب القــای بیماریهــای تحلیــل برنــده عصبــی همچون آلزایمر، پارکینسون و غیره در انسان میشود. ایزاوا و همکاران (2006) نشان دادند متآمفتامین در موش-های صحرایی سبب کاهش حافظه، گیجی و فراموشی میگردد و مصرف بلندمدت METH سبب تخریب پایانههای عصبی دوپامینرژیک و سروتونرژیک در مغز می¬شود (20). شفاهی و همکاران (2019) کاهش حافظه فضایی و غیرفضایی بهواسطه کوچکشدن هیپوکامپ مغز و مرگ سلولی نورون ها توسط METH را گزارش کردند (21). تجمع α-synناشی METH بهطور مستقیم منجر به آسیب میتوکندری، تخریب غلاف میلین و نارسایی تشکیل وزیکولهای سیناپسی میشود و به طور غیرمستقیم می¬تواند از طریق فعال کردن بیش از اندازه CDK5و GSK-3β از طریق فعالیت این دو کیناز منجر به افزایش فسفوریلاسیون تائوp-tau) ) و بلوکهکردن اتوفاژی شود (22). اثر مت¬آمفتامین به طور هم افزایی میتوانند باعث افزایش تحلیل سلولهای عصبی ناشی از متآمفتامین شود. به نظر میرسد با تزریق METHبه موشهای صحرائی، کمپلکس CDK5 با P25 تشکیل شده است (23). در مطالعه والیان و همکاران (2018) تزریق متآمفتامین بهمدت 14 روز بهصورت افزایشی انجام شد و سپس شاخصهای مسیر پیام-رسانی انسولین از جمله گیرندهها و GSK-3βمورد سنجش قرار گرفتند. نتایج آنها نشان داد؛ GSK-3β یک روز بعد از آخرین تزریق هیچ تغییری نداشت. اما 28 روز بعد از آخرین تزریق، شاخص GSK-3β افزایش معناداری نشان داد که با تحقیق حاضر ناهمسو میباشد. احتمالاً کسب این نتیجه می-تواند ناشی از بافت هدف (ماده سیاه و جسم مخطط) و میزان دوز تزریقی متآمفتامین باشد (24). احتمالاً در مطالعه حاضر میزان فعالیت این دو کیناز CDK5و GSK-3β خیلی افزایش داشته و در نهایت منجر به افزایش APPو سپس فسفوریله شدن بیش از اندازه Tau شده است و احتمالا" تمرینات HITمنجر به کاهش فعالیت CDK5 و GSK-3β شده است. با اتصال انسولین به گیرنده خود دو مسیر اصلی PI3K/AKT و MAPK فعال میشود. بهنظر میرسد تزریق METH مسیر پیامرسانی انسولین را مختل کرده و منجر به افزایش بیان GSK-3β شده است و در نهایت افزایش APP و p-Tau را بهدنبال داشته است که همسو با مطالعه چن و همکاران بوده است (12). مطالعات نشان داده است کاهش انرژی در دسترس میتواند موجب اختلال در تولید پروتئینهای پیشساز آمیلوئید و بنابراین تجمع پلاکهای بتا-آمیلوئید گردد (25). در بیماری آلزایمر، کاهش نورونها در چندین منطقه مهم یادگیری و حافظه به خصوص در هیپوکامپ اتفاق میافتد. بنابراین، مسیرPI3K/Akt در مغز یک سیگنالینگ مهم انسولین است که مسئول محافظت از سلولهای عصبی، یادگیری و عملکردهای حافظه است. METH فعالسازی Akt ، یکی از مولکولهای کلیدی در پایین دست مسیر سیگنالینگ PI3K/Akt را غیرفعال میکند(26). بـاکر و همکـاران (2010) اظهار کردند که فعالیت ورزشی احتمالاً از طریق تنظیم فرآیند عملکردی پروتئین پیشساز آمیلوئید و افزایش تخریب و پاکسازی Aβ به کاهش سطوح بتا آمیلویید در مغز منجر میشود و همچنین ورزش ممکن است افزایشدهنده تجزیه APP باشد. از آنجاییکه فعالیت ورزشی، بسیاری از فرآوردههـای ژنـی را هــم در ســطح mRNA و هــم در ســطح پــروتئین، تعــدیل میکند؛ این احتمال وجود دارد که چندین مسیر ممکـن است برای تنظیم سطح آمیلوئید بهطور مستقیم و یـا غیرمستقیم فعـال باشـد (27). یـک احتمـال ایـن اسـت کـه ورزش میتواند فعالیت پروتئازوم را به طـور مثبـت تنظـیم کنـد و در نتیجه میتواند تخریب قطعات پروتئولیتیکی APP را در پـی داشته باشد. احتمال دوم این است که ورزش بهطور مـستقیم متابولیــسم APP را بــا اســتفاده از افــزایش فعالیــت نــورونی از طریق فعالسازی مسیر IRS-1/PI3K/Akt تعدیل میکند (28). از طـرف دیگـر، احتمـالاً فعالیـت بـدنی میتواند اختلالات رفتاری را با کاهش مقـادیر پپتیـد 42Aβ- از طریق افـزایش سـاخت عامـلهـای نوروتروفیـک NGF،BDNF و IGF-1 که برای بقاء نـورونی، تکثیـر نـورونی و شکلپذیری سیناپسی دارای اهمیت هستند، بهبود بخشد (29). در واقع مطالعات محدودی اثر مستقیم ارتباط تمرینات ورزشی، METH و شاخصهای α-syn، CDK5، GSK-3β، APP،Tau ، p-Tau را مورد بررسی قرار دادهاند. شفیعی و همکاران (2022) در مطالعهای مشابه اثر تمرینات تناوبی با شدت متوسط بر وضعیت آنزیمهای آنتیاکسیدانی و حافظه فضایی موشهای وابسته به مت¬امفتامین مورد بررسی قرار دادند که نتایج آنها نشان داد متآمفتامین سبب ایجاد نوروتوکسیتی (Neurotoxicity) و منجر به کاهش حافظه فضایی و دفاع آنزیمهای آنتیاکسیدانی به واسطه افزایش استرس اکسیداتیو در سطح سلول شد و انجام تمرینات MIT منجر به کاهش بیان ژنهای α-syn ، CDK5 ، Tauو p-Tau در بافت هیپوکامپ شد (17). که نتایج آنها همسو با تحقیق حاضر بود. عدم سنجش حافظه فضایی (آزمون رفتاری ماز آبی موریس) و آنزیمهای آنتیاکسیدانی از محدودیت¬های تحقیق حاضر میباشد. بهنظر میرسد نیاز به تحقیقات بیشتری در ارتباط با نوع، شدت و زمان اثرگذاری تمرینات ورزشی احساس میشود. سومکوار و همکاران (2015) نشان دادند استفاده از METH در مدل¬های حیوانی به دلیل تولید گونههای فعال اکسیژن سبب ایجاد استرس¬اکسیداتیو و نوروتوکسیتی میشود؛ زیرا رادیکالهای آزاد بهطور طبیعی به وسیله آنزیم¬های آنتی¬اکسیدان داخل سلولی همچون سوپراکسید دیسموتاز، گلوتاتیون پراکسیداز و کاتالاز برداشته و حذف میشوند (30). احتمالاً " METH در هیپوکامپ موشهای تحقیق حاضر منجر به استرس اکسیداتیو شده است و بهدنبال آن باعث فعال شدن مسیر آپوپتوزیس (مسیر داخلی و خارجی) و تخریب نورونی شده است. یکی از محدودیتهای پژوهش حاضر عدم سنجش میزان بیان ژنی Caspases-3 است. بررسیهای هیستوپاتولوژیک در منطقه CA1 هیپوکامپ موشهای صحرائی نشان داد که تزریق متآمفتامین منجر به تخریب نورونها شده است و تمرینات HIT تا حدودی باعث پیشگیری از تخریب نورونها در منطقه CA1 هیپوکامپ موشهای صحرائی شده است. بهنظر میرسد نوروتوکسیتی در هیپوکامپ موشهای صحرائی گروه METH اتفاق افتاده است. هاماکاوا و همکاران (2013) نشان دادند که 3 هفته فعالیت ورزشی موجب کاهش سطح رادیکالهای آزاد میشود که با کاهش اختلالات حرکتی ناشی از آن همراه خواهد بود (31). اوگونوفسکی و همکاران (2005) نشان دادند، ورزش با شدت متوسط (1 ساعت شنا در روز به مدت 8 هفته) هم ظرفیت آنتیاکسیدانی و هم مقاومت در برابر استرس اکسیداتیو را در بدن افزایش میدهد و عملکرد حافظه موش¬های صحرائی را بهبود میبخشد (32). سومکوار و همکاران (2015) عنوان کردند فعالیت ورزشی هوازی با افزایش آنتیاکسیدانهای سلولهای عصبی، میتواند موجب کاهش استرس اکسیداتیو و افزایش مقاومت نورونهای ناحیه هیپوکامپ در برابر آسیبهای ناشی از متآمفتامین شود (30). این مکانیسمهای نوروپروتکتیو فعالیت ورزشی، یک دیدگاه درمانی نوین و یک نقطه نظر مهم پیشگیرانه را فراهم میکند و به عنوان روشی مؤثر و راهبردی مفید در کاهش عوارض مغزی ناشی از METH میباشد. کامیلتی و همکاران (2013) عنوان کردند که تمرین ورزشی، فعالیت پایه برخی از آنزیمهای آنتیاکسیدانی را افزایش میدهد و بهعنوان آنتیاکسیدانهای مستقیم و غیرمستقیم، انواع گونههای اکسیدکننده را خنثی میکنند و از سلولها در برابر آسیب استرس اکسیداتیو محافظت میکند (33). احتمالا" هشت هفته تمرین HIT توانسته میزان آنزیمهای آنتیاکسیدانی را افزایش دهد و اثرات مخرب استرس اکسیداتیو ناشی از METH را تعدیل کند.
نتیجهگیری
احتمالاً تزریق METH میتواند با افزایش α-syn،CDK5، GSK-3β، APP،Tau ، p-Tau باعث ایجاد اختلال در فعالیت نورونی شود. بنابراین افراد درگیر در این شکل از اعتیاد میتوانند برای جلوگیری از تخریب بیشتر نورونی و کاهش عوارض ماده مخدر (شیشه) بر بافت هیپوکامپ و بیماری آلزایمر از تمرینات تناوبی شدید استفاده کنند. همچنین بهنظر میرسد تمرین HIT باعث بهبود نورونها ناحیه هیپوکامپ شده است. علاوه بر این، استفاده از ورزش بهعنوان یک مداخله درمانی نیاز به تحقیقات بیشتری دارد که میتواند دستورالعملهای دقیقی (به عنوان مثال، شدت، تواتر، مدت، نوع ورزش) برای انواع مختلف اختلالات مصرف مواد مخدر ارائه دهد.
سپاسگزاری
این مقاله مستخرج از پایاننامه دوره دکتری رشته فیزیولوژی ورزشی می باشد؛ محققین از مسئولین مرکز تحقیقات علوم و اعصاب دانشگاه علوم پزشکی کرمان و تمامی کسانی که ما را در اجرای تحقیق حاضر همراهی نمودهاند کمال تشکر و قدردانی را ابراز میدارند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
کد اخلاق و ملاحظات اخلاقی
پروپوزال این مطالعه در کمیته اخلاق دانشگاه حکیم سبزواری تائید شده است. (کد اخلاق IR.HSU.AEC.1401.008)
مشارکت نویسندگان
خانم بهرامی، آقای شهرآبادی و شفیعی در ایده پژوهشی، طراحی مطالعه، نوشتن نسخه اولیه و مراحل اجرایی تمرین و جمعآوری داده و تفسیر دادهها مشارکت داشتند. آقایان دکتر حقیقی، اسدی و شفیعی ایده پژوهشی، طراحی مطالعه، همچنین اصلاحات و بازبینی متن از لحاظ محتوای علمی و تایید نسخه نهایی دستنوشته قبل از انتشار بر عهده داشتند و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
متآمفتامین (Methamphetamine) دارویی اعتیادآور و محرک است که بـه دلیـل دارا بـودن احســاس لــذت و سرخوشــی مــورد توجــه اکثــر مــردم بهویــژه جوانــان و نوجوانــان بــوده اســت (1). هــر چنــد مکانیسـمهای تخریـب سـلولهای عصبـی در نتیجـه مصـرف متآمفتامین در سیســتم عصبــی مرکــزی بــهطــور دقیــق مشـخص نشـده اسـت امـا تحقیقـات نشـان دادهاند کـه اسـترس اکسیــداتیو، القای آپوپتوز، فعالسازی میکروگلیا، هیپرترمــی و غیره در ایــن امــر دخیــل میباشــند (2,3). در واقــع متآمفتامین از طریـق بهـم ریختـن سیسـتم آنتیاکسـیدانی سـلولهای عصبـی منجـر بـه ایجـاد اسـترس اکسـیداتیو و در نهایــت مــرگ ســلولی میشــود (4,5). آنزیمهای کلیدی این سیســتم شامل سوپراکسید دیسموتاز (Superoxide dismutase)،کاتالاز (Catalase) و گلوتاتیون پراکســیداز (glutathione peroxidase) میباشند و خصوصیت مهم این آنزیمها، قابل القاء بودن آنها تحت شرایط استرس اکسیداتیو است (6,7). آلفا-سینوکلئین (α-synuclein)، پروتئینی غنی شده میباشد؛ که در پایانههای پیشسیناپسی عصبی و در میتوکندری وجود دارند. در چندین بیماری تخریب عصبی شامل زوال عقل با اجسام لویی (Dementia with Lewy bodies) ، آتروفی سیستم چندگانه (Multiple system atrophy) و بیماری آلزایمر(Alzheimer disease) و پارکینسون (Parkinson disease) نقش مهمی دارد (8). آلفاسینوکلئین (α-syn) پس از مسمومیت با METH در هیپوکامپ و ماده سیاه (Substantia nigra) تجمع مییابد. برخی تغییرات خاص پس از ترجمه از جمله فسفوریلاسیون، فراگیر شدن سمیت و نیتروسیلاسیون α-syn ممکن است باعث جمع شدن آنها شود (9). α-syn که توسط سلولهای عصبی ترشح میشود، ممکن است سلول¬های میکروگلیا را در درجات مختلف فعال کند (10). پاتولوژیک α- syn و فعالشدن میکروگلیایی با تقویت یکدیگر میتوانند منجر به تخریب عصبی شوند (11). با اینحال، اثرات METH در مسیر سیگنالینگ انسولین و بیان پروتئینهای پاتولوژیک مرتبط با بیماری آلزایمر (AD)، از جمله پروتئین پیشساز آمیلوئید (APP) وp-tau ، بهخوبی شناخته شده نیست (12). با اتصال METH به گیرنده انسولین، فعالیت تیروزینکینازی زیر واحد بتا آغاز و به دنبال آن مسیرهای پایین دستی Akt و PI3K غیرفعال میشوند. عدم فعال شدن آنها باعث افزایش GSK-3β شده و این مسیر باعث افزایش پروتئین پیشساز آمیلوئید (APP)و p-tau میشود که در نهایت کاهش عملکرد شناختی (حافظه و یادگیری) را بهدنبال دارد (2,13). با این حال، نقش التهاب عصبی به واسطه α-syn ناشی از METH نیاز به مطالعه بیشتر دارد. یک فرضیه بیان میکند که تجمع α-syn ناشی از METH ممکن است بهطور مستقیم منجر به آسیب میتوکندری، تخریب غلاف میلین و نارسایی تشکیل وزیکولهای سیناپسی شده و اثر غیرمستقیم میتواند از طریق فعالکردن بیش اندازه CDK5 و GSK-3β منجر به فسفوریلاسیون تائوp-tau) ) و بلوکه کردن اتوفاژی شود. هر دو مسیر بهطور همافزایی می¬توانند باعث افزایش تحلیل سلولهای عصبی ناشی ازMETH شوند (14). سمیت در سلولهای عصبی به واسطه متآمفتامین می تواند منجر به تخریب عصبی و در نهایت بهوجود آورنده بیماری آلزایمر در افراد شود. لذا جلوگیری از ایجاد بیماری آلزایمر در اثر متآمفتامین از اهمیت بالایی برخودار است. از بین راهکارهای درمانی که برای اثرات نوروتوکسیک مت¬آمفتامین ، مطرح شده است و در این زمینه، مطالعات نشان میدهد که ورزش و فعالیت بدنی پایدار میتواند به عنوان یک مداخله برای کاهش اثرات مخرب مت-آمفتامین مورد استفاده قرار گیرد. بنابراین، به نظر میرسد که متآمفتامین عملکرد طبیعی مغز را مختل میکند و ورزش از این اختلال جلوگیری یا آن را کاهش میدهد. تجمع آلفا سینوکلئین به طور قابل توجهی باعث وجود نقصهای حرکتی می شود؛ که اصلیترین علامت بیماری پارکینسون است، یافتهها نشان میدهد که تمرین استقامتی سطح α-Syn را کاهش داده، که متعاقباً باعث از بین رفتن نورونهای دوپامینرژیک (DAergic) و مرگ سلولی (آپوپتوز با واسطه(α-Syn میشود (15). میناکاکا و همکاران (2019) در مطالعهای اثر 4 هفته تمرین استقامتی سبک را در موشهای بدون ضایعه (اختلال در مسیر اتوفاژی- لیزوزوم (Autophagy-lysosomal pathway) را مورد بررسی قرار دادند. یافتهها نشان داد تمرینات استقامتی باعث افزایش فعالیت و پایداری در حین راه رفتن میشود و هومئوستاز دوپامینرژیک و آلفا سینوکلئین را بهبود، بدون آنکه باعث تحریک مسیر اتوفاژی-لیزوزوم مغزی شود (16). شفیعی و همکاران (2022) اثر تمرینات تناوبی با شدت متوسط بر وضعیت آنزیمهای آنتیاکسیدانی در بافت هیپوکامپ موشهای صحرائی وابسته به متآمفتامین مورد بررسی قرار دادند و نتایج آنها نشان داد تمرینات ورزشی باعث کاهش اثرات مخرب ناشی از تزریق متآمفتامین میشود (17). در حال حاضر، مطالعات محدودی اثر تمرینات تناوبی و شاخصهای موثر بر بیماری آلزایمر در موشهای وابسته به متآمفتامین که اثرات مخربی بر هیپوکامپ میگذارد را مورد سنجش قرار دادهاند. آیا تمرین تناوبی شدید به عنوان یک عامل پیشگیریکننده یا درمانی برای بهبود اثرات مخرب متآمفتامین بر نورونهای سیستم عصبی مرکزی (هیپوکامپ) موثر است؟
روش بررسی
در این پژوهش تجربی - آزمایشگاهی، 32 سر موش صحرائینر ویستار با میانگین وزنی20±180 گرم از مرکز آزمایشگاه حیوانات دانشگاه علوم پزشکی کرمان خریداری و تحت چرخه خواب و بیداری (12ساعت روشنایی و 12 ساعت تاریکی) و رطوبت 40 تا 60 درصد و درجه حرارت 2±21 درجه سانتیگراد نگهداری شدند. موشها در طول دورههای تزریق و تمرین ورزشی دسترسی آزاد به آب و غذا داشتند. موشها با روش تصادفی ساده به چهار گروه 8 تایی شامل گروه سالین (Saline)، گروه متآمفتامین اولیه (METH-1)، گروه مت¬آمفتامین + تمرین تناوبی شدید (METH+HIT) و گروه متآمفتامین ثانویه (METH-2) تقسیم شدند. البته گروه متآمفتامین ثانویه (METH-2) جهت بررسی اثر زمان در دوره تمرین وجود داشت. سپس، رتها بهمدت یک هفته دوره آشنایی با محیط آزمایشگاه و نوارگردان را انجام دادند. تزریق درون صفاقی محلول سالین (0/9 درصد تزریقی) و مت-آمفتامین هیدروکلراید (خلوص< 96 درصد مرکز ملی مواد مخدر کرمان، ایران) بهترتیب در گروههای سالین، METH- 1 ,2 وMETH+HIT انجام شد. METH با دوز 5 میلی¬گرم بر کیلوگرم وزن بدن روزانه یکبار بهمدت 21 روز (دوز کلی تزریق 105 میلیگرم بر کیلوگرم) القاء شد (17). موشهای صحرائی 24 ساعت بعد از آخرین جلسه تزریق (انتهای 21 روز) گروه¬های سالین و METH-1 و تمرین (انتهای 8 هفته) گروههای METH-2 وMETH+HIT، با گاز CO2 بیهوش و سپس آتانازی شدند.
پروتکل تمرین: قبل از اجرای برنامه تمرینی، موشهای صحرایی آزمون ورزشی فزاینده را تا مرز خستگی انجام دادند. در ابتدا، 5 دقیقه گرم کردن بهصورت خیلی آهسته صورت گرفت که تقریباً معادل با 8 متر در دقیقه بر روی تردمیل بود، بعد از گرمکردن، آزمون ورزشی فزاینده تا مرز خستگی با سرعت ده متر در دقیقه شروع شد و به ازای هر دو دقیقه، سه متر بر سرعت تردمیل افزوده شد تا حیوانات، دیگر قادر به دویدن نباشند (18). سپس، میانگین سرعت بیشینه موش-های صحرایی در گروه METH+HIT برای طراحی برنامه تمرین محاسبه شد. تمرینات گروه METH+HIT بهمدت 8 هفته و 5 روز در هفته بر روی نوارگردان مخصوص جوندگان در ساعت مشخصی در طول روز انجام شد (18). تمرینات تناوبی با شدت متوسط (85 الی90% سرعت بیشینه) با شیب صفر انجام شد و مدت تمرین در هر جلسه 36 دقیقه بود که شامل 6 دقیقه گرمکردن و سردکردن با شدت 25% سرعت بیشینه بود و برنامه اصلی از دو بخش تناوب شدید 85 الی 90% سرعت بیشینه (4 تناوب، 2 دقیقهای) و تناوب سبک با شدت 30% سرعت بیشینه (4 تناوب، 2 تا 4 دقیقهای) اجرا شد (جدول 1).
جدول1: پروتکل تمرین تناوبی شدید (HIT)

تغییرات پاتولوژیک: مغز موشهای صحرایئ با دقت و بدون آسیب از جمجمــه خــارج و در فرمالدئیــد 10 درصد (MERCK, Germany) قــرار داده شــد. پــس از انجـام مراحـل پـردازش بافتـی، مقاطـع بافتـی بـا ضخامـت 5 میکـرون تهیـه و توسـط هماتوکسـیلین و ائوزیـن رنگآمیـزی شـد. عکسهای هیپوکامـپ توسـط میکروسـکوپ نوری (Olympus CX21FS1, Japan) مجهــز بــه دوربیــن عکس¬برداری (Cannon, Japan) تصویربــرداری شــد. مطالعه تصاویـر توسـط عدسـی شـیئی بـا بزرگنمایـی40 انجـام شـد. تراکـم نورونـی (N/mm3) منطقه CA1 هیپوکامــپ توســط روش دایســکتور محاســبه شد. روش دایســکتور بــه ایــن صــورت اســت کــه در یــک چهــارچــوب مرجــع نورونهــا شــمارش میشــوند، اگــر نورونــی در هــر دو چهــار چــوب باشــد در شــمارش محسـوب نمیشـود، امـا اگـر نورونـی در چهـار چـوب مرجـع باشـد ولـی در چهـار چـوب بعـدی نباشـد، شـمارش می-شـود (تعــداد نمونههای شــمارش شده، n=5 بــرای تمــام گروهها)(19).
سنجش بیان ژنها: 50 میلیگرم بافت هیپوکامپ برای استخراج RNA با استفاده از محلول ترایزول (یکتا تجهیز آزما) لیز شد و با دستگاه همگنکننده بافت کاملا هموژن شد و براساس دستورالعمل کیت برای جداسازی RNA از کلروفرم و ایزوپروپانول و شستشوی آن، از اتانول 75 درصد استفاده گردید. کل نمونهها با دستگاه پیکودراپ (picodrop limited, Hinxton, United Kingdom) جهت اندازه-گیری RNA و سنجش غلظت در طول موجهای 280/260 و 280/230 مورد سنجش قرار گرفتند. سنتز cDNA با استفاده از کیت cDNA Synthesis (Yektatajhiz) ، به شماره (Cat No: YT4500) و بر اساس پروتکل سنتزcDNA موجود در کیت انجام شد. با اضافه کردن RNase inhibitor جهت از بین بردن آلودگی، سنتز cDNA در دستگاه PCR ساخت شرکت Analitik Jena انجام گردید. به منظور اندازهگیری سطح بیان ژن¬های مربوطه از روش Real Time-PCR (qRT-PCR) با کمک آنزیم Real Q Plus 2x Master Mix Green محصول شرکت (Ampliqon SYBR green Master Mix High ROX) ساخت کشور دانمارک و با استفاده از دستگاه real time PCR مدل Rotor Gene Q ساخت کمپانی QIAGEN صورت گرفت. پروتکل دمایی بهصورت دناتوراسیون اولیه در دمای 95 درجه سانتیگراد بهمدت 15 دقیقه، به دنبال آن 40 چرخه متوالی بهصورت دناتوراسیون در دمای 95 درجه سانتیگراد به مدت 10 ثانیه، 60 درجه سانتیگراد به مدت 20 ثانیه و 72 درجه سانتیگراد به مدت 20 ثانیه انجام شد. توالی پرایمرهای مورد استفاده در این پژوهش توسط نرمافزار آنلاین Primer-BLAST(NCBI) طراحی شدهاند و توالی بازهای پرایمرها در جدول 2 ارائه شده و همچنین از ژن (Gapdh) به عنوان ژن کنترل داخلی استفاده شد. تجزیه و تحلیل دادهها براساس مقایسه چرخه آستانه (CT) انجام میشود. منحنی تکثیر هر واکنش PCR با منحنی تکثیر ژن مرجع Gapdh مربوطه نرمالیزه شد. در این مطالعه، اختلاف CT بهدست آمده از نمونههای مورد آزمایش و نمونههای کنترل محاسبه و با استفاده از فرمول∆∆CT-2 نسبت ژن هدف به ژن مرجع محاسبه شده است.
جدول2: پرایمرهای مورد استفاده در پژوهش

تجزیه و تحلیل آماری
کلیه نتایج بهصورت (انحراف استاندارد ± میانگین) بیان و جهت بررسی توزیع نرمال بودن دادهها از آزمون شاپیروویلک و برای مقایسه تفاوت بین گروهها از آزمون آماری تحلیل واریانس یکطرفه و آزمون تعقیبی توکی در سطح معنیداری (0/05≥P) استفاده شد. کلیه محاسبات آماری از طریق نرمافزار آماری GraphPad Prism نسخه 9 انجام شد.
نتایج
نتایج بیان ژن نشان داد تزریق METH باعث افزایش معنیدار شاخص α-syn به ترتیب در گروههای METH-1,2 نسبت به گروه سالین شد (0/005≥p; P0/001≥, P)؛ همچنین گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/522≥P). تمرینات HIT توانست میزان بیان α-syn بهطور معنیداری نسبت به گروه METH-2 کاهش دهد (0/036≥P) ولی این کاهش در نسبت به گروه METH-1 معنادار نبود (0/111≥P)(شکل1:A). همچنین تزریق METH باعث افزایش معنیدار شاخص GSK-3β به ترتیب در گروههای METH-1,2 نسبت به گروه سالین شد (0/001≥; P0/001≥P) و تمرینات تناوبی شدید توانست میزان بیان GSK-3β بهطور معنی¬داری نسبت به گروه METH-1,2کاهش دهد (0/020≥ ; P0/007≥P). همچنین گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/671≥P)(شکل1:B). تزریق METH باعث افزایش معنیدار شاخص CDK5 به ترتیب در گروه¬های METH-1,2 نسبت به گروه سالین شد (0/001≥; P0/001≥P) و تمرینات HIT توانست میزان بیان CDK5 بهطور معنیداری نسبت به گروه METH-1,2کاهش دهد (0/006≥; P0/034≥P). همچنین گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/250≥P)(شکل1:C). تزریق METH باعث افزایش معنیدار در شاخص APP به ترتیب در گروههای METH-1,2 نسبت به گروه سالین شد (0/006≥; P0/004≥P) و انجام تمرین تناوبی شدید در گروه METH+HIT باعث کاهش معنیدار شاخص APP نسبت به گروه METH-1,2 شد (0/046≥;P0/031≥P). همچنین بیان ژن APP در گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/815≥P)(شکل1:D). نتایج بیان ژنهای Tau و p-Tau به ترتیب نشان داد؛ با تزریق METH افزایش معنیدار در گروههای METH-1,2 نسبت بهگروه سالین داشتند (0/002≥,P0/031≥;P0/002≥,P0/001≥P). تمرینات HIT توانست میزان بیان ژن Tau نسبت به گروه METH-1 به طور معناداری کاهش دهد (0/026≥P)؛ همچنین بیان ژن Tauدر گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (0/703≥P)(شکل1:E). همچنین تمرینات HIT در گروه METH+HITمیزان بیان ژن p-Tau را نسبت به گروه METH-1,2 کاهش داد (0/036≥; P0/009≥P)؛ اما بیان ژن p-Tauدر گروه METH+HIT نسبت به گروه سالین افزایش داشت اما این اختلاف از لحاظ آماری معنادار نبود (655/0≥P) (شکل1:F). نتایج بررسی¬های پاتولوژیک بافت ناحیه CA1 هیپوکامپ حیوانات تحت تیمار با متآمفتامین و ورزش نشان داد که متآمفتامین (METH-1,2) موجب افزایش دژنراسیون نورونی در این ناحیه در مقایسه با گروه سالین شده، بهطوری که شمارش نورونی تفاوت معنیداری را بین این گروهها نشان داد (0/001≥; P0/001≥P). از طرفی تمرینات HIT به ترتیب در گروههای METH-1,2 منجر به کاهش معنادار تعداد نورون دژنره شد(0/029≥p; P0/001≥P) (شکل3).

شکل1: شاخص¬های بیان ژنی α-syn، GSK-3β ، CDK5 ، APP، Tau و p-Tau در موشهای وابسته به متآمفتامین. METH بهطور قابلتوجهی شاخص¬های α-syn، GSK-3β ، CDK5 ، APP، Tau و p-Tau را افزایش داد (A-F)؛ تمرینات (HIT) میزان بیان ژنهای تحقیق حاضر را کاهش داد *p<0.05)؛ **p<0.01؛ .(***p<0.001 دادهها به صورت انحرافمعیار± میانگین در هر گروه(n=8) ؛ ANOVA یک طرفه و به دنبال آن آزمون تعقیبی توکی) نشان داده شده است.

شــکل2: تصویر میکروسکوپی ناحیه CA1 هیپوکامپ گروه¬های سالین(A)، METH-1(B)، METH+HIT (C) و METH-2 (D).
در تصویر ساختار بافتشناسی ناحیه CA1 هیپوکامپ نشان داده شده است و فلش سفید نورون سالم و فلش سیاه نورون دژنره را نشان می¬دهند.
رنگآمیزی: هماتوکسیلین-ائوزین بزرگ نمایی: 40x

شــکل3: بررسی هیستوپاتولوژیک ناحیه CA1 هیپوکامپ حیوانات وابسته به متآمفتامین.METH بهطور قابلتوجهی نورونهای دژنره شده را افزایش داد. تمرینات HIT بهطور قابلتوجهی نورونهای دژنره شده را کاهش داد *p<0.05)؛ **p<0.01؛ .(***p<0.001دادهها بهصورت انحرافمعیار± میانگین در هر گروه(n=5) ؛ ANOVA یک طرفه و بهدنبال آن آزمون تعقیبی توکی) نشان داده شده است.
بحث
نتایج بیان ژنی در بافت هیپوکامپ نشان داد همراه با تزریقMETH بهطور معناداری بیان شاخصهای α-syn، GSK-3β، CDK5، APP، Tau و p-Tau افزایش مییابد؛ اما تمرینات (HIT) میزان بیان ژنهای تحقیق حاضر را بهطور معناداری کاهش داد؛ همچنین تفاوت معناداری بین شاخصهای تحقیق حاضر در گروه تمرین تناوبی شدید با گروه سالین مشاهده نشد. مطالعــات نشــان دادنــد کــه METH ســبب القــای بیماریهــای تحلیــل برنــده عصبــی همچون آلزایمر، پارکینسون و غیره در انسان میشود. ایزاوا و همکاران (2006) نشان دادند متآمفتامین در موش-های صحرایی سبب کاهش حافظه، گیجی و فراموشی میگردد و مصرف بلندمدت METH سبب تخریب پایانههای عصبی دوپامینرژیک و سروتونرژیک در مغز می¬شود (20). شفاهی و همکاران (2019) کاهش حافظه فضایی و غیرفضایی بهواسطه کوچکشدن هیپوکامپ مغز و مرگ سلولی نورون ها توسط METH را گزارش کردند (21). تجمع α-synناشی METH بهطور مستقیم منجر به آسیب میتوکندری، تخریب غلاف میلین و نارسایی تشکیل وزیکولهای سیناپسی میشود و به طور غیرمستقیم می¬تواند از طریق فعال کردن بیش از اندازه CDK5و GSK-3β از طریق فعالیت این دو کیناز منجر به افزایش فسفوریلاسیون تائوp-tau) ) و بلوکهکردن اتوفاژی شود (22). اثر مت¬آمفتامین به طور هم افزایی میتوانند باعث افزایش تحلیل سلولهای عصبی ناشی از متآمفتامین شود. به نظر میرسد با تزریق METHبه موشهای صحرائی، کمپلکس CDK5 با P25 تشکیل شده است (23). در مطالعه والیان و همکاران (2018) تزریق متآمفتامین بهمدت 14 روز بهصورت افزایشی انجام شد و سپس شاخصهای مسیر پیام-رسانی انسولین از جمله گیرندهها و GSK-3βمورد سنجش قرار گرفتند. نتایج آنها نشان داد؛ GSK-3β یک روز بعد از آخرین تزریق هیچ تغییری نداشت. اما 28 روز بعد از آخرین تزریق، شاخص GSK-3β افزایش معناداری نشان داد که با تحقیق حاضر ناهمسو میباشد. احتمالاً کسب این نتیجه می-تواند ناشی از بافت هدف (ماده سیاه و جسم مخطط) و میزان دوز تزریقی متآمفتامین باشد (24). احتمالاً در مطالعه حاضر میزان فعالیت این دو کیناز CDK5و GSK-3β خیلی افزایش داشته و در نهایت منجر به افزایش APPو سپس فسفوریله شدن بیش از اندازه Tau شده است و احتمالا" تمرینات HITمنجر به کاهش فعالیت CDK5 و GSK-3β شده است. با اتصال انسولین به گیرنده خود دو مسیر اصلی PI3K/AKT و MAPK فعال میشود. بهنظر میرسد تزریق METH مسیر پیامرسانی انسولین را مختل کرده و منجر به افزایش بیان GSK-3β شده است و در نهایت افزایش APP و p-Tau را بهدنبال داشته است که همسو با مطالعه چن و همکاران بوده است (12). مطالعات نشان داده است کاهش انرژی در دسترس میتواند موجب اختلال در تولید پروتئینهای پیشساز آمیلوئید و بنابراین تجمع پلاکهای بتا-آمیلوئید گردد (25). در بیماری آلزایمر، کاهش نورونها در چندین منطقه مهم یادگیری و حافظه به خصوص در هیپوکامپ اتفاق میافتد. بنابراین، مسیرPI3K/Akt در مغز یک سیگنالینگ مهم انسولین است که مسئول محافظت از سلولهای عصبی، یادگیری و عملکردهای حافظه است. METH فعالسازی Akt ، یکی از مولکولهای کلیدی در پایین دست مسیر سیگنالینگ PI3K/Akt را غیرفعال میکند(26). بـاکر و همکـاران (2010) اظهار کردند که فعالیت ورزشی احتمالاً از طریق تنظیم فرآیند عملکردی پروتئین پیشساز آمیلوئید و افزایش تخریب و پاکسازی Aβ به کاهش سطوح بتا آمیلویید در مغز منجر میشود و همچنین ورزش ممکن است افزایشدهنده تجزیه APP باشد. از آنجاییکه فعالیت ورزشی، بسیاری از فرآوردههـای ژنـی را هــم در ســطح mRNA و هــم در ســطح پــروتئین، تعــدیل میکند؛ این احتمال وجود دارد که چندین مسیر ممکـن است برای تنظیم سطح آمیلوئید بهطور مستقیم و یـا غیرمستقیم فعـال باشـد (27). یـک احتمـال ایـن اسـت کـه ورزش میتواند فعالیت پروتئازوم را به طـور مثبـت تنظـیم کنـد و در نتیجه میتواند تخریب قطعات پروتئولیتیکی APP را در پـی داشته باشد. احتمال دوم این است که ورزش بهطور مـستقیم متابولیــسم APP را بــا اســتفاده از افــزایش فعالیــت نــورونی از طریق فعالسازی مسیر IRS-1/PI3K/Akt تعدیل میکند (28). از طـرف دیگـر، احتمـالاً فعالیـت بـدنی میتواند اختلالات رفتاری را با کاهش مقـادیر پپتیـد 42Aβ- از طریق افـزایش سـاخت عامـلهـای نوروتروفیـک NGF،BDNF و IGF-1 که برای بقاء نـورونی، تکثیـر نـورونی و شکلپذیری سیناپسی دارای اهمیت هستند، بهبود بخشد (29). در واقع مطالعات محدودی اثر مستقیم ارتباط تمرینات ورزشی، METH و شاخصهای α-syn، CDK5، GSK-3β، APP،Tau ، p-Tau را مورد بررسی قرار دادهاند. شفیعی و همکاران (2022) در مطالعهای مشابه اثر تمرینات تناوبی با شدت متوسط بر وضعیت آنزیمهای آنتیاکسیدانی و حافظه فضایی موشهای وابسته به مت¬امفتامین مورد بررسی قرار دادند که نتایج آنها نشان داد متآمفتامین سبب ایجاد نوروتوکسیتی (Neurotoxicity) و منجر به کاهش حافظه فضایی و دفاع آنزیمهای آنتیاکسیدانی به واسطه افزایش استرس اکسیداتیو در سطح سلول شد و انجام تمرینات MIT منجر به کاهش بیان ژنهای α-syn ، CDK5 ، Tauو p-Tau در بافت هیپوکامپ شد (17). که نتایج آنها همسو با تحقیق حاضر بود. عدم سنجش حافظه فضایی (آزمون رفتاری ماز آبی موریس) و آنزیمهای آنتیاکسیدانی از محدودیت¬های تحقیق حاضر میباشد. بهنظر میرسد نیاز به تحقیقات بیشتری در ارتباط با نوع، شدت و زمان اثرگذاری تمرینات ورزشی احساس میشود. سومکوار و همکاران (2015) نشان دادند استفاده از METH در مدل¬های حیوانی به دلیل تولید گونههای فعال اکسیژن سبب ایجاد استرس¬اکسیداتیو و نوروتوکسیتی میشود؛ زیرا رادیکالهای آزاد بهطور طبیعی به وسیله آنزیم¬های آنتی¬اکسیدان داخل سلولی همچون سوپراکسید دیسموتاز، گلوتاتیون پراکسیداز و کاتالاز برداشته و حذف میشوند (30). احتمالاً " METH در هیپوکامپ موشهای تحقیق حاضر منجر به استرس اکسیداتیو شده است و بهدنبال آن باعث فعال شدن مسیر آپوپتوزیس (مسیر داخلی و خارجی) و تخریب نورونی شده است. یکی از محدودیتهای پژوهش حاضر عدم سنجش میزان بیان ژنی Caspases-3 است. بررسیهای هیستوپاتولوژیک در منطقه CA1 هیپوکامپ موشهای صحرائی نشان داد که تزریق متآمفتامین منجر به تخریب نورونها شده است و تمرینات HIT تا حدودی باعث پیشگیری از تخریب نورونها در منطقه CA1 هیپوکامپ موشهای صحرائی شده است. بهنظر میرسد نوروتوکسیتی در هیپوکامپ موشهای صحرائی گروه METH اتفاق افتاده است. هاماکاوا و همکاران (2013) نشان دادند که 3 هفته فعالیت ورزشی موجب کاهش سطح رادیکالهای آزاد میشود که با کاهش اختلالات حرکتی ناشی از آن همراه خواهد بود (31). اوگونوفسکی و همکاران (2005) نشان دادند، ورزش با شدت متوسط (1 ساعت شنا در روز به مدت 8 هفته) هم ظرفیت آنتیاکسیدانی و هم مقاومت در برابر استرس اکسیداتیو را در بدن افزایش میدهد و عملکرد حافظه موش¬های صحرائی را بهبود میبخشد (32). سومکوار و همکاران (2015) عنوان کردند فعالیت ورزشی هوازی با افزایش آنتیاکسیدانهای سلولهای عصبی، میتواند موجب کاهش استرس اکسیداتیو و افزایش مقاومت نورونهای ناحیه هیپوکامپ در برابر آسیبهای ناشی از متآمفتامین شود (30). این مکانیسمهای نوروپروتکتیو فعالیت ورزشی، یک دیدگاه درمانی نوین و یک نقطه نظر مهم پیشگیرانه را فراهم میکند و به عنوان روشی مؤثر و راهبردی مفید در کاهش عوارض مغزی ناشی از METH میباشد. کامیلتی و همکاران (2013) عنوان کردند که تمرین ورزشی، فعالیت پایه برخی از آنزیمهای آنتیاکسیدانی را افزایش میدهد و بهعنوان آنتیاکسیدانهای مستقیم و غیرمستقیم، انواع گونههای اکسیدکننده را خنثی میکنند و از سلولها در برابر آسیب استرس اکسیداتیو محافظت میکند (33). احتمالا" هشت هفته تمرین HIT توانسته میزان آنزیمهای آنتیاکسیدانی را افزایش دهد و اثرات مخرب استرس اکسیداتیو ناشی از METH را تعدیل کند.
نتیجهگیری
احتمالاً تزریق METH میتواند با افزایش α-syn،CDK5، GSK-3β، APP،Tau ، p-Tau باعث ایجاد اختلال در فعالیت نورونی شود. بنابراین افراد درگیر در این شکل از اعتیاد میتوانند برای جلوگیری از تخریب بیشتر نورونی و کاهش عوارض ماده مخدر (شیشه) بر بافت هیپوکامپ و بیماری آلزایمر از تمرینات تناوبی شدید استفاده کنند. همچنین بهنظر میرسد تمرین HIT باعث بهبود نورونها ناحیه هیپوکامپ شده است. علاوه بر این، استفاده از ورزش بهعنوان یک مداخله درمانی نیاز به تحقیقات بیشتری دارد که میتواند دستورالعملهای دقیقی (به عنوان مثال، شدت، تواتر، مدت، نوع ورزش) برای انواع مختلف اختلالات مصرف مواد مخدر ارائه دهد.
سپاسگزاری
این مقاله مستخرج از پایاننامه دوره دکتری رشته فیزیولوژی ورزشی می باشد؛ محققین از مسئولین مرکز تحقیقات علوم و اعصاب دانشگاه علوم پزشکی کرمان و تمامی کسانی که ما را در اجرای تحقیق حاضر همراهی نمودهاند کمال تشکر و قدردانی را ابراز میدارند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
کد اخلاق و ملاحظات اخلاقی
پروپوزال این مطالعه در کمیته اخلاق دانشگاه حکیم سبزواری تائید شده است. (کد اخلاق IR.HSU.AEC.1401.008)
مشارکت نویسندگان
خانم بهرامی، آقای شهرآبادی و شفیعی در ایده پژوهشی، طراحی مطالعه، نوشتن نسخه اولیه و مراحل اجرایی تمرین و جمعآوری داده و تفسیر دادهها مشارکت داشتند. آقایان دکتر حقیقی، اسدی و شفیعی ایده پژوهشی، طراحی مطالعه، همچنین اصلاحات و بازبینی متن از لحاظ محتوای علمی و تایید نسخه نهایی دستنوشته قبل از انتشار بر عهده داشتند و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Uhlmann S, Debeck K, Simo A, Kerr T, Montaner JS, Wood E. Crystal Methamphetamine Initiation among Street-Involved Youth. Am J Drug Alcohol Abuse 2014; 40(1): 31-6.
2- Gabbouj S, Ryhänen S, Marttinen M, Wittrahm R, Takalo M, Kemppainen S, et al. Altered Insulin Signaling in Alzheimer’s Disease Brain–Special Emphasis on PI3K-Akt Pathway. Front Neurosci 2019; 13: 629.
3- Panenka WJ, Procyshyn RM, Lecomte T, MacEwan GW, Flynn SW, Honer WG, et al. Methamphetamine Use: A Comprehensive Review of Molecular, Preclinical and Clinical Findings. Drug Alcohol Depend 2013; 129(3): 167-79.
4- Cadet JL, Krasnova IN. Molecular Bases of Methamphetamine-Induced Neurodegeneration. Int Rev Neurobiol 2009; 88: 101-19.
5- Kuhn DM, Francescutti-Verbeem DM, Thomas DM. Dopamine Quinones Activate Microglia and Induce a Neurotoxic Gene Expression Profile: Relationship to Methamphetamine‐Induced Nerve Ending Damage. Ann N Y Acad Sci 2006; 1074: 31-41.
6- Nordberg J, Arnér ES. Reactive Oxygen Species, Antioxidants, and the Mammalian Thioredoxin System. Free Radic Biol Med 2001; 31(11): 1287-312.
7- Oruç EÖ, Usta D. Evaluation of Oxidative Stress Responses and Neurotoxicity Potential of Diazinon in Different Tissues of Cyprinus Carpio. Environ Toxicol Pharmacol 2007; 23(1): 48-55.
8- Outeiro TF, Koss DJ, Erskine D, Walker L, Kurzawa-Akanbi M, Burn D, et al. Dementia with Lewy Bodies: An Update and Outlook. Mol Neurodegener 2019; 14(1): 5.
9- Barrett PJ, Timothy Greenamyre J. Post-Translational Modification of Α-Synuclein in Parkinson׳ S Disease. Brain Res 2015; 1628(Pt B): 247-53.
10- Zhang QS, Heng Y, Yuan YH, Chen NH. Pathological Α-Synuclein Exacerbates the Progression of Parkinson’s Disease through Microglial Activation. Toxicol Lett 2017; 265: 30-7.
11- Sanchez-Guajardo V, Tentillier N, Romero-Ramos M. The Relation between Α-Synuclein and Microglia in Parkinson’s Disease: Recent Developments. Neuroscience 2015; 302: 47-58.
12- Chen L, Zhou L, Yu P, Fang F, Jiang L, Fei J, et al. Methamphetamine Exposure Upregulates the Amyloid Precursor Protein and Hyperphosphorylated Tau Expression: The Roles of Insulin Signaling in SH-SY5Y Cell Line. J Toxicol Sci 2019; 44(7): 493-503.
13- Shieh JC, Huang PT, Lin YF. Alzheimer’s disease and Diabetes: Insulin Signaling as the Bridge Linking Two Pathologies. Mol Neurobiol 2020; 57(4): 1966-77.
14- Ding J, Hu S, Meng Y, Li C, Huang J, He Y, et al. Alpha-Synuclein Deficiency Ameliorates Chronic Methamphetamine Induced Neurodegeneration in Mice. Toxicology 2020; 438: 152461.
15- Koo JH, Cho JY. Treadmill Exercise Attenuates Α-Synuclein Levels by Promoting Mitochondrial Function and Autophagy Possibly Via SIRT1 in the Chronic MPTP/P-Induced Mouse Model of Parkinson’s Disease. Neurotox Res 2017; 32(3): 473-486.
16- Minakaki G, Canneva F, Chevessier F, Bode F, Menges S, Timotius IK, et al. Treadmill Exercise Intervention Improves Gait and Postural Control in Alpha-Synuclein Mouse Models without Inducing Cerebral Autophagy. Behav Brain Res 2019; 363: 199-215.
17- Shafiei A, Haghighi AH, Askari R, Keyhani A, Nabavizadeh MS, Asadi-Shekaari M. Effects of Moderate-Intensity Interval Training on Gene Expression and Antioxidant Status in the Hippocampus of Methamphetamine-Dependent Rats. Neurotoxicity Research 2022; 40(5): 1455-63.
18- Khalafi M, Shabkhiz F, Azali Alamdari K, Bakhtiyari A. Irisin Response to Two Types of Exercise Training in Type 2 Diabetic Male Rats. AMUJ 2016; 19(111): 37-45.
19- Ru Q, Tian X, Xiong Q, Xu C, Chen L, Wu Y. Krill Oil Alleviated Methamphetamine-Induced Memory Impairment Via the MAPK Signaling Pathway and Dopaminergic Synapse Pathway. Front Pharmacol 2021; 12: 756822.
20- Izawa J, Yamanashi K, Asakura T, Misu Y, Goshima Y. Differential Effects of Methamphetamine and Cocaine on Behavior and Extracellular Levels of Dopamine and 3, 4-Dihydroxyphenylalanine in the Nucleus Accumbens of Conscious Rats. Eur J Pharmacol 2006; 549(1-3): 84-90.
21- Shafahi M, Vaezi G, Shajiee H, Sharafi S, Khaksari M. Effects of Crocin on Learning, Spatial Memory Impairment and Necrosis Cells Death in Rats Hippocampus Area in Methamphetamine Induced Neurotoxicity. Journal of Knowledge & Health 2019; 14(1): 12-21.
22- Wang X, Becker K, Levine N, Zhang M, Lieberman AP, Moore DJ, et al. Pathogenic Alpha-Synuclein Aggregates Preferentially Bind to Mitochondria and Affect Cellular Respiration. Acta Neuropathol Commun 2019; 7: 41.
23- Peric A, Annaert W. Early Etiology of Alzheimer’s Disease: Tipping the Balance Toward Autophagy or Endosomal Dysfunction? Acta Neuropathol 2015; 129(3): 363-81.
24- Valian N, Ahmadiani A, Dargahi L. Increasing Methamphetamine Doses Inhibit Glycogen Synthase Kinase 3β Activity by Stimulating the Insulin Signaling Pathway in Substantia Nigra. J Cell Biochem 2018; 119(10): 8522-30.
25- Abramov E, Dolev I, Fogel H, Ciccotosto GD, Ruff E, Slutsky I. Amyloid-Β as a Positive Endogenous Regulator of Release Probability at Hippocampal Synapses. Nat Neurosci 2009; 12(12): 1567-76.
26- Hayati M, Zarghoshi J, Dabirifar G, Yousefi M, Omidi M. The Effect of Different Training Periods on Beta-Amyloid 42 Index in Hippocampus of Streptozotocin-Induced Diabetic Male Rats. Sport Physiology & Management Investigations 2021; 13(3): 127-37.
27- Baker LD, Frank LL, Foster-Schubert K, Green PS, Wilkinson CW, McTiernan A, et al. Aerobic Exercise Improves Cognition for Older Adults with Glucose Intolerance, a Risk Factor for Alzheimer's Disease. J Alzheimers Dis 2010; 22(2): 569-79.
28- Cotman CW, Berchtold NC. Exercise: A Behavioral Intervention to Enhance Brain Health and Plasticity. Trends Neurosci 2002; 25(6): 295-301.
29- Trejo JL, Carro E, Torres-Aleman I. Circulating Insulin-Like Growth Factor I Mediates Exercise-Induced Increases in the Number of New Neurons in the Adult Hippocampus. J Neurosci 2001; 21(5): 1628-34.
30- Somkuwar SS, Staples MC, Fannon MJ, Ghofranian A, Mandyam CD. Evaluating Exercise as a Therapeutic Intervention for Methamphetamine Addiction-Like Behavior. Brain Plast 2015; 1(1): 63-81.
31- Hamakawa M, Ishida A, Tamakoshi K, Shimada H, Nakashima H, Noguchi T, et al. Repeated Short-Term Daily Exercise Ameliorates Oxidative Cerebral Damage and the Resultant Motor Dysfunction after Transient Ischemia in Rats. J Clin Biochem Nutr 2013; 53(1): 8-14.
32- Ogonovszky H, Berkes I, Kumagai S, Kaneko T, Tahara S, Goto S, et al. The Effects of Moderate-, Strenuous-And Over-Training on Oxidative Stress Markers, DNA Repair, and Memory, in Rat Brain. Neurochem Int 2005; 46(8): 635-40.
33- Camiletti-Moirón D, Aparicio VA, Aranda P, Radak Z. Does Exercise Reduce Brain Oxidative Stress? A Systematic Review. Scand J Med Sci Sports 2013; 23(4): e202-12.
1- Uhlmann S, Debeck K, Simo A, Kerr T, Montaner JS, Wood E. Crystal Methamphetamine Initiation among Street-Involved Youth. Am J Drug Alcohol Abuse 2014; 40(1): 31-6.
2- Gabbouj S, Ryhänen S, Marttinen M, Wittrahm R, Takalo M, Kemppainen S, et al. Altered Insulin Signaling in Alzheimer’s Disease Brain–Special Emphasis on PI3K-Akt Pathway. Front Neurosci 2019; 13: 629.
3- Panenka WJ, Procyshyn RM, Lecomte T, MacEwan GW, Flynn SW, Honer WG, et al. Methamphetamine Use: A Comprehensive Review of Molecular, Preclinical and Clinical Findings. Drug Alcohol Depend 2013; 129(3): 167-79.
4- Cadet JL, Krasnova IN. Molecular Bases of Methamphetamine-Induced Neurodegeneration. Int Rev Neurobiol 2009; 88: 101-19.
5- Kuhn DM, Francescutti-Verbeem DM, Thomas DM. Dopamine Quinones Activate Microglia and Induce a Neurotoxic Gene Expression Profile: Relationship to Methamphetamine‐Induced Nerve Ending Damage. Ann N Y Acad Sci 2006; 1074: 31-41.
6- Nordberg J, Arnér ES. Reactive Oxygen Species, Antioxidants, and the Mammalian Thioredoxin System. Free Radic Biol Med 2001; 31(11): 1287-312.
7- Oruç EÖ, Usta D. Evaluation of Oxidative Stress Responses and Neurotoxicity Potential of Diazinon in Different Tissues of Cyprinus Carpio. Environ Toxicol Pharmacol 2007; 23(1): 48-55.
8- Outeiro TF, Koss DJ, Erskine D, Walker L, Kurzawa-Akanbi M, Burn D, et al. Dementia with Lewy Bodies: An Update and Outlook. Mol Neurodegener 2019; 14(1): 5.
9- Barrett PJ, Timothy Greenamyre J. Post-Translational Modification of Α-Synuclein in Parkinson׳ S Disease. Brain Res 2015; 1628(Pt B): 247-53.
10- Zhang QS, Heng Y, Yuan YH, Chen NH. Pathological Α-Synuclein Exacerbates the Progression of Parkinson’s Disease through Microglial Activation. Toxicol Lett 2017; 265: 30-7.
11- Sanchez-Guajardo V, Tentillier N, Romero-Ramos M. The Relation between Α-Synuclein and Microglia in Parkinson’s Disease: Recent Developments. Neuroscience 2015; 302: 47-58.
12- Chen L, Zhou L, Yu P, Fang F, Jiang L, Fei J, et al. Methamphetamine Exposure Upregulates the Amyloid Precursor Protein and Hyperphosphorylated Tau Expression: The Roles of Insulin Signaling in SH-SY5Y Cell Line. J Toxicol Sci 2019; 44(7): 493-503.
13- Shieh JC, Huang PT, Lin YF. Alzheimer’s disease and Diabetes: Insulin Signaling as the Bridge Linking Two Pathologies. Mol Neurobiol 2020; 57(4): 1966-77.
14- Ding J, Hu S, Meng Y, Li C, Huang J, He Y, et al. Alpha-Synuclein Deficiency Ameliorates Chronic Methamphetamine Induced Neurodegeneration in Mice. Toxicology 2020; 438: 152461.
15- Koo JH, Cho JY. Treadmill Exercise Attenuates Α-Synuclein Levels by Promoting Mitochondrial Function and Autophagy Possibly Via SIRT1 in the Chronic MPTP/P-Induced Mouse Model of Parkinson’s Disease. Neurotox Res 2017; 32(3): 473-486.
16- Minakaki G, Canneva F, Chevessier F, Bode F, Menges S, Timotius IK, et al. Treadmill Exercise Intervention Improves Gait and Postural Control in Alpha-Synuclein Mouse Models without Inducing Cerebral Autophagy. Behav Brain Res 2019; 363: 199-215.
17- Shafiei A, Haghighi AH, Askari R, Keyhani A, Nabavizadeh MS, Asadi-Shekaari M. Effects of Moderate-Intensity Interval Training on Gene Expression and Antioxidant Status in the Hippocampus of Methamphetamine-Dependent Rats. Neurotoxicity Research 2022; 40(5): 1455-63.
18- Khalafi M, Shabkhiz F, Azali Alamdari K, Bakhtiyari A. Irisin Response to Two Types of Exercise Training in Type 2 Diabetic Male Rats. AMUJ 2016; 19(111): 37-45.
19- Ru Q, Tian X, Xiong Q, Xu C, Chen L, Wu Y. Krill Oil Alleviated Methamphetamine-Induced Memory Impairment Via the MAPK Signaling Pathway and Dopaminergic Synapse Pathway. Front Pharmacol 2021; 12: 756822.
20- Izawa J, Yamanashi K, Asakura T, Misu Y, Goshima Y. Differential Effects of Methamphetamine and Cocaine on Behavior and Extracellular Levels of Dopamine and 3, 4-Dihydroxyphenylalanine in the Nucleus Accumbens of Conscious Rats. Eur J Pharmacol 2006; 549(1-3): 84-90.
21- Shafahi M, Vaezi G, Shajiee H, Sharafi S, Khaksari M. Effects of Crocin on Learning, Spatial Memory Impairment and Necrosis Cells Death in Rats Hippocampus Area in Methamphetamine Induced Neurotoxicity. Journal of Knowledge & Health 2019; 14(1): 12-21.
22- Wang X, Becker K, Levine N, Zhang M, Lieberman AP, Moore DJ, et al. Pathogenic Alpha-Synuclein Aggregates Preferentially Bind to Mitochondria and Affect Cellular Respiration. Acta Neuropathol Commun 2019; 7: 41.
23- Peric A, Annaert W. Early Etiology of Alzheimer’s Disease: Tipping the Balance Toward Autophagy or Endosomal Dysfunction? Acta Neuropathol 2015; 129(3): 363-81.
24- Valian N, Ahmadiani A, Dargahi L. Increasing Methamphetamine Doses Inhibit Glycogen Synthase Kinase 3β Activity by Stimulating the Insulin Signaling Pathway in Substantia Nigra. J Cell Biochem 2018; 119(10): 8522-30.
25- Abramov E, Dolev I, Fogel H, Ciccotosto GD, Ruff E, Slutsky I. Amyloid-Β as a Positive Endogenous Regulator of Release Probability at Hippocampal Synapses. Nat Neurosci 2009; 12(12): 1567-76.
26- Hayati M, Zarghoshi J, Dabirifar G, Yousefi M, Omidi M. The Effect of Different Training Periods on Beta-Amyloid 42 Index in Hippocampus of Streptozotocin-Induced Diabetic Male Rats. Sport Physiology & Management Investigations 2021; 13(3): 127-37.
27- Baker LD, Frank LL, Foster-Schubert K, Green PS, Wilkinson CW, McTiernan A, et al. Aerobic Exercise Improves Cognition for Older Adults with Glucose Intolerance, a Risk Factor for Alzheimer's Disease. J Alzheimers Dis 2010; 22(2): 569-79.
28- Cotman CW, Berchtold NC. Exercise: A Behavioral Intervention to Enhance Brain Health and Plasticity. Trends Neurosci 2002; 25(6): 295-301.
29- Trejo JL, Carro E, Torres-Aleman I. Circulating Insulin-Like Growth Factor I Mediates Exercise-Induced Increases in the Number of New Neurons in the Adult Hippocampus. J Neurosci 2001; 21(5): 1628-34.
30- Somkuwar SS, Staples MC, Fannon MJ, Ghofranian A, Mandyam CD. Evaluating Exercise as a Therapeutic Intervention for Methamphetamine Addiction-Like Behavior. Brain Plast 2015; 1(1): 63-81.
31- Hamakawa M, Ishida A, Tamakoshi K, Shimada H, Nakashima H, Noguchi T, et al. Repeated Short-Term Daily Exercise Ameliorates Oxidative Cerebral Damage and the Resultant Motor Dysfunction after Transient Ischemia in Rats. J Clin Biochem Nutr 2013; 53(1): 8-14.
32- Ogonovszky H, Berkes I, Kumagai S, Kaneko T, Tahara S, Goto S, et al. The Effects of Moderate-, Strenuous-And Over-Training on Oxidative Stress Markers, DNA Repair, and Memory, in Rat Brain. Neurochem Int 2005; 46(8): 635-40.
33- Camiletti-Moirón D, Aparicio VA, Aranda P, Radak Z. Does Exercise Reduce Brain Oxidative Stress? A Systematic Review. Scand J Med Sci Sports 2013; 23(4): e202-12.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1402/5/24 | پذیرش: 1402/7/9 | انتشار: 1402/10/15
دریافت: 1402/5/24 | پذیرش: 1402/7/9 | انتشار: 1402/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







