دوره 31، شماره 10 - ( دی 1402 )
جلد 31 شماره 10 صفحات 7155-7144 |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.B.REC.1401.030
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Azadbakht B, Saremi A, Khansooz M. Investigating the Effects of 8 Weeks of Resistance Training on the Levels of P53 and Nrf2 Proteins in Kidney Tissue in Diabetic Rats with Morphine Withdrawal Syndrome. JSSU 2024; 31 (10) :7144-7155
URL: http://jssu.ssu.ac.ir/article-1-6002-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6002-fa.html
آزادبخت بهزاد، صارمی عباس، خانسوز مجتبی. بررسی اثر 8 هفته تمرین مقاومتی بر سطوح پروتئینهای P53 و Nrf2 بافت کلیه در موشهای صحرایی دیابتی همراه با سندروم ترک مرفین. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (10) :7144-7155
متن کامل [PDF 885 kb]
(171 دریافت)
| چکیده (HTML) (510 مشاهده)
متن کامل: (323 مشاهده)
مقدمه
اپیدمی دیابت ملیتوس در حال حاضر به یک تهدید جدی برای سلامت جهانی تبدیل شده است (1). هیپرگلیسمی مزمن ناشی از دیابت منجر به استرساکسیداتیو مزمن برای همه بافتها میشود. گلوکز در غلظتهای غیرعادی بالا، گونههای فعال اکسیژن (Reactive Oxygen Species) را تشکیل میدهد که میتواند منجر به آسیب اکسیداتیو در اهداف ثانویه کلاسیک دیابت مانند چشمها، کلیهها، اعصاب و عروق خونی شود (2). کلیهها نقش مهمی در فیلتراسیون مواد زائد خون ایفا میکنند و در شرایط قندخون بالا، آسیب پذیرتر از دیگر بافتها هستند (3). افزایش سطح گونههای فعال اکسیژن(ROS) توسط هیپرگلیسمی میتواند آپوپتوز سلولهای کلیوی را القاء کند (4). P53 یکی از مهمترین سرکوبگرهای تومور بهشمار میرود که در پاسخ به عوامل مختلفی از استرس سلولی مانند آسیب DNA، هایپوکسی شدید، پیری سلولی و فشارهای اکسایشی بالا افزایش یافته و فعال میشود (5). مطالعات اخیر نیز نشان میدهد که p53 نقش مهمی در ایجاد بیماریهای متابولیک، از جمله دیابت دارد (6). همچنین پروتئین P53 در تنظیم آپوپتوز نقش مهمی دارد (7). و توسط ROS تنظیم میشود (8). P53 با پروتئینهای مختلف در غشای خارجی میتوکندری، مانند پروتئینهای ضدآپوپتوز Bcl-2 و Bcl-x تعامل میکند تا فعالیت آنها را مسدود کرده و آپوپتوز را القا کند (8). نشان داده شده است که هیپرگلیسمی از طریق فعال شدن p53 باعث آپوپتوز سلولی میشود (9). از طرفی فاکتور اریتروئید هستهایNuclear Factor Erythroid 2 - Related Factor or Nrf2))، یک فاکتور رونویسی میباشد که نقش مهمی در دفاع سلول علیه آسیبهای اکسیداتیو را ایفا میکند (10). اخیراً، مطالعات نشان دادهاند که Nrf2 به عنوان یک واسطه اصلی برای سیستم دفاعی آنتیاکسیدانی در بدن ما نقش مهمی در جلوگیری از استرساکسیداتیو/ آسیب، التهاب و اختلال عملکرد اندام ناشی از دیابت دارد (11). سطوح پایین Nrf2 در ایجاد استرساکسیداتیو و عدم تعادل وضعیت ردوکس در بیماران دیابتی نقش دارد (12). در واقع، فعالسازی Nrf2 نه تنها از کلیه در برابر آسیب اکسیداتیو ناشی از دیابت محافظت میکند، بلکه سایر اندامها را نیز از دیابت محافظت میکند (11). از طرفی برخی معتقدند که تریاک در برخی از اختلالات بهویژه دیابت اثر درمانی مثبت دارد. بر همین اساس، مردم عادی تریاک را توصیه میکنند و همین امر دلیلی برای مصرف آن است (13). مرفین فعالترین و فراوانترین آلکالوئید در تریاک است (14). ثابت شده است که مرفین استرساکسیداتیو را در سلولهای مختلف اعمال میکند (15). یافتههای سمرقندیان و همکاران (2014) به خطر آسیب کبدی ناشی از استفاده طولانیمدت از مرفین از طریق اختلال در تعادل اکسیدان-آنتیاکسیدان اشاره دارد (16). Singhal و همکاران (1998) نشان دادند که آپوپتوز فیبروبلاستهای کلیه ناشی از مرفین ممکن است از طریق تولید p53 اتفاق بیفتد (17). افزایش حاصل در p53 منجر به القای توقف چرخه سلولی یا آپوپتوز میشود (18). همچنین مصرف طولانیمدت مرفین اثرات منفی دارد و در نتیجه باعث تشدید دیابت، دیسلیپیدمی و فشارخون میشود. بر این اساس، لازم است جوامع را از مضرات احتمالی مصرف غیرمجاز تریاک آگاه کرد (14). از سوی دیگر ورزش در سلامت انسان نقش عمدهای ایفا مینماید. نقش درمانی ورزش در بیماران مبتلا به افزایش فشارخون، افسردگی، اعتیاد و دیابت گزارش شده است (19). در خصوص پیشینه تحقیقاتی اثر تمرینات ورزشی بر متغیرهای این مطالعه، یافتههای مطالعه جوکار و شرافتیمقدم (1400) نشان داد که تمرین HIIT منجر به کاهش پروتئین P53 در بافت عضله قلب موشهای صحرایی مبتلا به دیابت میشود (7). علاوه بر این عباسی و همکاران (1397) مشاهده کردند که اثر هشت هفته تمرین همزمان استقامتی و مقاومتی منجر به افزایش سطوح پلاسمایی Nrf2 مردان جوان گردید (20). با توجه اینکه اثر تمرینات مختلف ورزشی بر بافت کلیه در دیابت همراه با سندروم ترک مرفین نامشخص است و تا کنون مطالعهای در این مورد صورت نگرفته است. لذا تحقیق حاضر برای نخستینبار با هدف بررسی اثر 8 هفته تمرین مقاومتی بر سطوح پروتئینهای P53 و Nrf2بافت کلیه در موشهای صحرایی نر دیابتی همراه با سندروم ترک مرفین انجام شد.
روش بررسی
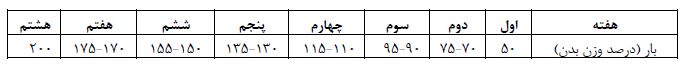
تحقیق حاضر از نظر هدف کاربردی و از لحاظ شیوه اجرا، تجربی آزمایشگاهی میباشد که به صورت پسآزمون با گروه کنترل انجام گرفت. نمونههای این مطالعه 32 سر موش صحرایی نر نژاد ویستار خریداری شده از دانشگاه بقیۀاالله بودند، با میانگین سن 8 تا 10 هفته و میانگین وزن 30 ±230 گرم، بر اساس وزن به صورت تصادفی به 4 گروه 8 تایی شامل: دیابت، دیابت مرفین، دیابت + ورزش مقاومتی و دیابت مرفین + ورزش مقاومتی تقسیم شدند. موشها به مدت دو هفته در شرایط جدید در قفسهایی از جنس پلیکربنات شفاف، در آزمایشگاه جوندگان در شرایط دمای 2±22 درجه سانتیگراد، رطوبت 40 تا 60 درصد و چرخهی روشنایی به تاریکی 12:12 ساعت با تهویه مناسب و دسترسی به غذا (تهیه شده به صورت پلت از مرکز تولید انواع خوراک دام شرکت بهپرور) و آب (بطریهای500 میلی لیتر ویژه حیوانات آزمایشگاهی) به صورت نامحدود، نگهداری شدند. در خصوص دیابتی نمودن موشها در سال 1998ماسیلو (Masiello) و همکاران مدل جدیدی از دیابت در موشهای صحرایی ارائه دادند که دارای بسیاری از ویژگیهای دیابت نوع 2 انسانی بود. این روش که ناشی از تزریق استرپتوزوتوسین و نیکوتینآمید میباشد برای مدت زمان طولانی ثابت باقی میماند به گونهای که این مدل دیابت نه تنها برای مطالعات حیوانی کوتاه مدت بلکه بلند مدت نیز مناسب است (21). بنابراین براساس روش ماسیلو و همکاران برای دیابتی کردن موشها بعد از 12 ساعت ناشتا با تزریـق درون صـفاقی محلول استرپتوزوتوسـین (سـاخت شرکت سیگما، آمریکـا) محلـول در بـافر سـیترات 0/1 مولار با دوز 65 میلیگرم به ازای هر کیلوگرم وزن بدن که بعد از 15 دقیقه از تزریق محلول نیکوتینآمید (ساخت شـرکت سـیگما، آمریکـا) محلول شده در نرمالسالین با دوز 120 میلیگرم برای هر کیلوگرم وزن بدن استفاده شد. 72 ساعت پس از تزریق جهت اطمینـان از دیـابتی بودن (معیار ورود و خروج به مطالعه)، مـوشهـای صحرایی کـه میزان قندخون آنهـا بیشـتر از 250 میلیگرم/دسیلیتر (mg/dl) بود بــه عنــوان دیــابتی در نظــر گرفتــه شدند (22). سطوح قندخون با خونگیری بعد از 12 ساعت ناشتا، از انتهای دم موشها توسط گلوکومتر (بیورر مدل GL42، ساخت کشور آلمان) اندازهگیری شد (23). پروتکل سندروم ترک مرفین پس از تایید القاء دیابت صورت گرفت. جهت ایجاد وابستگی به مرفین از روش خوراکی استفاده شد. مرفین در آب آشامیدنی حیوانات با غلظتهای متوالی 0/1، 0/2 و0/3 میلـیگـرم بر میلیلیتر هرکدام برای 48 سـاعت، سپس 0/4 میلـیگـرم در میلـیلیتـر بـرای بقیـه روزهـا تـا روز 21 ، به آب اضافه شد (24). همچنین با توجه به دیابتی بودن موشها و طعم تلخ مرفین از شیرینکننده مصنوعی مناسب با غلظت 3 درصد استفاده و به آب آشامیدنی اضافه شد. برای اطمینان از وابستگی ناشی از مرفین در حیوانات در پایان روز 21، نالوکسان (شـرکت سـیگما آمریکـا) به میزان 2 میلیگرم به ازای هر کیلوگرم وزن بدن به صورت داخل صفاقی بـه نمونهها تزریـق شد و علایـم ترک اعتیاد از جمله پریدن، بالا رفـتن، خارانـدن، دنـدان قروچـه، قرمـزی دور چـشم، اسـهال، لـرزش، افتـادگی پلک، نعوظ و روی دو پا ایستادن برای مـدت 30 دقیقـه بررســی گردید (25). مشاهده شد که نالوکسان علائم ترک مرفین را در حیوانات معتاد القا کرد. پروتکل تمرین مقاومتی نیز بعد از یک هفته آشنایی موشها به بالا رفتن از نردبان، به مدت 8 هفته اجرا گردید که شامل بالا رفتن از نردبانی به طول 1 متر، دارای 26 پله با فاصله 4 سانتیمتر و شیب 85 درجه بود. بدین صورت انجام شد که وزنهای معادل 50 درصد وزن موش به دم آن متصل بود و این میزان بر اساس اصل اضافه بار به تدریج به 200 درصد وزن بدن حیوانات در هفته آخر رسید (جدول 1) و در این حالت حیوان از نردبان بالا میرفت. این برنامه هفتهای سه جلسه انجام گرفت. تمرینات روزانه در سه نوبت و هر نوبت شامل 4 بار صعود از نردبان بود. بین نوبتها سه دقیقه استراحت و بین تکرارها یک دقیقه استراحت وجود داشت (26). در صـورت خـودداری از صـعود، شوک الکتریکی کموات استفاده شد (27).
جدول 1: تمرینات مقاومتی در 3 دور 4 تکراری روی نردبان 1 متری با 26 پله با فاصله 4 سانتیمتری
چهل و هشت ساعت پس از آخرین جلسه تمرین، همه موشها با ترکیبی از 75 میلیگرم/کیلوگرم وزن بدن، کتامین و 10 میلیگرم/ کیلوگرم وزن بدن، زایلازین بیهوش، کشته، تشریح و بافت کلیه جدا گردید. بعد از شستن بافتها با نرمالسالین، به سرعت در مخازن نیتروژن مایع به مدت 2 دقیقه غوطهور شدند و جهت انتقال به آزمایشگاه در دمای منفی70 درجه سانتیگراد نگهداری شدند، سطوح پروتئین شاخصهای این پژوهش توسط کیتهای الایزا مخصوص موش صحرایی مطابق دستورالعمل شرکت تولیدکننده اندازهگیری شدند اندازهگیری سطح پروتئین P53 این مطالعه توسط کیت الایزا شرکت RayBiotech ساخت کشور آمریکا با شماره کاتالوگ ELR-p53 وحساسیت 0/32 نانوگرم بر میلیلیتر انجام گرفت. همچنین سطح پروتئین Nrf2 با کیت الایزا شرکت Novus biologicals محصول کشور آمریکا با شماره کاتالوگ NBP3-08161 و حساسیت 9/38 پیکوگرم در میلیلیتر اندازهگیری شد.
تجزیه و تحلیل آماری
برای تجزیه و تحلیل اطلاعات این پژوهش از نرمافزار version 16 SPSSاستفاده شد و جهت اطمینان از نرمال بودن دادهها از آزمون شاپیرویلک و همچنین در مقایسه میانگین گروههای مورد مطالعه از آزمون تحلیل واریانس آنوای یکراهه و آزمون تعقیبی توکی با سـطح معنیداری p≤0/05استفاده شد.
نتایج
میانگین، انحراف معیار و نتایج آنالیز واریانس یکراهه متغیرهای مورد مطالعه در گروههای این پژوهش در جدول 3و2 ارائه شده است. همچنین میانگین قندخون گروههای مورد مطالعه در ابتدا و انتهای این پژوهش نیز در جدول 3 آمده است. در مقایسه بین گروهی متغیر P53 این پژوهش با استفاده از آزمون آنالیز واریانس یکطرفه (10/198 =F و 0/001=p) و متغیرNrf2 ( F=8/227 و P=0/003 ) مشاهده شد که اختلاف معنادار است.
جدول 2 : میانگین، انحراف معیار و نتایج آنالیز واریانس یکراهه متغیرهای P53 وNrf2 بافت کلیه در گروههای مورد مطالعه
.JPG)
D = دیابت .DM = دیابت مرفین . D.RT = دیابت + تمرین مقاومتی . DM.RT = دیابت مرفین + تمرین مقاومتی
SD ±M= میانگین ± انحراف معیار. سـطح معنی داری p≤0/05
جدول 3: میانگین قندخون گروههای مورد مطالعه در ابتدا و انتهای مطالعه

D = دیابت .DM = دیابت مرفین . D.RT = دیابت + تمرین مقاومتی . DM.RT = دیابت مرفین + تمرین مقاومتی
نتایج آزمون تعقیبی توکی در خصوص متغیر P53(نمودار 1) نشان داد که گروههای دیابت + تمرین مقاومتی(0/006=P) و دیابت مرفین + تمرین مقاومتی(0/023=P) نسبت به گروه دیابت کاهش معنادار داشته است و همچنین گروه دیابت مرفین + تمرین مقاومتی(0/012=P) نسبت به گروه دیابت مرفین نیز کاهش معنادار دارد.
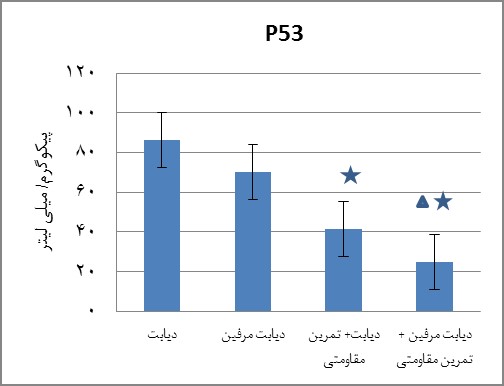
نمودار 1 : سطح پروتئین P53 در گروه های مورد مطالعه
:کاهش معنادار نسبت به گروه دیابت ، : کاهش معنادار نسبت به گروه دیابت مرفین
نتایج آزمون تعقیبی توکی در خصوص متغیر Nrf2 (نمودار 2) نشان داد که گروه دیابت مرفین(0/010=P) نسبت به گروه دیابت افزایش معنادار داشته است. گروههای دیابت مرفین + تمرین مقاومتی (0/013=P) و دیابت + تمرین مقاومتی(0/003=P) نسبت به گروه دیابت مرفین کاهش معنادار نشان داد.
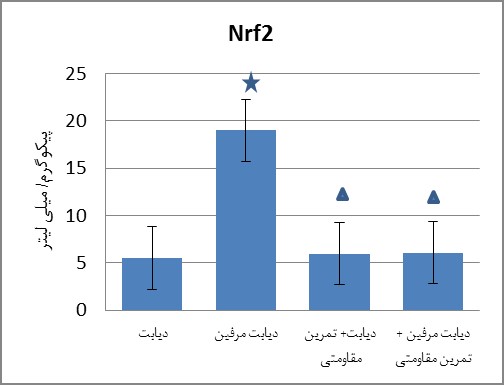
نمودار 2 : سطح پروتئین Nrf2 در گروه های مورد مطالعه
:افزایش معنادار نسبت به گروه دیابت : کاهش معنادار نسبت به گروه دیابت مرفین
بحث
نتایج این پژوهش نشان داد که 8 هفته تمرین مقاومتی موجب کاهش معنیدار فاکتور تنظیمی آپوپتوز P53 در بافت کلیه رتهای دیابتی و دیابتی همراه با سندروم ترک در گروههای تمرین شده است در ضمن بر اساس جستجوهای بعمل آمده تاکنون مطالعهای مطابق با موضوع مطالعه حاضر در بافت کلیه و سایر بافتهای بدن انجام نشده است. مطالعات مداخلهای تمرینات ورزشی به شدت از اثربخشی آن برای پیشگیری و مدیریت دیابت حمایت میکند (28). همسو با مطالعه حاضر جانبزرگی و همکاران (1401) در مطالعه هشت هفته تمرین هوازی در موشهای مبتلا به دیابت نوع دو، کاهش معنیدار غلظت پروتئینP53 را در بافت پانکراس مشاهده کردند (29). جهانتاش و همکاران (1400) نیز نشان دادند که تمرین تناوبی به کاهش بیان ژن P53 در سلولهای کبدی در رتهای چاق دیابتی منجر شد (30). همچنین نتایج مطالعه حسنپور و همکاران (2017) نشان داد که تمرین HIIT منجر به کاهش غیرمعنادار سطوح پروتئین P53 در قلب موشهای دیابتی شد (31). و همینطور یافتههای مطالعه جوکار و شرافتیمقدم (1400) نیز نشان داد که تمرین HIIT منجر به کاهش محتوای بافتی پروتئینP53 قلب موشهای دیابتی میشود (7). کاهش معنادار سطوح P53 بخش کلورکتال (colorectal) بافت روده بزرگ (کولون و رکتوم) رتها پس از ۸ هفته تمرین مقاومتی توسط عسگری و همکاران (2017) نیز گزارش شده است (32) که با یافتههای این مطالعه مطابقت دارد. از طرفی سیدقمی و همکاران (1396) مشاهده کردند که تمرین استقامتی با شدت بالا، تفاوت معناداری در بیان ژن p53 عضله اسکلتی ایجاد نکرد (33) که با نتایج این پژوهش مطابقت ندارد. از دلایل احتمالی آن میتوان به شدت تمرین و روش اندازهگیری و دیابتی نبودن نمونهها اشاره کرد. اما در خصوص پیشینه تحقیقاتی اثر تمرینات مختلف ورزشی بر فاکتور P53 در سندروم ترک مطالعهای یافت نشد. یافتههای ما در این خصوص نشان داد که اثر تمرین مقاومتی در گروه سندروم ترک (دیابت مرفین) نیز باعث کاهش معنادار سطح پروتئین P53 شده است. دیابت با افزایش فشاراکسایشی همراه بوده و استرساکسایشی نقش مهمی در پیشرفت دیابت دارد (34). از سوی دیگر، تریاک و متابولیت آن مانند مرفین با تحویل مستقیم گونههای فعال اکسیژن (ROS) و تحریک تولید ROS درونزا از طریق تحریک سلولهای التهابی، استرساکسیداتیو را افزایش میدهد (35). همچنین مرفین میتواند بهطور مستقیم فعالیت دفاعی آنتیاکسیدانی را در بدن کاهش دهد. بهنظر میرسد که تشکیل ROS یکی از مکانیسمهای اصلی در پس سوءمصرف مرفین است که با کاهش آنزیمهای آنتیاکسیدانی مرتبط است (16). با این حال، ورزش و فعالیت منظم میتواند منجر به کاهش استرس اکسیداتیو شود (36). مشاهده شده است که تمرین مقاومتی موجب کاهش قندخون و استرساکسایشی در رتهای ویستار دیابتی میشود (37). همچنین مطالعات نشان دادهاند که تمرینات ورزشی از طریق کاهش استرساکسیداتیو و آپوپتوز نقش حفاظتی در سلولها در برابر عوارض ناشی از دیابت ایفا میکنند (38). در مطالعهای دیگر نشان داده شد که استفاده از انواع مختلف تمرین ورزشی باعث افزایش شاخصهای آنتیاکسیدانی و کاهش شاخصهای استرساکسیداتیو و التهابی در بافت کبد گروه سندروم ترک مرفین گردید و ورزش سبب بهبود آسیب بافتی کبد، ناشی از مصرف مرفین در این گروه شد (39). در بررسی اثر تمرینات مختلف ورزشی در موشهای معتاد به مرفین مشاهده شد که ورزش سبب بهبود وضعیت آنتیاکسیدانی در روده موشهای قطع مصرف میشود (40). از سوی دیگر ورزش با آزادسازی اپیوئیدهای درونزاد باعث کاهش علائم وابستگی در حیوانات معتاد میگردد و در نتیجه تمایل به مصرف مرفین و سایر مواد اعتیادآور را کاهش میدهد (19) بنابراین با توجه به اینکه ورزش علائم ترک اعتیاد به مرفین را کاهش میدهد به نظر میرسد که در کاهش آثار سمی این ترکیب نیز نقش داشته باشد (19). لذا یکی از دلایل کاهش P53 در اثر فعالیتهای ورزشی و در این مطالعه این است که تمرینات منظم باعث کاهش استرساکسیداتیو و بالا رفتن دفاع آنتیاکسیدانی بدن میشوند (41). و با توجه به پژوهشهای انجام شده، از دلایل اصلی افزایش مقادیر P53 فرایندهای ایجاد شده ناشی از فشارهای اکسایشی است(32). بنابراین چون یکی از دلایل افزایش P53 افزایش استرساکسیداتیو است، میتوان انتظار داشت سطوح پروتئین P53 نیز بدلیل مهار استرساکسیداتیو کاهش پیدا کند (41). همچنین یافتههای این پژوهش نشان داد که تمرین مقاومتی در گروه دیابت + تمرین مقاومتی در مقایسه با گروه کنترل دیابت باعث افزایش غیرمعنیدار فاکتور تنظیمی آنتیاکسیدانی Nrf2 گردیده است. اما تمرین مقاومتی منجر به کاهش معنیدار Nrf2 در گروه دیابت مرفین + تمرین مقاومتی نسبت به گروه دیابت مرفین شد. گروه دیابت مرفین نیز در مقایسه با گروه دیابت افزایش معناداری را نشان داد. در خصوص پیشینه تحقیقاتی متغیر Nrf2 همسو با نتایج ما، مطالعه باعزم و همکاران (1401) نشان داد که القای دیابت در رتها باعث کاهش معنادار بیان ژنNrf2 در بافت بیضه شد و انجام ده هفته تمرین استقامتی منجر به افزایش معنادار سطح Nrf2 گردید (42). عباسی و همکاران (1397) نیز مشاهده کردند که هشت هفته تمرین همزمان استقامتی و مقاومتی منجر به افزایش سطوح پلاسمایی Nrf2 در مردان جوان گردید (20). این نتایج هم راستا با نتایج ما میباشد زیرا یافتههای ما نیز نشان داد که 8 هفته تمرین مقاومتی منجر به افزایش غیرمعنادار Nrf2 در گروه دیابت + تمرین مقاومتی شده است. در خصوص پیشینه تحقیقاتی اثر تمرینات مختلف ورزشی بر متغیر Nrf2 در سندروم ترک مطالعهای یافت نشد. اما نتایج ما نشان داد که تمرین مقاومتی موجب کاهش معنادار سطح پروتئین Nrf2 در گروه دیابت مرفین + تمرین مقاومتی در مقایسه با گروه دیابت مرفین شد که مکانیسم آن نامشخص است و تحقیقات بیشتری برای روشن شدن این موضوع لازم است. علاوه بر این، یافتههای ما نشان داد که مداخله مرفین باعث افزایش معنادار سطح Nrf2 در گروه دیابت مرفین در مقایسه با گروه دیابت شد. همسو با این نتایج، در مطالعهای نشان داده شد که Nrf2 در قشر پیشانی و جسم مخطط موشهای تحت درمان با مرفین افزایش مییابد (43). علاوه بر این Huang (2022) نیز نشان داد که مرفین میتواند بهطور قابلتوجهی بیان Nrf2 را افزایش دهد (44). مکانیسم آن ممکن است به علت بالا رفتن استرساکسیداتیو در اثر مصرف مرفین (15) باشد. هر چند دلیل اصلی آن نامشخص است و نیاز به مطالعات بیشتر ضروری است. ثابت شده است که Nrf2 به عنوان یک فاکتور رونویسی، برخی از آنزیمهای آنتیاکسیدانی را تنظیم میکند و این آنزیمها در هنگام بروز استرساکسیداتیو نقش محافظتی ایفا میکنند (45،46). لذا عدم اندازهگیری شاخصهای آنتیاکسیدانی از محدودیتهای این مطالعه میباشد. بنابراین پیشنهاد میگردد در مطالعات آتی شاخصهای آنتیاکسیدانی و استرساکسیداتیو نیز اندازهگیری شود. از طرفی با توجه به اینکه جامعه آماری این مطالعه موشهای صحرایی دیابتی بودند، جهت نتایج دقیقتر همچنین پیشنهاد میگردد از گروههای غیردیابتی یا سالم و غیردیابتی معتاد به مرفین نیز استفاده گردد.
نتیجهگیری
نتایج حاصل از این مطالعه بیانگر این مسئله است که تمرین مقاومتی ممکن است بر میزان سطح پروتئین p53 در بافت کلیه تاثیرگذار باشد. با توجه به اینکه یافتههای ما نشان داد که تمرین مقاومتی احتمالا با کاهش پروتئین P53 باعث تقلیل آسیب بافت کلیه در رتهای دیابتی و دیابتی همراه با سندروم ترک مرفین میشود که میتوان گفت، تمرین مقاومتی بر بافت کلیه در شرایط پاتولوژیک اثر مثبت و محافظتی دارد.
سپاسگزاری
این مقاله برگرفته از قسمتی از رساله دکتری در رشته فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد بروجرد میباشد. نویسندگان از مسئولین و کادر آزمایشگاه سارا تبریز جهت همکاری صمیمانهشان تشکر و قدردانی میکنند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
کد اخلاق و ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه آزاد اسلامی واحد بروجرد مورد تایید قرار گرفته است. (کد اخلاق :IR.IAU.B.REC.1401.030).
مشارکت نویسندگان
نویسنده اول، دوم و سوم: ایده و طراحی مطالعه، نویسنده اول: جمعآوری دادهها و آنالیز و تفسیر نتایج، نویسنده اول: نگارش نسخه اولیه، نویسنده اول و دوم: ویرایش نسخه اول مقاله، در ضمن و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
اپیدمی دیابت ملیتوس در حال حاضر به یک تهدید جدی برای سلامت جهانی تبدیل شده است (1). هیپرگلیسمی مزمن ناشی از دیابت منجر به استرساکسیداتیو مزمن برای همه بافتها میشود. گلوکز در غلظتهای غیرعادی بالا، گونههای فعال اکسیژن (Reactive Oxygen Species) را تشکیل میدهد که میتواند منجر به آسیب اکسیداتیو در اهداف ثانویه کلاسیک دیابت مانند چشمها، کلیهها، اعصاب و عروق خونی شود (2). کلیهها نقش مهمی در فیلتراسیون مواد زائد خون ایفا میکنند و در شرایط قندخون بالا، آسیب پذیرتر از دیگر بافتها هستند (3). افزایش سطح گونههای فعال اکسیژن(ROS) توسط هیپرگلیسمی میتواند آپوپتوز سلولهای کلیوی را القاء کند (4). P53 یکی از مهمترین سرکوبگرهای تومور بهشمار میرود که در پاسخ به عوامل مختلفی از استرس سلولی مانند آسیب DNA، هایپوکسی شدید، پیری سلولی و فشارهای اکسایشی بالا افزایش یافته و فعال میشود (5). مطالعات اخیر نیز نشان میدهد که p53 نقش مهمی در ایجاد بیماریهای متابولیک، از جمله دیابت دارد (6). همچنین پروتئین P53 در تنظیم آپوپتوز نقش مهمی دارد (7). و توسط ROS تنظیم میشود (8). P53 با پروتئینهای مختلف در غشای خارجی میتوکندری، مانند پروتئینهای ضدآپوپتوز Bcl-2 و Bcl-x تعامل میکند تا فعالیت آنها را مسدود کرده و آپوپتوز را القا کند (8). نشان داده شده است که هیپرگلیسمی از طریق فعال شدن p53 باعث آپوپتوز سلولی میشود (9). از طرفی فاکتور اریتروئید هستهایNuclear Factor Erythroid 2 - Related Factor or Nrf2))، یک فاکتور رونویسی میباشد که نقش مهمی در دفاع سلول علیه آسیبهای اکسیداتیو را ایفا میکند (10). اخیراً، مطالعات نشان دادهاند که Nrf2 به عنوان یک واسطه اصلی برای سیستم دفاعی آنتیاکسیدانی در بدن ما نقش مهمی در جلوگیری از استرساکسیداتیو/ آسیب، التهاب و اختلال عملکرد اندام ناشی از دیابت دارد (11). سطوح پایین Nrf2 در ایجاد استرساکسیداتیو و عدم تعادل وضعیت ردوکس در بیماران دیابتی نقش دارد (12). در واقع، فعالسازی Nrf2 نه تنها از کلیه در برابر آسیب اکسیداتیو ناشی از دیابت محافظت میکند، بلکه سایر اندامها را نیز از دیابت محافظت میکند (11). از طرفی برخی معتقدند که تریاک در برخی از اختلالات بهویژه دیابت اثر درمانی مثبت دارد. بر همین اساس، مردم عادی تریاک را توصیه میکنند و همین امر دلیلی برای مصرف آن است (13). مرفین فعالترین و فراوانترین آلکالوئید در تریاک است (14). ثابت شده است که مرفین استرساکسیداتیو را در سلولهای مختلف اعمال میکند (15). یافتههای سمرقندیان و همکاران (2014) به خطر آسیب کبدی ناشی از استفاده طولانیمدت از مرفین از طریق اختلال در تعادل اکسیدان-آنتیاکسیدان اشاره دارد (16). Singhal و همکاران (1998) نشان دادند که آپوپتوز فیبروبلاستهای کلیه ناشی از مرفین ممکن است از طریق تولید p53 اتفاق بیفتد (17). افزایش حاصل در p53 منجر به القای توقف چرخه سلولی یا آپوپتوز میشود (18). همچنین مصرف طولانیمدت مرفین اثرات منفی دارد و در نتیجه باعث تشدید دیابت، دیسلیپیدمی و فشارخون میشود. بر این اساس، لازم است جوامع را از مضرات احتمالی مصرف غیرمجاز تریاک آگاه کرد (14). از سوی دیگر ورزش در سلامت انسان نقش عمدهای ایفا مینماید. نقش درمانی ورزش در بیماران مبتلا به افزایش فشارخون، افسردگی، اعتیاد و دیابت گزارش شده است (19). در خصوص پیشینه تحقیقاتی اثر تمرینات ورزشی بر متغیرهای این مطالعه، یافتههای مطالعه جوکار و شرافتیمقدم (1400) نشان داد که تمرین HIIT منجر به کاهش پروتئین P53 در بافت عضله قلب موشهای صحرایی مبتلا به دیابت میشود (7). علاوه بر این عباسی و همکاران (1397) مشاهده کردند که اثر هشت هفته تمرین همزمان استقامتی و مقاومتی منجر به افزایش سطوح پلاسمایی Nrf2 مردان جوان گردید (20). با توجه اینکه اثر تمرینات مختلف ورزشی بر بافت کلیه در دیابت همراه با سندروم ترک مرفین نامشخص است و تا کنون مطالعهای در این مورد صورت نگرفته است. لذا تحقیق حاضر برای نخستینبار با هدف بررسی اثر 8 هفته تمرین مقاومتی بر سطوح پروتئینهای P53 و Nrf2بافت کلیه در موشهای صحرایی نر دیابتی همراه با سندروم ترک مرفین انجام شد.
روش بررسی
تحقیق حاضر از نظر هدف کاربردی و از لحاظ شیوه اجرا، تجربی آزمایشگاهی میباشد که به صورت پسآزمون با گروه کنترل انجام گرفت. نمونههای این مطالعه 32 سر موش صحرایی نر نژاد ویستار خریداری شده از دانشگاه بقیۀاالله بودند، با میانگین سن 8 تا 10 هفته و میانگین وزن 30 ±230 گرم، بر اساس وزن به صورت تصادفی به 4 گروه 8 تایی شامل: دیابت، دیابت مرفین، دیابت + ورزش مقاومتی و دیابت مرفین + ورزش مقاومتی تقسیم شدند. موشها به مدت دو هفته در شرایط جدید در قفسهایی از جنس پلیکربنات شفاف، در آزمایشگاه جوندگان در شرایط دمای 2±22 درجه سانتیگراد، رطوبت 40 تا 60 درصد و چرخهی روشنایی به تاریکی 12:12 ساعت با تهویه مناسب و دسترسی به غذا (تهیه شده به صورت پلت از مرکز تولید انواع خوراک دام شرکت بهپرور) و آب (بطریهای500 میلی لیتر ویژه حیوانات آزمایشگاهی) به صورت نامحدود، نگهداری شدند. در خصوص دیابتی نمودن موشها در سال 1998ماسیلو (Masiello) و همکاران مدل جدیدی از دیابت در موشهای صحرایی ارائه دادند که دارای بسیاری از ویژگیهای دیابت نوع 2 انسانی بود. این روش که ناشی از تزریق استرپتوزوتوسین و نیکوتینآمید میباشد برای مدت زمان طولانی ثابت باقی میماند به گونهای که این مدل دیابت نه تنها برای مطالعات حیوانی کوتاه مدت بلکه بلند مدت نیز مناسب است (21). بنابراین براساس روش ماسیلو و همکاران برای دیابتی کردن موشها بعد از 12 ساعت ناشتا با تزریـق درون صـفاقی محلول استرپتوزوتوسـین (سـاخت شرکت سیگما، آمریکـا) محلـول در بـافر سـیترات 0/1 مولار با دوز 65 میلیگرم به ازای هر کیلوگرم وزن بدن که بعد از 15 دقیقه از تزریق محلول نیکوتینآمید (ساخت شـرکت سـیگما، آمریکـا) محلول شده در نرمالسالین با دوز 120 میلیگرم برای هر کیلوگرم وزن بدن استفاده شد. 72 ساعت پس از تزریق جهت اطمینـان از دیـابتی بودن (معیار ورود و خروج به مطالعه)، مـوشهـای صحرایی کـه میزان قندخون آنهـا بیشـتر از 250 میلیگرم/دسیلیتر (mg/dl) بود بــه عنــوان دیــابتی در نظــر گرفتــه شدند (22). سطوح قندخون با خونگیری بعد از 12 ساعت ناشتا، از انتهای دم موشها توسط گلوکومتر (بیورر مدل GL42، ساخت کشور آلمان) اندازهگیری شد (23). پروتکل سندروم ترک مرفین پس از تایید القاء دیابت صورت گرفت. جهت ایجاد وابستگی به مرفین از روش خوراکی استفاده شد. مرفین در آب آشامیدنی حیوانات با غلظتهای متوالی 0/1، 0/2 و0/3 میلـیگـرم بر میلیلیتر هرکدام برای 48 سـاعت، سپس 0/4 میلـیگـرم در میلـیلیتـر بـرای بقیـه روزهـا تـا روز 21 ، به آب اضافه شد (24). همچنین با توجه به دیابتی بودن موشها و طعم تلخ مرفین از شیرینکننده مصنوعی مناسب با غلظت 3 درصد استفاده و به آب آشامیدنی اضافه شد. برای اطمینان از وابستگی ناشی از مرفین در حیوانات در پایان روز 21، نالوکسان (شـرکت سـیگما آمریکـا) به میزان 2 میلیگرم به ازای هر کیلوگرم وزن بدن به صورت داخل صفاقی بـه نمونهها تزریـق شد و علایـم ترک اعتیاد از جمله پریدن، بالا رفـتن، خارانـدن، دنـدان قروچـه، قرمـزی دور چـشم، اسـهال، لـرزش، افتـادگی پلک، نعوظ و روی دو پا ایستادن برای مـدت 30 دقیقـه بررســی گردید (25). مشاهده شد که نالوکسان علائم ترک مرفین را در حیوانات معتاد القا کرد. پروتکل تمرین مقاومتی نیز بعد از یک هفته آشنایی موشها به بالا رفتن از نردبان، به مدت 8 هفته اجرا گردید که شامل بالا رفتن از نردبانی به طول 1 متر، دارای 26 پله با فاصله 4 سانتیمتر و شیب 85 درجه بود. بدین صورت انجام شد که وزنهای معادل 50 درصد وزن موش به دم آن متصل بود و این میزان بر اساس اصل اضافه بار به تدریج به 200 درصد وزن بدن حیوانات در هفته آخر رسید (جدول 1) و در این حالت حیوان از نردبان بالا میرفت. این برنامه هفتهای سه جلسه انجام گرفت. تمرینات روزانه در سه نوبت و هر نوبت شامل 4 بار صعود از نردبان بود. بین نوبتها سه دقیقه استراحت و بین تکرارها یک دقیقه استراحت وجود داشت (26). در صـورت خـودداری از صـعود، شوک الکتریکی کموات استفاده شد (27).
جدول 1: تمرینات مقاومتی در 3 دور 4 تکراری روی نردبان 1 متری با 26 پله با فاصله 4 سانتیمتری

چهل و هشت ساعت پس از آخرین جلسه تمرین، همه موشها با ترکیبی از 75 میلیگرم/کیلوگرم وزن بدن، کتامین و 10 میلیگرم/ کیلوگرم وزن بدن، زایلازین بیهوش، کشته، تشریح و بافت کلیه جدا گردید. بعد از شستن بافتها با نرمالسالین، به سرعت در مخازن نیتروژن مایع به مدت 2 دقیقه غوطهور شدند و جهت انتقال به آزمایشگاه در دمای منفی70 درجه سانتیگراد نگهداری شدند، سطوح پروتئین شاخصهای این پژوهش توسط کیتهای الایزا مخصوص موش صحرایی مطابق دستورالعمل شرکت تولیدکننده اندازهگیری شدند اندازهگیری سطح پروتئین P53 این مطالعه توسط کیت الایزا شرکت RayBiotech ساخت کشور آمریکا با شماره کاتالوگ ELR-p53 وحساسیت 0/32 نانوگرم بر میلیلیتر انجام گرفت. همچنین سطح پروتئین Nrf2 با کیت الایزا شرکت Novus biologicals محصول کشور آمریکا با شماره کاتالوگ NBP3-08161 و حساسیت 9/38 پیکوگرم در میلیلیتر اندازهگیری شد.
تجزیه و تحلیل آماری
برای تجزیه و تحلیل اطلاعات این پژوهش از نرمافزار version 16 SPSSاستفاده شد و جهت اطمینان از نرمال بودن دادهها از آزمون شاپیرویلک و همچنین در مقایسه میانگین گروههای مورد مطالعه از آزمون تحلیل واریانس آنوای یکراهه و آزمون تعقیبی توکی با سـطح معنیداری p≤0/05استفاده شد.
نتایج
میانگین، انحراف معیار و نتایج آنالیز واریانس یکراهه متغیرهای مورد مطالعه در گروههای این پژوهش در جدول 3و2 ارائه شده است. همچنین میانگین قندخون گروههای مورد مطالعه در ابتدا و انتهای این پژوهش نیز در جدول 3 آمده است. در مقایسه بین گروهی متغیر P53 این پژوهش با استفاده از آزمون آنالیز واریانس یکطرفه (10/198 =F و 0/001=p) و متغیرNrf2 ( F=8/227 و P=0/003 ) مشاهده شد که اختلاف معنادار است.
جدول 2 : میانگین، انحراف معیار و نتایج آنالیز واریانس یکراهه متغیرهای P53 وNrf2 بافت کلیه در گروههای مورد مطالعه
.JPG)
D = دیابت .DM = دیابت مرفین . D.RT = دیابت + تمرین مقاومتی . DM.RT = دیابت مرفین + تمرین مقاومتی
SD ±M= میانگین ± انحراف معیار. سـطح معنی داری p≤0/05
جدول 3: میانگین قندخون گروههای مورد مطالعه در ابتدا و انتهای مطالعه

D = دیابت .DM = دیابت مرفین . D.RT = دیابت + تمرین مقاومتی . DM.RT = دیابت مرفین + تمرین مقاومتی
نتایج آزمون تعقیبی توکی در خصوص متغیر P53(نمودار 1) نشان داد که گروههای دیابت + تمرین مقاومتی(0/006=P) و دیابت مرفین + تمرین مقاومتی(0/023=P) نسبت به گروه دیابت کاهش معنادار داشته است و همچنین گروه دیابت مرفین + تمرین مقاومتی(0/012=P) نسبت به گروه دیابت مرفین نیز کاهش معنادار دارد.

نمودار 1 : سطح پروتئین P53 در گروه های مورد مطالعه
:کاهش معنادار نسبت به گروه دیابت ، : کاهش معنادار نسبت به گروه دیابت مرفین
نتایج آزمون تعقیبی توکی در خصوص متغیر Nrf2 (نمودار 2) نشان داد که گروه دیابت مرفین(0/010=P) نسبت به گروه دیابت افزایش معنادار داشته است. گروههای دیابت مرفین + تمرین مقاومتی (0/013=P) و دیابت + تمرین مقاومتی(0/003=P) نسبت به گروه دیابت مرفین کاهش معنادار نشان داد.

نمودار 2 : سطح پروتئین Nrf2 در گروه های مورد مطالعه
:افزایش معنادار نسبت به گروه دیابت : کاهش معنادار نسبت به گروه دیابت مرفین
بحث
نتایج این پژوهش نشان داد که 8 هفته تمرین مقاومتی موجب کاهش معنیدار فاکتور تنظیمی آپوپتوز P53 در بافت کلیه رتهای دیابتی و دیابتی همراه با سندروم ترک در گروههای تمرین شده است در ضمن بر اساس جستجوهای بعمل آمده تاکنون مطالعهای مطابق با موضوع مطالعه حاضر در بافت کلیه و سایر بافتهای بدن انجام نشده است. مطالعات مداخلهای تمرینات ورزشی به شدت از اثربخشی آن برای پیشگیری و مدیریت دیابت حمایت میکند (28). همسو با مطالعه حاضر جانبزرگی و همکاران (1401) در مطالعه هشت هفته تمرین هوازی در موشهای مبتلا به دیابت نوع دو، کاهش معنیدار غلظت پروتئینP53 را در بافت پانکراس مشاهده کردند (29). جهانتاش و همکاران (1400) نیز نشان دادند که تمرین تناوبی به کاهش بیان ژن P53 در سلولهای کبدی در رتهای چاق دیابتی منجر شد (30). همچنین نتایج مطالعه حسنپور و همکاران (2017) نشان داد که تمرین HIIT منجر به کاهش غیرمعنادار سطوح پروتئین P53 در قلب موشهای دیابتی شد (31). و همینطور یافتههای مطالعه جوکار و شرافتیمقدم (1400) نیز نشان داد که تمرین HIIT منجر به کاهش محتوای بافتی پروتئینP53 قلب موشهای دیابتی میشود (7). کاهش معنادار سطوح P53 بخش کلورکتال (colorectal) بافت روده بزرگ (کولون و رکتوم) رتها پس از ۸ هفته تمرین مقاومتی توسط عسگری و همکاران (2017) نیز گزارش شده است (32) که با یافتههای این مطالعه مطابقت دارد. از طرفی سیدقمی و همکاران (1396) مشاهده کردند که تمرین استقامتی با شدت بالا، تفاوت معناداری در بیان ژن p53 عضله اسکلتی ایجاد نکرد (33) که با نتایج این پژوهش مطابقت ندارد. از دلایل احتمالی آن میتوان به شدت تمرین و روش اندازهگیری و دیابتی نبودن نمونهها اشاره کرد. اما در خصوص پیشینه تحقیقاتی اثر تمرینات مختلف ورزشی بر فاکتور P53 در سندروم ترک مطالعهای یافت نشد. یافتههای ما در این خصوص نشان داد که اثر تمرین مقاومتی در گروه سندروم ترک (دیابت مرفین) نیز باعث کاهش معنادار سطح پروتئین P53 شده است. دیابت با افزایش فشاراکسایشی همراه بوده و استرساکسایشی نقش مهمی در پیشرفت دیابت دارد (34). از سوی دیگر، تریاک و متابولیت آن مانند مرفین با تحویل مستقیم گونههای فعال اکسیژن (ROS) و تحریک تولید ROS درونزا از طریق تحریک سلولهای التهابی، استرساکسیداتیو را افزایش میدهد (35). همچنین مرفین میتواند بهطور مستقیم فعالیت دفاعی آنتیاکسیدانی را در بدن کاهش دهد. بهنظر میرسد که تشکیل ROS یکی از مکانیسمهای اصلی در پس سوءمصرف مرفین است که با کاهش آنزیمهای آنتیاکسیدانی مرتبط است (16). با این حال، ورزش و فعالیت منظم میتواند منجر به کاهش استرس اکسیداتیو شود (36). مشاهده شده است که تمرین مقاومتی موجب کاهش قندخون و استرساکسایشی در رتهای ویستار دیابتی میشود (37). همچنین مطالعات نشان دادهاند که تمرینات ورزشی از طریق کاهش استرساکسیداتیو و آپوپتوز نقش حفاظتی در سلولها در برابر عوارض ناشی از دیابت ایفا میکنند (38). در مطالعهای دیگر نشان داده شد که استفاده از انواع مختلف تمرین ورزشی باعث افزایش شاخصهای آنتیاکسیدانی و کاهش شاخصهای استرساکسیداتیو و التهابی در بافت کبد گروه سندروم ترک مرفین گردید و ورزش سبب بهبود آسیب بافتی کبد، ناشی از مصرف مرفین در این گروه شد (39). در بررسی اثر تمرینات مختلف ورزشی در موشهای معتاد به مرفین مشاهده شد که ورزش سبب بهبود وضعیت آنتیاکسیدانی در روده موشهای قطع مصرف میشود (40). از سوی دیگر ورزش با آزادسازی اپیوئیدهای درونزاد باعث کاهش علائم وابستگی در حیوانات معتاد میگردد و در نتیجه تمایل به مصرف مرفین و سایر مواد اعتیادآور را کاهش میدهد (19) بنابراین با توجه به اینکه ورزش علائم ترک اعتیاد به مرفین را کاهش میدهد به نظر میرسد که در کاهش آثار سمی این ترکیب نیز نقش داشته باشد (19). لذا یکی از دلایل کاهش P53 در اثر فعالیتهای ورزشی و در این مطالعه این است که تمرینات منظم باعث کاهش استرساکسیداتیو و بالا رفتن دفاع آنتیاکسیدانی بدن میشوند (41). و با توجه به پژوهشهای انجام شده، از دلایل اصلی افزایش مقادیر P53 فرایندهای ایجاد شده ناشی از فشارهای اکسایشی است(32). بنابراین چون یکی از دلایل افزایش P53 افزایش استرساکسیداتیو است، میتوان انتظار داشت سطوح پروتئین P53 نیز بدلیل مهار استرساکسیداتیو کاهش پیدا کند (41). همچنین یافتههای این پژوهش نشان داد که تمرین مقاومتی در گروه دیابت + تمرین مقاومتی در مقایسه با گروه کنترل دیابت باعث افزایش غیرمعنیدار فاکتور تنظیمی آنتیاکسیدانی Nrf2 گردیده است. اما تمرین مقاومتی منجر به کاهش معنیدار Nrf2 در گروه دیابت مرفین + تمرین مقاومتی نسبت به گروه دیابت مرفین شد. گروه دیابت مرفین نیز در مقایسه با گروه دیابت افزایش معناداری را نشان داد. در خصوص پیشینه تحقیقاتی متغیر Nrf2 همسو با نتایج ما، مطالعه باعزم و همکاران (1401) نشان داد که القای دیابت در رتها باعث کاهش معنادار بیان ژنNrf2 در بافت بیضه شد و انجام ده هفته تمرین استقامتی منجر به افزایش معنادار سطح Nrf2 گردید (42). عباسی و همکاران (1397) نیز مشاهده کردند که هشت هفته تمرین همزمان استقامتی و مقاومتی منجر به افزایش سطوح پلاسمایی Nrf2 در مردان جوان گردید (20). این نتایج هم راستا با نتایج ما میباشد زیرا یافتههای ما نیز نشان داد که 8 هفته تمرین مقاومتی منجر به افزایش غیرمعنادار Nrf2 در گروه دیابت + تمرین مقاومتی شده است. در خصوص پیشینه تحقیقاتی اثر تمرینات مختلف ورزشی بر متغیر Nrf2 در سندروم ترک مطالعهای یافت نشد. اما نتایج ما نشان داد که تمرین مقاومتی موجب کاهش معنادار سطح پروتئین Nrf2 در گروه دیابت مرفین + تمرین مقاومتی در مقایسه با گروه دیابت مرفین شد که مکانیسم آن نامشخص است و تحقیقات بیشتری برای روشن شدن این موضوع لازم است. علاوه بر این، یافتههای ما نشان داد که مداخله مرفین باعث افزایش معنادار سطح Nrf2 در گروه دیابت مرفین در مقایسه با گروه دیابت شد. همسو با این نتایج، در مطالعهای نشان داده شد که Nrf2 در قشر پیشانی و جسم مخطط موشهای تحت درمان با مرفین افزایش مییابد (43). علاوه بر این Huang (2022) نیز نشان داد که مرفین میتواند بهطور قابلتوجهی بیان Nrf2 را افزایش دهد (44). مکانیسم آن ممکن است به علت بالا رفتن استرساکسیداتیو در اثر مصرف مرفین (15) باشد. هر چند دلیل اصلی آن نامشخص است و نیاز به مطالعات بیشتر ضروری است. ثابت شده است که Nrf2 به عنوان یک فاکتور رونویسی، برخی از آنزیمهای آنتیاکسیدانی را تنظیم میکند و این آنزیمها در هنگام بروز استرساکسیداتیو نقش محافظتی ایفا میکنند (45،46). لذا عدم اندازهگیری شاخصهای آنتیاکسیدانی از محدودیتهای این مطالعه میباشد. بنابراین پیشنهاد میگردد در مطالعات آتی شاخصهای آنتیاکسیدانی و استرساکسیداتیو نیز اندازهگیری شود. از طرفی با توجه به اینکه جامعه آماری این مطالعه موشهای صحرایی دیابتی بودند، جهت نتایج دقیقتر همچنین پیشنهاد میگردد از گروههای غیردیابتی یا سالم و غیردیابتی معتاد به مرفین نیز استفاده گردد.
نتیجهگیری
نتایج حاصل از این مطالعه بیانگر این مسئله است که تمرین مقاومتی ممکن است بر میزان سطح پروتئین p53 در بافت کلیه تاثیرگذار باشد. با توجه به اینکه یافتههای ما نشان داد که تمرین مقاومتی احتمالا با کاهش پروتئین P53 باعث تقلیل آسیب بافت کلیه در رتهای دیابتی و دیابتی همراه با سندروم ترک مرفین میشود که میتوان گفت، تمرین مقاومتی بر بافت کلیه در شرایط پاتولوژیک اثر مثبت و محافظتی دارد.
سپاسگزاری
این مقاله برگرفته از قسمتی از رساله دکتری در رشته فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد بروجرد میباشد. نویسندگان از مسئولین و کادر آزمایشگاه سارا تبریز جهت همکاری صمیمانهشان تشکر و قدردانی میکنند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
کد اخلاق و ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه آزاد اسلامی واحد بروجرد مورد تایید قرار گرفته است. (کد اخلاق :IR.IAU.B.REC.1401.030).
مشارکت نویسندگان
نویسنده اول، دوم و سوم: ایده و طراحی مطالعه، نویسنده اول: جمعآوری دادهها و آنالیز و تفسیر نتایج، نویسنده اول: نگارش نسخه اولیه، نویسنده اول و دوم: ویرایش نسخه اول مقاله، در ضمن و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Amanat S, Ghahri S, Dianatinasab A, Fararouei M, Dianatinasab M. Exercise and Type 2 Diabetes. Adv Exp Med Biol 2020; 1228: 91-105.
2- Robertson RP, Harmon JS. Diabetes, Glucose Toxicity, and Oxidative Stress: A Case of Double Jeopardy for the Pancreatic Islet Beta Cell. Free Radic Biol Med 2006; 41(2): 177-84.
3- Farokhi F, Kafash-Farkhad N, Asadi-Samani M. Preventive Effects of Hydroalcoholic Extract of Prangosferulacea (L.) Lindl.on Kidney Damages of Diabetic Rats Induced by Alloxan. J Sharekord Univ Med Sci 2013; 14(6): 72-81. [Persian]
4- Wagener FA, Dekker D, Berden JH, Scharstuhl A, van der Vlag J. The Role of Reactive Oxygen Species in Apoptosis of the Diabetic Kidney. Apoptosis 2009; 14(12): 1451-8.
5- Ghorbanalizadeh M, Bashiri J, Gholami F. Effect of 12-Week Aerobic Training on Cardiac P53 and AIF Gene Expression in Male Rats]. Med J Tabriz Uni Med Sciences Health Services 2020; 42(3): 310-8. [https://doi.org/10.34172/mj.2020.050]
6- Kung CP, Murphy ME. The Role of the P53 Tumor Suppressor in Metabolism and Diabetes. J Endocrinol 2016; 231(2): 61-75.
7- Jokar M, Sherafati Moghadam M. Effect of 4 Weeks of High-Intensity Interval Training on P53 and Caspase-3 Proteins Content in the Heart Muscle Tissue of Rats with Type 1 Diabetes. J Shahid Sadoughi Uni Med Sci 2022; 29(11): 4255-4267. [http://jssu.ssu.ac.ir/article-1-4947-fa.html]
8- Sharafi H, Rahimi R. The Effect of Resistance Exercise on P53, Caspase-9, and Caspase-3 in Trained and Untrained Men. J Strength Cond Res 2012; 26(4); 1142-48.
9- Flores-López LA, Díaz-Flores M, García-Macedo R, Ávalos-Rodríguez A, Vergara-Onofre M, Cruz M, et al. High Glucose Induces Mitochondrial P53 Phosphorylation by P38 MAPK in Pancreatic Rinm5f Cells. Mol Biol Rep 2013; 40(8): 4947-58.
10- Cuadrado A, Pajares M, Benito C, Jiménez-Villegas J, Escoll M, Fernández-Ginés R, et al. Can Activation of NRF2 be a Strategy against COVID-19? Trends Pharmacol Sci 2020; 41(9): 598-610.
11- Li B, Liu S, Miao L, Cai L. Prevention of Diabetic Complications by Activation of Nrf2: Diabetic Cardiomyopathy and Nephropathy. Exp Diabetes Res 2012; 2012: 216512.
12- Jiménez-Osorio AS, Picazo A, González-Reyes S, Barrera-Oviedo D, Rodríguez-Arellano ME, Pedraza-Chaverri J. Nrf2 and Redox Status in Prediabetic and Diabetic Patients. Int J Mol Sci 2014; 15(11): 20290-305.
13- Asadikaram G, Asiabanha M, Sirati Sabet M. Ovary Cells Apoptosis in Opium-Addicted Diabetic and Non-Diabetic Rats. Int J High Risk Behav Addict 2013; 2(1): 3-7.
14- Najafipour H, Beik A. The Impact of Opium Consumption on Blood Glucose, Serum Lipids and Blood Pressure, and Related Mechanisms. Front Physiol 2016; 7: 436.
15- Bhat RS, Bhaskaran M, Mongia A, Hitosugi N, Singhal PC. Morphine-Induced Macrophage Apoptosis: Oxidative Stress and Strategies for Modulation. J Leukoc Biol 2004; 75(6): 1131–8.
16- Samarghandian S, Afshari R, Farkhondeh T. Effect of Long-Term Treatment of Morphine on Enzymes, Oxidative Stress Indices and Antioxidant Status in Male Rat Liver. Int J Clin Exp Med 2014; 7(5): 1449-53.
17- Singhal PC, Sharma P, Sanwal V, Prasad A, Kapasi A, Ranjan R, et al. Morphine Modulates Proliferation of Kidney Fibroblasts. Kidney Int 1998; 53(2): 350-7.
18- Liebermann DA, Hoffman B, Steinman RA. Molecular Controls of Growth Arrest and Apoptosis: P53-Dependent and Independent Pathways. Oncogene 1995; 11(1): 199-210.
19- Ahmadizadeh M, Sarkaki A, Farboud Y, Mohammadian B, Rahim F. Effect of Exercise on Morphine-Induced Toxicity in Rat Liver and Kidney. Jundishapur Sci Med J 2012; 11(3): 325-33. [Persian]
20- Avandi SM, Hagh Shenas R, Abbasi S. The Effect of Eight Weeks Concurrent Training on Plasma Levels of NRF2 in Young Men. Journal of Applied Health Studies in Sport Physiology 2018; 5(2): 78-83. [Persian]
21- Kazemi F. The Effect of Endurance Training on Some Metabolic Parameters of Nicotinamide and Streptozotocin Induced Type 2 Diabetic Rats. Journal of Sport Biosciences 2017; 9(4): 457-71. [Persian]
22- Punitha IS, Rajendran K, Shirwaikar A, Shirwaikar A. Alcoholic Stem Extract of Coscinium Fenestratum Regulates Carbohydrate Metabolism and Improves Antioxidant Status in Streptozotocin-Nicotinamide Induced Diabetic Rats. Evid Based Complement Alternat Med 2005; 2(3): 375-81.
23- Parastesh M, Nadi Z. The Effects of Regular Resistance Training on the Liver’s Inflammatory Indexes, Chemerin, Resistin, and Insulin Resistance Index in Healthy and Type 2 Diabetic Male Rats. J Arak Uni Med Sci 2020; 23(1): 48-59. [Persian]
24- Jalalvand A, Heidarianpour A, Almasi J. Acute Effects of Swimming Exercise on Withdrawal Syndrome Sign in Morphine-Dependent Rats. J Sabzevar Uni Med Sci 2013; 20(3): 373-9. [Persian]
25- Salmanzadeh F, Fathollahi Y, Semnanian S, Shafizadeh M, Kazemnejad A. Dependence on Morphine Leads to a Prominent Sharing among the Different Mechanisms of Long-Term Potentiation in the CA1 Region of Rat Hippocampus. Brain Res 2003; 963(1-2): 93-100.
26- Mardani Salmi M, Reisi J, Esfarjani F, Zamani S. Effect of 8 Weeks Resistance Training and Irisin Injection on BDNF and Spatial Memory of Male Mice. Sport Physiology 2020; 12(46): 157-74. [Persian]
27- Banaeifar A, Gorzi A, Hedayati M, Nabiollahi Z, Rahmani-Moghaddam N, Khantan M. Effect of an 8-Week Resistance Training Program on Acetylcholinesterase Activity in Rat Muscle. Feyz 2012; 15(4): 316-21. [Persian]
28- Castaneda C. Type 2 Diabetes Mellitus and Exercise. Nutr Clin Care 2000; 3(6): 349-58.
29- Janbozorgi M, Gaini AA, Choobineh S, Tabandeh MR. The Effect of Eight Weeks of Aerobic Exercise on the Expression of Senescence Proteins P53 and P16 in Pancreatic Tissue of Diabetic Mice. ijdld 2022; 22 (1) :45-54. [Persian]
30- Jahantash M, Abed Natanzi H, Gholami M, Ghazalian F. Changes in Hepatocyte P53 Gene Expression and Insulin Resistance Index in Obese Diabetic Rats after Interval Training and N-Chromosomal Royal Jelly. RJMS 2022; 28(12): 28-42. [http://magiran.com/p2429585]
31- Hassanpour G, Nik Bakht HA, Azarbayjani MA, Shakeri N, Abednazari H. The Effect of Interval and Continued Trainings with Crocin on Apoptotic Markers in the Heart Tissue of High-Fat Diet and Streptozotocin Induced Type 2 Diabetic Rats. Rep Health Care 2017; 3(3): 58-70.
32- Askari B, Bijeh N, Rashid Lamir A. Effects of 8 Weeks of Resistance Training and IGF-1 Injection on Biochemical Markers of Cancer and Colorectal Structures in Rats. Mljgoums 2017; 11(6): 23-9.
33- Seyedgomi F, Bashiri J, Gholami F. Effect of High Intensity Endurance Training on P53 and Cytochrome-C Gene Expression in Male Rat Soleus Muscle. Armaghane Danesh 2017; 22(5): 608-22. [Persian]
34- Sahraei M, Abdi A, Jalal H. Protective Effect of Berberine Chloride and Aerobic Training on Liver Nrf2/Ho-1 Pathway and Pparγ in Streptozotocin-Induced Diabetic Rats. J Ardabil Univ Med Sci 2020; 20(3): 296-306. [Persian]
35- Salarian A, Kadkhodaee M, Zahmatkesh M, Seifi B, Bakhshi E, Akhondzadeh S, et al. Opioid Use Disorder Induces Oxidative Stress and Inflammation: The Attenuating Effect of Methadone Maintenance Treatment. Iran J Psychiatry 2018; 13(1): 46-54.
36- Maybaum S, Ilan M, Mogilevsky J, Tzivoni D. Improvement in Ischemic Parameters during Repeated Exercise Testing: A Possible Model for Myocardial Preconditioning. Am J Cardiol 1996; 78(10): 1087-91.
37- Khorram H, Ravasi A, Hedayati M, Samadi A, Gaeini A. Effect of Eight Weeks of Resistance Training on Oxidative Stress in Diabetic Rats. Journal of Sabzevar Uni of Med Sci 2013; 20(3): 389-99. [Persian]
38- Kanter M, Aksu F, Takir M, Kostek O, Kanter B, Oymagil A, et al. Effects of Low Intensityexercise against Apoptosis and Oxidative Stressstreptozotocin-Induced Diabetic Rat Heart. Exp Clin Endocrinol Diabetes 2017; 125(9): 583-91.
39- Abbasi E, Salehi I, Zarin Kalam E, Ranjbar K. Mirzaei F, Komaki A, et al. Protective Effect of Exercise on Liver Oxidative Stress, Inflammation and Histopathological Changes after Morphine Withdrawal in Rats. J Mazandaran Univ Med Sci 2022; 32(207): 26-37. [Persian]
40- Salehi I, Zarrinkalam E, Mirzaei F, Abasi Oshaghi E, Ranjbar K, Soleimani Asl S. Effects of Resistance, Endurance, and Concurrent Exercise on Oxidative Stress Markers and the Histological Changes of Intestine after Morphine Withdrawal in Rats. Avicenna J Med Biochem 2018; 6(2): 44-9.
41- Dashtiyan AA, Afzalpour ME, Tanideh N, Sepehrimanesh M. The Comparison of the Effect of Vitamin E on the Expression of P53/Pten of Prostate Gland of Male Rats in Two Groups of Intensive Continuous and Intermittent Exercise Training. JABS 2017; 7(3): 406-15. [Persian]
42- Nadi Z, Abbasi Y, Jalali Mashayekhi F, Bayat M, Bayat P, Baazm M. Correction to: Effect of Resistance and Endurance Trainings on Nrf2/Keap1 Signaling Pathway in Testicular Tissue of Type 2 Diabetic Rats. J Mazandaran Univ Med Sci 2022, 32(214): 24-34. [Persian]
43- Yun J, Lee Y, Yun K, Oh S. Bergenin Decreases the Morphine-Induced Physical Ddependence via Antioxidative Activity in Mice. Arch Pharm Res 2015; 38(6): 1248-54.
44- Huang X, Feng Y, Deji C, Yan X, Bai Y, Wei Sh. The Nuclear Factor E2-Related Factor 2 Participates in Morphine-Induced Autophagy. Research Square Posted 2022; 1-16.
45- Wang Y, Yang C, Elsheikh NAH, Li C, Yang F, Wang G, et al. HO-1 Reduces Heat Stress-Induced Apoptosis in Bovine Granulosa Cells by Suppressing Oxidative Stress. Aging (Albany NY) 2019; 11(15): 5535-47.
46- Feng Y, Cui R, Li Z, Zhang X, Jia Y, Zhang X, et al. Methane Alleviates Acetaminophen-Induced Liver Injury by Inhibiting Inflammation, Oxidative Stress, Endoplasmic Reticulum Stress, and Apoptosis through the Nrf2/HO-1/NQO1 Signaling Pathway. Oxid Med Cell Longev 2019; 2019: 7067619.
1- Amanat S, Ghahri S, Dianatinasab A, Fararouei M, Dianatinasab M. Exercise and Type 2 Diabetes. Adv Exp Med Biol 2020; 1228: 91-105.
2- Robertson RP, Harmon JS. Diabetes, Glucose Toxicity, and Oxidative Stress: A Case of Double Jeopardy for the Pancreatic Islet Beta Cell. Free Radic Biol Med 2006; 41(2): 177-84.
3- Farokhi F, Kafash-Farkhad N, Asadi-Samani M. Preventive Effects of Hydroalcoholic Extract of Prangosferulacea (L.) Lindl.on Kidney Damages of Diabetic Rats Induced by Alloxan. J Sharekord Univ Med Sci 2013; 14(6): 72-81. [Persian]
4- Wagener FA, Dekker D, Berden JH, Scharstuhl A, van der Vlag J. The Role of Reactive Oxygen Species in Apoptosis of the Diabetic Kidney. Apoptosis 2009; 14(12): 1451-8.
5- Ghorbanalizadeh M, Bashiri J, Gholami F. Effect of 12-Week Aerobic Training on Cardiac P53 and AIF Gene Expression in Male Rats]. Med J Tabriz Uni Med Sciences Health Services 2020; 42(3): 310-8. [https://doi.org/10.34172/mj.2020.050]
6- Kung CP, Murphy ME. The Role of the P53 Tumor Suppressor in Metabolism and Diabetes. J Endocrinol 2016; 231(2): 61-75.
7- Jokar M, Sherafati Moghadam M. Effect of 4 Weeks of High-Intensity Interval Training on P53 and Caspase-3 Proteins Content in the Heart Muscle Tissue of Rats with Type 1 Diabetes. J Shahid Sadoughi Uni Med Sci 2022; 29(11): 4255-4267. [http://jssu.ssu.ac.ir/article-1-4947-fa.html]
8- Sharafi H, Rahimi R. The Effect of Resistance Exercise on P53, Caspase-9, and Caspase-3 in Trained and Untrained Men. J Strength Cond Res 2012; 26(4); 1142-48.
9- Flores-López LA, Díaz-Flores M, García-Macedo R, Ávalos-Rodríguez A, Vergara-Onofre M, Cruz M, et al. High Glucose Induces Mitochondrial P53 Phosphorylation by P38 MAPK in Pancreatic Rinm5f Cells. Mol Biol Rep 2013; 40(8): 4947-58.
10- Cuadrado A, Pajares M, Benito C, Jiménez-Villegas J, Escoll M, Fernández-Ginés R, et al. Can Activation of NRF2 be a Strategy against COVID-19? Trends Pharmacol Sci 2020; 41(9): 598-610.
11- Li B, Liu S, Miao L, Cai L. Prevention of Diabetic Complications by Activation of Nrf2: Diabetic Cardiomyopathy and Nephropathy. Exp Diabetes Res 2012; 2012: 216512.
12- Jiménez-Osorio AS, Picazo A, González-Reyes S, Barrera-Oviedo D, Rodríguez-Arellano ME, Pedraza-Chaverri J. Nrf2 and Redox Status in Prediabetic and Diabetic Patients. Int J Mol Sci 2014; 15(11): 20290-305.
13- Asadikaram G, Asiabanha M, Sirati Sabet M. Ovary Cells Apoptosis in Opium-Addicted Diabetic and Non-Diabetic Rats. Int J High Risk Behav Addict 2013; 2(1): 3-7.
14- Najafipour H, Beik A. The Impact of Opium Consumption on Blood Glucose, Serum Lipids and Blood Pressure, and Related Mechanisms. Front Physiol 2016; 7: 436.
15- Bhat RS, Bhaskaran M, Mongia A, Hitosugi N, Singhal PC. Morphine-Induced Macrophage Apoptosis: Oxidative Stress and Strategies for Modulation. J Leukoc Biol 2004; 75(6): 1131–8.
16- Samarghandian S, Afshari R, Farkhondeh T. Effect of Long-Term Treatment of Morphine on Enzymes, Oxidative Stress Indices and Antioxidant Status in Male Rat Liver. Int J Clin Exp Med 2014; 7(5): 1449-53.
17- Singhal PC, Sharma P, Sanwal V, Prasad A, Kapasi A, Ranjan R, et al. Morphine Modulates Proliferation of Kidney Fibroblasts. Kidney Int 1998; 53(2): 350-7.
18- Liebermann DA, Hoffman B, Steinman RA. Molecular Controls of Growth Arrest and Apoptosis: P53-Dependent and Independent Pathways. Oncogene 1995; 11(1): 199-210.
19- Ahmadizadeh M, Sarkaki A, Farboud Y, Mohammadian B, Rahim F. Effect of Exercise on Morphine-Induced Toxicity in Rat Liver and Kidney. Jundishapur Sci Med J 2012; 11(3): 325-33. [Persian]
20- Avandi SM, Hagh Shenas R, Abbasi S. The Effect of Eight Weeks Concurrent Training on Plasma Levels of NRF2 in Young Men. Journal of Applied Health Studies in Sport Physiology 2018; 5(2): 78-83. [Persian]
21- Kazemi F. The Effect of Endurance Training on Some Metabolic Parameters of Nicotinamide and Streptozotocin Induced Type 2 Diabetic Rats. Journal of Sport Biosciences 2017; 9(4): 457-71. [Persian]
22- Punitha IS, Rajendran K, Shirwaikar A, Shirwaikar A. Alcoholic Stem Extract of Coscinium Fenestratum Regulates Carbohydrate Metabolism and Improves Antioxidant Status in Streptozotocin-Nicotinamide Induced Diabetic Rats. Evid Based Complement Alternat Med 2005; 2(3): 375-81.
23- Parastesh M, Nadi Z. The Effects of Regular Resistance Training on the Liver’s Inflammatory Indexes, Chemerin, Resistin, and Insulin Resistance Index in Healthy and Type 2 Diabetic Male Rats. J Arak Uni Med Sci 2020; 23(1): 48-59. [Persian]
24- Jalalvand A, Heidarianpour A, Almasi J. Acute Effects of Swimming Exercise on Withdrawal Syndrome Sign in Morphine-Dependent Rats. J Sabzevar Uni Med Sci 2013; 20(3): 373-9. [Persian]
25- Salmanzadeh F, Fathollahi Y, Semnanian S, Shafizadeh M, Kazemnejad A. Dependence on Morphine Leads to a Prominent Sharing among the Different Mechanisms of Long-Term Potentiation in the CA1 Region of Rat Hippocampus. Brain Res 2003; 963(1-2): 93-100.
26- Mardani Salmi M, Reisi J, Esfarjani F, Zamani S. Effect of 8 Weeks Resistance Training and Irisin Injection on BDNF and Spatial Memory of Male Mice. Sport Physiology 2020; 12(46): 157-74. [Persian]
27- Banaeifar A, Gorzi A, Hedayati M, Nabiollahi Z, Rahmani-Moghaddam N, Khantan M. Effect of an 8-Week Resistance Training Program on Acetylcholinesterase Activity in Rat Muscle. Feyz 2012; 15(4): 316-21. [Persian]
28- Castaneda C. Type 2 Diabetes Mellitus and Exercise. Nutr Clin Care 2000; 3(6): 349-58.
29- Janbozorgi M, Gaini AA, Choobineh S, Tabandeh MR. The Effect of Eight Weeks of Aerobic Exercise on the Expression of Senescence Proteins P53 and P16 in Pancreatic Tissue of Diabetic Mice. ijdld 2022; 22 (1) :45-54. [Persian]
30- Jahantash M, Abed Natanzi H, Gholami M, Ghazalian F. Changes in Hepatocyte P53 Gene Expression and Insulin Resistance Index in Obese Diabetic Rats after Interval Training and N-Chromosomal Royal Jelly. RJMS 2022; 28(12): 28-42. [http://magiran.com/p2429585]
31- Hassanpour G, Nik Bakht HA, Azarbayjani MA, Shakeri N, Abednazari H. The Effect of Interval and Continued Trainings with Crocin on Apoptotic Markers in the Heart Tissue of High-Fat Diet and Streptozotocin Induced Type 2 Diabetic Rats. Rep Health Care 2017; 3(3): 58-70.
32- Askari B, Bijeh N, Rashid Lamir A. Effects of 8 Weeks of Resistance Training and IGF-1 Injection on Biochemical Markers of Cancer and Colorectal Structures in Rats. Mljgoums 2017; 11(6): 23-9.
33- Seyedgomi F, Bashiri J, Gholami F. Effect of High Intensity Endurance Training on P53 and Cytochrome-C Gene Expression in Male Rat Soleus Muscle. Armaghane Danesh 2017; 22(5): 608-22. [Persian]
34- Sahraei M, Abdi A, Jalal H. Protective Effect of Berberine Chloride and Aerobic Training on Liver Nrf2/Ho-1 Pathway and Pparγ in Streptozotocin-Induced Diabetic Rats. J Ardabil Univ Med Sci 2020; 20(3): 296-306. [Persian]
35- Salarian A, Kadkhodaee M, Zahmatkesh M, Seifi B, Bakhshi E, Akhondzadeh S, et al. Opioid Use Disorder Induces Oxidative Stress and Inflammation: The Attenuating Effect of Methadone Maintenance Treatment. Iran J Psychiatry 2018; 13(1): 46-54.
36- Maybaum S, Ilan M, Mogilevsky J, Tzivoni D. Improvement in Ischemic Parameters during Repeated Exercise Testing: A Possible Model for Myocardial Preconditioning. Am J Cardiol 1996; 78(10): 1087-91.
37- Khorram H, Ravasi A, Hedayati M, Samadi A, Gaeini A. Effect of Eight Weeks of Resistance Training on Oxidative Stress in Diabetic Rats. Journal of Sabzevar Uni of Med Sci 2013; 20(3): 389-99. [Persian]
38- Kanter M, Aksu F, Takir M, Kostek O, Kanter B, Oymagil A, et al. Effects of Low Intensityexercise against Apoptosis and Oxidative Stressstreptozotocin-Induced Diabetic Rat Heart. Exp Clin Endocrinol Diabetes 2017; 125(9): 583-91.
39- Abbasi E, Salehi I, Zarin Kalam E, Ranjbar K. Mirzaei F, Komaki A, et al. Protective Effect of Exercise on Liver Oxidative Stress, Inflammation and Histopathological Changes after Morphine Withdrawal in Rats. J Mazandaran Univ Med Sci 2022; 32(207): 26-37. [Persian]
40- Salehi I, Zarrinkalam E, Mirzaei F, Abasi Oshaghi E, Ranjbar K, Soleimani Asl S. Effects of Resistance, Endurance, and Concurrent Exercise on Oxidative Stress Markers and the Histological Changes of Intestine after Morphine Withdrawal in Rats. Avicenna J Med Biochem 2018; 6(2): 44-9.
41- Dashtiyan AA, Afzalpour ME, Tanideh N, Sepehrimanesh M. The Comparison of the Effect of Vitamin E on the Expression of P53/Pten of Prostate Gland of Male Rats in Two Groups of Intensive Continuous and Intermittent Exercise Training. JABS 2017; 7(3): 406-15. [Persian]
42- Nadi Z, Abbasi Y, Jalali Mashayekhi F, Bayat M, Bayat P, Baazm M. Correction to: Effect of Resistance and Endurance Trainings on Nrf2/Keap1 Signaling Pathway in Testicular Tissue of Type 2 Diabetic Rats. J Mazandaran Univ Med Sci 2022, 32(214): 24-34. [Persian]
43- Yun J, Lee Y, Yun K, Oh S. Bergenin Decreases the Morphine-Induced Physical Ddependence via Antioxidative Activity in Mice. Arch Pharm Res 2015; 38(6): 1248-54.
44- Huang X, Feng Y, Deji C, Yan X, Bai Y, Wei Sh. The Nuclear Factor E2-Related Factor 2 Participates in Morphine-Induced Autophagy. Research Square Posted 2022; 1-16.
45- Wang Y, Yang C, Elsheikh NAH, Li C, Yang F, Wang G, et al. HO-1 Reduces Heat Stress-Induced Apoptosis in Bovine Granulosa Cells by Suppressing Oxidative Stress. Aging (Albany NY) 2019; 11(15): 5535-47.
46- Feng Y, Cui R, Li Z, Zhang X, Jia Y, Zhang X, et al. Methane Alleviates Acetaminophen-Induced Liver Injury by Inhibiting Inflammation, Oxidative Stress, Endoplasmic Reticulum Stress, and Apoptosis through the Nrf2/HO-1/NQO1 Signaling Pathway. Oxid Med Cell Longev 2019; 2019: 7067619.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1402/2/27 | پذیرش: 1402/7/9 | انتشار: 1402/10/15
دریافت: 1402/2/27 | پذیرش: 1402/7/9 | انتشار: 1402/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







