دوره 30، شماره 6 - ( شهریور 1401 )
جلد 30 شماره 6 صفحات 4958-4949 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Jalali F, Kamiab Z, Pourghazi S, Bazmandegan G. Study of Growth Process of Infants in Healthy and Gestational Diabetes Mothers in Rafsanjan City in 2017. JSSU 2022; 30 (6) :4949-4958
URL: http://jssu.ssu.ac.ir/article-1-5612-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5612-fa.html
جلالی فاطمه، کامیاب زهرا، پورقاضی شایان، بازماندگان غلامرضا. بررسی روند رشد شیرخواران در مادران سالم و مبتلا به دیابت بارداری شهرستان رفسنجان در سال 1396. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (6) :4949-4958
متن کامل [PDF 721 kb]
(244 دریافت)
| چکیده (HTML) (483 مشاهده)
متن کامل: (409 مشاهده)
مقدمه
دیابت بارداری (Gestational Diabetes Mellitus;GDM) عدم تحمل گلوکز با شدتهای مختلف میباشد که برای اولین بار در طی بارداری شروع و یا تشخیص داده میشود (1) این بیماری شایعترین اختلال متابولیک دوران بارداری است که با افزایش قندخون ناشی از نقص در ترشح یا فعالیت انسولین یا هردو مشخص می شود. شیوع GDM 20-1 درصد و در ایران 1/3 تا 8/9 درصد گزارش شده است (2،3). بر اساس معیارهای موسسه بینالمللی گروههای مطالعاتی دیابت و حاملگی (The International Association of the Diabetes and Pregnancy Study Groups)، بروز این اختلال در یک مطالعه تا 29/9 درصد گزارش شده است (4). طی سالهای اخیر شیوع GDM روند افزایشی داشته است و براساس تخمین سازمان بهداشت جهانی شیوع دیابت بارداری در سال 2035 نسبت به شیوع آن در سال 2000 میلادی 1/5 برابر خواهد شد (5). تفاوت میزان شیوع GDM در مطالعات به عواملی همچون نژاد، معیارها و آزمونهای مورد استفاده برای غربالگری و تشخیص مرتبط است (2). در مناطقی که شیوع بالاتر بیماری وجود دارد، بیماری دیابت نوع دو نیز بیشتر است و شانس ابتلا به دیابت آشکار در زنان مبتلا به GDM افزایش مییابد (6). همچنین در بارداریهای بعدی زنان مبتلا به GDM شانس برگشت بیماری 69-30 درصد گزارش شده است (7). افزایش مقاومت بافتی مادران نسبت به انسولین در طی مدت بارداری باعث نیاز بیشتر به انسولین میشود که در صورت عدم تعادل بین مقاومت بافتی به انسولین و تولید آن، سطح گلوکز خون به خصوص در سه ماهه آخر بارداری افزایش یافته و هیپرگلیسمی و علائم GDM در زن نمایان میشود. اگرچه مقاومت نسبت به انسولین تا هنگام زایمان نیز روند افزایشی دارد اما بعد از زایمان، در بیشتر زنان این مقاومت از بین میرود (8،9). از آنجایی که گلوکز از طریق جفت به جنین قابل انتقال است، تغییرات قند خون مادر از جمله هیپرگلیسمی، هیپوگلیسمی و حساسیت مادر به انسولین، اثرات غیرقابل جبرانی برای مادر و جنین دارد. جنین در مادری که مبتلا به GDM است، در محیطی کاملاً متفاوت از یک جنین مادر سالم قرار میگیرد. گلوکز، آلانین و اسیدهای چرب آزاد زیادی از گردش خون مادر به جنین منتقل میشوند و در نتیجه غلظت انسولین مایع آمینوتیک افزایش مییابد که نشانگر پاسخ جبرانی جنین برای افزایش این مواد است. هیپرگلیسمی واضح در سه ماهه اول بارداری باعث افزایش خطر ناهنجاری مادرزادی و مرگ و میر حول و حوش زایمان میگردد (12-10). مطالعات نشان داده که دیابت بارداری میتواند با پیامدهای مختلف تولد، از جمله هیپرگلیسمی، هیپوگلیسمی، هیپربیلیروبینمی، سندروم دیسترس تنفسی، پرهاکلامپسی، ماکروزومی جنین، دیستوشی شانه و بهدنبال آن افزایش میزان زایمان با ابزار و سزارین، همچنین آسیبهای زایمانی همراه گردد. بهعلاوه دیابت بارداری با افزایش خطر پیامدهای نامطلوب طولانی مدت از جمله گسترش دیابت نوع دو در مادر همچنین افزایش چاقی، دیابت و بیماری قلبی عروقی در شیرخوار همراه گردد (13،14). اثرات نامطلوب GDM بر روند رشد نوزادان یکی از معضلات آتی مادران مبتلا میباشد. نتایج مطالعات حاکی از بالا بودن وزن هنگام تولد نوزادان (15)، رشد نامتوازن جنین، افزایش احتمال بستری و عوارضی مانند هیپوگلیسمی و اختلالات اسکلتی در نوزادان دارای مادر مبتلا به GDM میباشد (16,17). همچنین این نوزادان در سنین بالاتر در معرض خطر بیماری های مزمن و چاقی هستند (18). در مطالعه دیگری خاطر نشان شد که GDM خطر تولد نوزاد ماکروزوم و سایر شاخصهای آنتروپومتریک در نوزادان مادران دیابتی نسبت به مادران سالم را افزایش میدهد (19). تعیـین شـاخصهـای رشدی شیرخواران از متـداولترین و سادهترین روشهای ارزیابی رشد و سلامت نوزادان یک جامعه میباشد (20). الگوی رشد کودکان یکنواخت نبوده و هر کودک الگـوی رشد خاص خود را دارد. در شرایط مطلوب بایستی ملاک این اندازهگیریهای مربوط به رشد در زمان تولد برای هر جمعیت خاص که دارای شرایط محیطـی و وراثتـی متفـاوتی اسـت، بـهصورت مجزا تعیین گردد (20,21). از آنجاییکه بیماری GDM تاکنون درمان قطعی نداشته (22) و نوزادان بسیاری در نتیجه این معضل، با بیماری و مشکلات دیگر مواجه میشوند که میتواند الگوی رشد نوزادان و شیرخواران را تحتتاثیر قرار دهد، مطالعه حاضر با هدف بررسی و مقایسه روند رشد شیرخواران زیر 2 سال دارای مادران مبتلا به GDM و سالم در شهرستان رفسنجان اجرا گردید.
روش بررسی
مطالعه حاضر به صورت مقطعی بر روی شیرخواران زیر 2 سال ( بدو تولد تا 24 ماهگی) متولد شده از مادران سالم و مبتلا به دیابت بارداری، تحت پوشش مراکز بهداشتی درمانی شهرستان رفسنجان، در سال 1396 اجرا شد. حجم نمونه مطالعه شامل 104 شیرخوار متولد شده از مادران مبتلا به GDM و 104 شیرخوار متولد شده از مادران سالم به عنوان گروه کنترل (در مجموع 208 شیرخوار) بود. ملاک اطلاق GDM در مطالعه حاضر عدم تحمل گلوکز بود که برای اولین بار در طی بارداری شروع و یا تشخیص داده میشود (1). برای این منظور برای تمام زنانی که دیابت شناخته شده نداشته و برای ارزیابی در اولین ویزیت بارداری مراجعه نمودند، اندازهگیری گلوکز سرم ناشتا پس از حداقل 8 ساعت ناشتا بودن انجام شد. گلوکز ناشتای بیش از 126 میلیگرم در دسیلیتر، در اولین ویزیت و تایید به فاصله یک هفته بعد، به عنوان GDM در نظر گرفته شده است (23). اطلاعات با استفاده از پرونده مادران در مراکز بهداشتی درمانی شهر رفسنجان جمعآوری شد. چکلیست محقق ساخته حاوی دو قسمت اطلاعات مربوط به مادران شامل سن، محل زندگی، شغل، مصرف سیگار و نوع زایمان و همچنین اطلاعات مربوط به شیرخوار شامل جنسیت، نحوه تغذیه، مصرف قطره آهن، مصرف قطره ویتامین آ+د، اندازه دور سر، وزن و قد در مقاطع زمانی بدو تولد، 6 ماهگی، 12 ماهگی و 18 ماهگی بود. ملاک ورود به مطالعه شامل شیرخواران ترم (سن حاملگی ≥37 هفته)، وزن هنگام تولد بالای 2500 گرم و شیرخواران دارای برنامه پایش و مراقبتهای منظم دوره شیرخوارگی بود. معیارهای خروج شامل شیرخواران دچار ناهنجارهای مادرزادی، شیرخواران دارای اختلال رشد جنینی (Intrauterine growth restriction ;IUGR) و شیرخواران دارای مادران مبتلا به بیماریهای مزمن نظیر فشارخون، بیماریهای قلبی-عروقی و دیابت بود. اطلاعات مطالعه کاملاً محرمانه بوده و چکلیستها فاقد مشخصات هویتی مادران و شیرخواران بود.
تجزیه و تحلیل آماری
تجزیه و تحلیل اطلاعات جمعآوری شده با استفاده از نرمافزار آماری SPSS/16 و با استفاده از آزمونهای t مستقل، مجذور کای و آنالیز واریانس اندازههای تکراری (One-Way Repeated Measure) انجام گردید. سطح معنیداری در آزمونها 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه. علوم پزشکی رفسنجان. تایید شده است (کد اخلاق IR.RUMS.REC.1397.027).
نتایج
در مطالعه حاضر تعداد 208 شیرخوار در دو گروه شیرخواران متولد شده از مادران مبتلا به GDM و مادران سالم مورد مطالعه قرار گرفتند. میانگین سنی مادران مبتلا به GDM حدود دو سال بیشتر از مادران سالم بود (P=0.001). محل زندگی اغلب مادران شهر (P=0.554) و اغلب مادران خانه دار (P=0.124) بودند. فراوانی مصرف سیگار در مادران مبتلا به GDM 2/9 درصد و در مادران سالم 3/8 درصد بود (P=0.701). فراوانی زایمان سزارین در مادران مبتلا به GDM و سالم بالا بود بهطوری که مادران مبتلا به GDM در 73/1 درصد موارد و مادران سالم 57/7 درصد زایمان سزارین داشتند (P=0.020). شیرخواران پسر در هر دو گروه فراوانی بیشتری داشتند (P=0.781). میانگین وزن بدو تولد شیرخواران مادران مبتلا به GDM بهطور قابل توجهی بالاتر از مادران سالم بود (P<0.001) اما از نظر قد اختلاف معنی داری نداشتند (P=0.148). میانگین دور سر شیرخواران در دو گروه اختلاف معناداری داشت (P<0.001) و از نظر وضعیت نحوه تغذیه شیرخواران، مصرف قطره آهن و مصرف قطره AD دو گروه شیرخواران تقریباً مشابه بودند (P>0.05). در نمودار 1 روند تغییرات شاخصهای وزن، قد و دور سر شیرخواران در دو گروه در طی زمانهای بدو تولد، 6 ماه، 12 ماه و 18 ماه بعد از تولد نشان داده شده است. همانطور که مشاهده میشود روند افزایشی در شاخصهای شیرخواران مادران مبتلا به GDM و مادران سالم وجود دارد. نتایج تغییرات میانگین و مقایسه شاخصهای وزن، قد و دور سر در دو گروه زنان مبتلا به GDM و زنان سالم در طی زمانهای بدو تولد، 6 ماهگی، 12 ماهگی و 18 ماهگی بعد از تولد با استفاده از آزمون One-Way Repeated Measure در جدول 2 نمایش داده شده است. همانطور که ملاحظه میگردد روند معنیداری در میانگین تغییرات وزن، قد و دور سر در هر گروه در طول زمان های مختلف اندازه گیری وجود داشت (P<0.001). همچنین روند این تغییرات بین دو گروه نیز معنادار بود (P<0.001).
جدول 1: مقایسه ویژگیهای دموگرافیک و شاخصهای آنتروپومتریک مادران و شیرخواران متولد شده از مادران سالم و مبتلا به GDM
.JPG)
داده های جدول بهصورت "انحراف معیار±میانگین" و یا "تعداد (درصد)" گزارش شده است.
*آزمون t مستقل، 0/05> p اختلاف معنیدار+آزمون مجذور کای،0/05> p اختلاف معنیدار
جدول 2: تغییرات میانگین شاخصهای وزن، قد و دور سر شیرخواران در زمان، زمان/گروه و بین دو گروه زنان مبتلا به دیابت بارداری و زنان سالم
.JPG)
* Greenhouse-Geisser test** Sphericity Assumed test
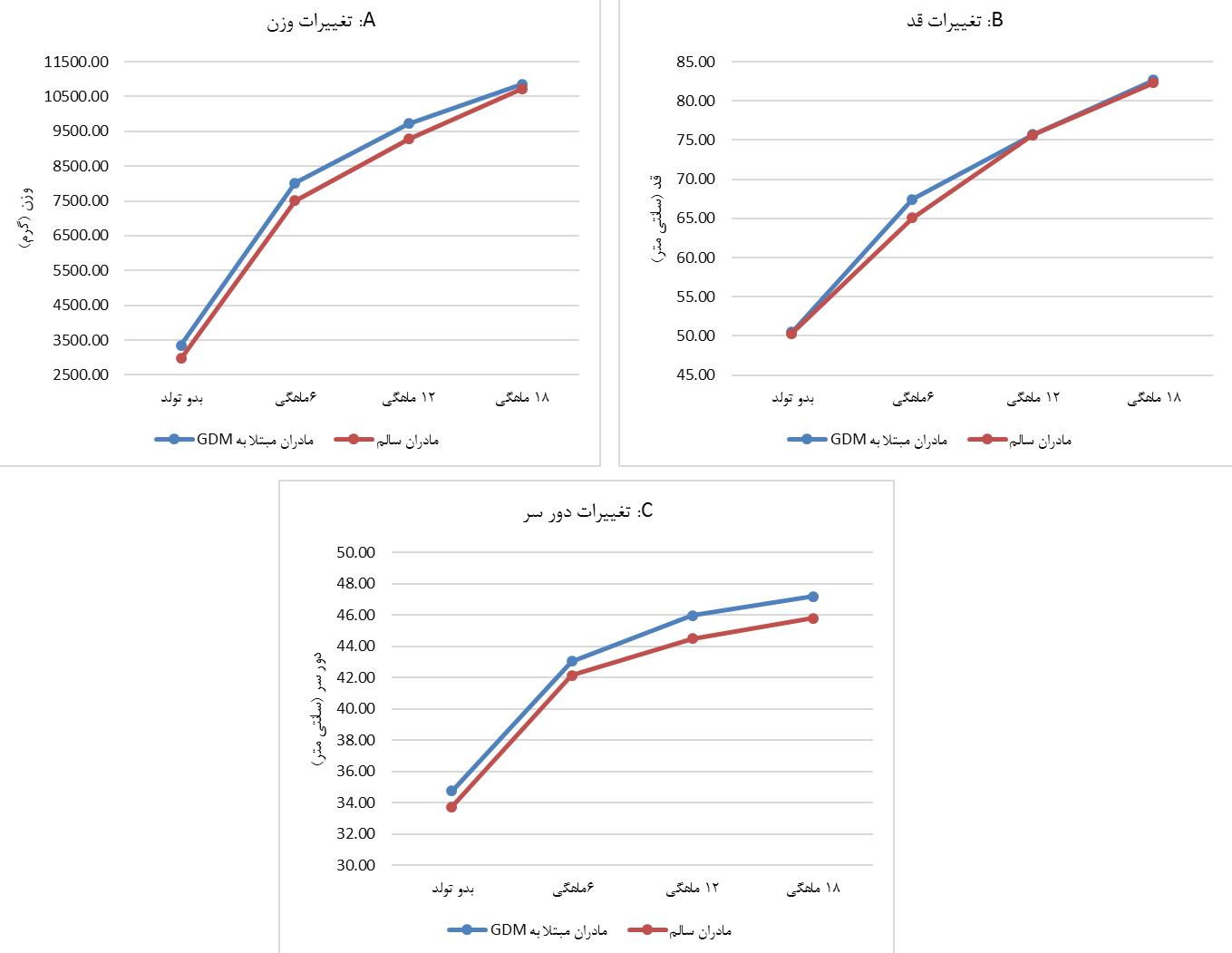
نمودار 1: روند تغییرات شاخصهای وزن، قد و دور سر در دو گروه شیرخواران مادران مبتلا به دیابت بارداری و مادران سالم
بحث
رشد شیرخواران پدیدهای است که متغیرهای زیـادی در تظــاهرات آن دخالــت دارنــد. اندازهگیریهای قد، وزن و دور سر از جمله شاخصهای آنتروپومتریک هستند که برای ارزیابی رشد جسمی و وضعت تغذیهای کودک بهکار می روند و از منابع مهم اطلاعاتی میباشند. هــر کــودک روند رشــد مخصوص به خود را دارد، با این حال رشد طبیعی کودکان دارای دامنه معینی است و رشد هرکـودک را بایـد در این حدود طبیعی بررسی نمود. بیماریهای مادر از جمله GDM یکی از عوامل تاثیرگذار بر رشد دوران جنینی و بعد از تولد نوزادان میباشد (24،25). نتایج مطالعه حاضر نشان داد میانگین وزن، قد و دور سر در شیرخواران مادران مبتلا به GDM، در زمانهای بدو تولد تا 18 ماهگی بیشتر از شیرخواران مادران سالم بود. اختلاف وزن در دو گروه شیرخواران از بدو تولد به وضوح مشاهده شد، در 6 ماهگی حداکثر اختلاف وجود داشت و در 18 ماهگی این اختلاف به حداقل مقدار خود رسید. بررسی روند قد شیرخواران در مادران مبتلا به GDM و سالم نشان داد اختلاف قدی شیرخواران در بدو تولد، 12 و 18 ماهگی در حداقل مقدار بوده و در 6 ماهگی اختلاف قدی نسبت به سایر زمانهای مشاهده شده بیشتر بود. نتایج مطالعه در بررسی روند دور سر شیرخواران در مادران مبتلا به GDM و سالم نشان داد اندازه دور سر شیرخواران در مادران مبتلا به GDM در تمامی زمانهای بررسی شده بیشتر از شیرخواران مادران سالم میباشد. این اختلاف در 12 ماهگی و 18 ماهگی دارای حداکثر مقدار بود. در همین راستا نتایج مطالعه Kesha و همکاران در بررسی پایش رشد کودکان مادران دیابتی نشان داد وزن هنگام تولد نوزادان مادران مبتلا به دیابت معمولا بیشتر از نوزادان عادی است (15). نتایج مطالعه McGrath و همکاران نشان داد علیرغم کاهش چشمگیر پیامدهای نامطلوب جدی برای زنان مبتلا به دیابت در بارداری، در این زنان رشد بیش از حد جنین و عوارض مرتبط با آن مانند هیپوگلیسمی نوزادان، دیستوسی شانه و بستری شدن در بخش مراقبتهای ویژه نوزادان افزایش مییابد. علاوه بر این، نوزادان LGA (Large for Gestational Age) در معرض خطر چاقی، دیابت و بیماریهای مزمن در سالهای بعدی زندگی هستند (16). نتایج مطالعه Touger و همکاران نشان داد نوزادان مادران مبتلا به دیابت در هنگام تولد وزن بیشتری نسبت به نوزادان زنان غیر مبتلا به دیابت داشتند و در 1/5 سالگی اگرچه انز نظر قدی کوتاهتر بودند اما وزن، وزن نسبی آنها، وزن متناسب با سن، جنس و قد مشابه در دو گروه نوزادان مشابه بود (17). همچنین خطر تولد نوزاد با وزن بالا در مادر مبتلا به GDM را 3-2 برابر گزارش شده است (18). نتایج مطالعه دیگری در هند نشان داد دیابت مادر در دوران بارداری با وزن بیشتر نوزادان همراه است و خطر ابتلا به دیابت و چاقی را در فرزندان افزایش می دهد (26). این رابطه حتی در بین خواهر و برادرهایی که قبل و بعد از شروع دیابت مادر متولد شده است نیز مشاهده شده است و میتواند حاکی از این نکته باشد که نقش محیط داخل رحمی در زنان دیابتی، علاوه بر انتقال حساسیت ژنتیکی بر روی جنین و نوزاد موثر است (27). در مطالعه Gillman و همکاران و Baptiste و همکاران نیز بین دیابت حاملگی و افزایش وزن به هنگام تولد و چاقی پس از آن ارتباط مستقیمی مشاهده شد (28،29). علیرغم نتایج مطالعاتی که همسو با نتایج مطالعه حاضر گزارش شد، در مطالعه متاآنالیزی که توسط Manerkar و همکاران انجام شد نتایج نشان داد در فاصله یک تا 6 ماه مقدار BMI (Body Mass Index) نوزادان مادران مبتلا به دیابت با فرزندان مادران سالم تفاوتی نداشت. همچنین کاهش روند افزایش قد و افزایش حجم چربی در 7 تا 12 ماهگی مشاهده شد. محققین خاطرنشان نمودند که همراهی بسیار کمی بین دیابت مادران با وزن و قد نوزادان پس از 12 ماه وجود دارد (30). فرزندان مادران مبتلا به دیابت الگوی رشد متفاوتی با همسالان خود در اوایل زندگی دارند، وزن هنگام تولد بالاتر داشته و پس از آن یک دوره رشد نسبتاً ضعیف همراه با کاهش رشد را تجربه میکنند (17). اگرچه مکانیسمهای اختصاصی که بهوسیله آنها هیپرگلیسمی باعث مختل شدن تکامل جنین و تاثیرات نامطلوب بر رشد نوزادان میشود بهطور کامل شناخته نشدهاند، اما در مطالعات علل مختلفی برای این موضوع ذکر شده است. وضعیت متابولیک مادر، عاملی مهمی در ماکروزومی جنین است. در بارداریهایی که با دیابت همراه شدهاند اگر قند خون مادر بهطور قابلتوجهی افزایش یابد، هیپرگلیسمی بهطور همزمان در جنین رخ میدهد که موجب تحریک و هیپرپلازی سلولهای پانکراس و در نهایت هیپرانسولینمی جبرانی شده که در ادامه باعث تشدید کاتابولیسم و در نتیجه افزایش مصرف انرژی، اکسیژن و حتی هیپوکسی جنین، اختلال در تشکیل عروق در بافتهای در حال تکامل جنین، اسیدوز متابولیک و افزایش مرگ و میر میشود (12،31،11). افزایش غلظت مواد غذایی مرکب در خون جنین موجب تحریک ترشح انسولین جنین میشود که محرک رشد بهویژه در بافتهای حساس به انسولین (مانند کبد، عضلات اسکلتی، عضلات قلب و چربی زیرجلدی) است، لذا این هیپرانسولینمی موجب ماکروزومی در نوزاد میشود. هیپرانسولینمی جنین همچنین باعث تحریک ذخیره گلیکوژن در کبد، افزایش فعالیت آنزیمهای دخیل در سنتز لیپید و تجمع چربی در بافتهای چربی میشود. این اثرات متابولیک ممکن است در وقوع عوارض متابولیک درازمدت در کودک دخیل باشند (11،25،32). علیرغم تاثیراتی که دیابت دوران بارداری مادر بر جنین و نوزاد میگذارد، محققین نقش عوامل دیگری از جمله ترکیبات شیر مادر را در اثرگذاری روی شاخصهای رشد نوزادان موثر میدانند. به طوریکه Yu و همکاران اظهار نمودند که ترکیبات شیر مادران دیابتی غنی از آدیپونکتین، هورمون رشد و انسولین است که متفاوت از ترکیبات شیر مادران غیر دیابتی است و این عامل ممکن است در ایجاد تغییرات شاخص های رشدی نوزادان مادران مبتلا به دیابت موثر باشد (33). مطالعه Plagemann و همکاران نیز اظهار نمودند احتمالاً تفاوت در مقدار پروتئین شیر مادران دیابتی باعث کوتاهتر شدن دوره شیرخواری و تأثیر بر BMI فرزندان این مادران میشود (34). اگرچه این فرضیه نیز همچنان مورد بحث میباشد و Kiraly و همکاران بر پایه مشاهدات خود اظهار نمودند که نوع تغذیه شیرخواران در پنج ماه اول پس از تولد در ارتباط با وزنگیری نوزاد نمیباشد (35) و لازم است این موضوع در مطالعات آتی به خوبی مورد بررسی قرار گیرد.
نتیجهگیری
بررسی روند شاخصهای رشدی شیرخواران متولد شده از مادران دیابتی و سالم حاکی از افزایش این شاخصها شامل میانگین وزن، قد و دور سر در شیرخواران مادران مبتلا به GDM بود. میزان اختلاف در بدو تولد در حداقل مقدار بود و در بیشتر موارد در 6 تا یکسالگی اختلاف بیشتری بین مقادیر شاخصها مشاهده شد.
سپاسگزاری
از واحد توسعه تحقیقات بالینی بیمارستان حضرت علی ابن ابیطالب ع رفسنجان به دلیل تصویب و حمایتهای لازم از اجرای این طرح تقدیر و تشکر میشود.
حامی مالی: دانشگاه علوم پزشکی رفسنجان
تعارض در منافع: وجود ندارد.
دیابت بارداری (Gestational Diabetes Mellitus;GDM) عدم تحمل گلوکز با شدتهای مختلف میباشد که برای اولین بار در طی بارداری شروع و یا تشخیص داده میشود (1) این بیماری شایعترین اختلال متابولیک دوران بارداری است که با افزایش قندخون ناشی از نقص در ترشح یا فعالیت انسولین یا هردو مشخص می شود. شیوع GDM 20-1 درصد و در ایران 1/3 تا 8/9 درصد گزارش شده است (2،3). بر اساس معیارهای موسسه بینالمللی گروههای مطالعاتی دیابت و حاملگی (The International Association of the Diabetes and Pregnancy Study Groups)، بروز این اختلال در یک مطالعه تا 29/9 درصد گزارش شده است (4). طی سالهای اخیر شیوع GDM روند افزایشی داشته است و براساس تخمین سازمان بهداشت جهانی شیوع دیابت بارداری در سال 2035 نسبت به شیوع آن در سال 2000 میلادی 1/5 برابر خواهد شد (5). تفاوت میزان شیوع GDM در مطالعات به عواملی همچون نژاد، معیارها و آزمونهای مورد استفاده برای غربالگری و تشخیص مرتبط است (2). در مناطقی که شیوع بالاتر بیماری وجود دارد، بیماری دیابت نوع دو نیز بیشتر است و شانس ابتلا به دیابت آشکار در زنان مبتلا به GDM افزایش مییابد (6). همچنین در بارداریهای بعدی زنان مبتلا به GDM شانس برگشت بیماری 69-30 درصد گزارش شده است (7). افزایش مقاومت بافتی مادران نسبت به انسولین در طی مدت بارداری باعث نیاز بیشتر به انسولین میشود که در صورت عدم تعادل بین مقاومت بافتی به انسولین و تولید آن، سطح گلوکز خون به خصوص در سه ماهه آخر بارداری افزایش یافته و هیپرگلیسمی و علائم GDM در زن نمایان میشود. اگرچه مقاومت نسبت به انسولین تا هنگام زایمان نیز روند افزایشی دارد اما بعد از زایمان، در بیشتر زنان این مقاومت از بین میرود (8،9). از آنجایی که گلوکز از طریق جفت به جنین قابل انتقال است، تغییرات قند خون مادر از جمله هیپرگلیسمی، هیپوگلیسمی و حساسیت مادر به انسولین، اثرات غیرقابل جبرانی برای مادر و جنین دارد. جنین در مادری که مبتلا به GDM است، در محیطی کاملاً متفاوت از یک جنین مادر سالم قرار میگیرد. گلوکز، آلانین و اسیدهای چرب آزاد زیادی از گردش خون مادر به جنین منتقل میشوند و در نتیجه غلظت انسولین مایع آمینوتیک افزایش مییابد که نشانگر پاسخ جبرانی جنین برای افزایش این مواد است. هیپرگلیسمی واضح در سه ماهه اول بارداری باعث افزایش خطر ناهنجاری مادرزادی و مرگ و میر حول و حوش زایمان میگردد (12-10). مطالعات نشان داده که دیابت بارداری میتواند با پیامدهای مختلف تولد، از جمله هیپرگلیسمی، هیپوگلیسمی، هیپربیلیروبینمی، سندروم دیسترس تنفسی، پرهاکلامپسی، ماکروزومی جنین، دیستوشی شانه و بهدنبال آن افزایش میزان زایمان با ابزار و سزارین، همچنین آسیبهای زایمانی همراه گردد. بهعلاوه دیابت بارداری با افزایش خطر پیامدهای نامطلوب طولانی مدت از جمله گسترش دیابت نوع دو در مادر همچنین افزایش چاقی، دیابت و بیماری قلبی عروقی در شیرخوار همراه گردد (13،14). اثرات نامطلوب GDM بر روند رشد نوزادان یکی از معضلات آتی مادران مبتلا میباشد. نتایج مطالعات حاکی از بالا بودن وزن هنگام تولد نوزادان (15)، رشد نامتوازن جنین، افزایش احتمال بستری و عوارضی مانند هیپوگلیسمی و اختلالات اسکلتی در نوزادان دارای مادر مبتلا به GDM میباشد (16,17). همچنین این نوزادان در سنین بالاتر در معرض خطر بیماری های مزمن و چاقی هستند (18). در مطالعه دیگری خاطر نشان شد که GDM خطر تولد نوزاد ماکروزوم و سایر شاخصهای آنتروپومتریک در نوزادان مادران دیابتی نسبت به مادران سالم را افزایش میدهد (19). تعیـین شـاخصهـای رشدی شیرخواران از متـداولترین و سادهترین روشهای ارزیابی رشد و سلامت نوزادان یک جامعه میباشد (20). الگوی رشد کودکان یکنواخت نبوده و هر کودک الگـوی رشد خاص خود را دارد. در شرایط مطلوب بایستی ملاک این اندازهگیریهای مربوط به رشد در زمان تولد برای هر جمعیت خاص که دارای شرایط محیطـی و وراثتـی متفـاوتی اسـت، بـهصورت مجزا تعیین گردد (20,21). از آنجاییکه بیماری GDM تاکنون درمان قطعی نداشته (22) و نوزادان بسیاری در نتیجه این معضل، با بیماری و مشکلات دیگر مواجه میشوند که میتواند الگوی رشد نوزادان و شیرخواران را تحتتاثیر قرار دهد، مطالعه حاضر با هدف بررسی و مقایسه روند رشد شیرخواران زیر 2 سال دارای مادران مبتلا به GDM و سالم در شهرستان رفسنجان اجرا گردید.
روش بررسی
مطالعه حاضر به صورت مقطعی بر روی شیرخواران زیر 2 سال ( بدو تولد تا 24 ماهگی) متولد شده از مادران سالم و مبتلا به دیابت بارداری، تحت پوشش مراکز بهداشتی درمانی شهرستان رفسنجان، در سال 1396 اجرا شد. حجم نمونه مطالعه شامل 104 شیرخوار متولد شده از مادران مبتلا به GDM و 104 شیرخوار متولد شده از مادران سالم به عنوان گروه کنترل (در مجموع 208 شیرخوار) بود. ملاک اطلاق GDM در مطالعه حاضر عدم تحمل گلوکز بود که برای اولین بار در طی بارداری شروع و یا تشخیص داده میشود (1). برای این منظور برای تمام زنانی که دیابت شناخته شده نداشته و برای ارزیابی در اولین ویزیت بارداری مراجعه نمودند، اندازهگیری گلوکز سرم ناشتا پس از حداقل 8 ساعت ناشتا بودن انجام شد. گلوکز ناشتای بیش از 126 میلیگرم در دسیلیتر، در اولین ویزیت و تایید به فاصله یک هفته بعد، به عنوان GDM در نظر گرفته شده است (23). اطلاعات با استفاده از پرونده مادران در مراکز بهداشتی درمانی شهر رفسنجان جمعآوری شد. چکلیست محقق ساخته حاوی دو قسمت اطلاعات مربوط به مادران شامل سن، محل زندگی، شغل، مصرف سیگار و نوع زایمان و همچنین اطلاعات مربوط به شیرخوار شامل جنسیت، نحوه تغذیه، مصرف قطره آهن، مصرف قطره ویتامین آ+د، اندازه دور سر، وزن و قد در مقاطع زمانی بدو تولد، 6 ماهگی، 12 ماهگی و 18 ماهگی بود. ملاک ورود به مطالعه شامل شیرخواران ترم (سن حاملگی ≥37 هفته)، وزن هنگام تولد بالای 2500 گرم و شیرخواران دارای برنامه پایش و مراقبتهای منظم دوره شیرخوارگی بود. معیارهای خروج شامل شیرخواران دچار ناهنجارهای مادرزادی، شیرخواران دارای اختلال رشد جنینی (Intrauterine growth restriction ;IUGR) و شیرخواران دارای مادران مبتلا به بیماریهای مزمن نظیر فشارخون، بیماریهای قلبی-عروقی و دیابت بود. اطلاعات مطالعه کاملاً محرمانه بوده و چکلیستها فاقد مشخصات هویتی مادران و شیرخواران بود.
تجزیه و تحلیل آماری
تجزیه و تحلیل اطلاعات جمعآوری شده با استفاده از نرمافزار آماری SPSS/16 و با استفاده از آزمونهای t مستقل، مجذور کای و آنالیز واریانس اندازههای تکراری (One-Way Repeated Measure) انجام گردید. سطح معنیداری در آزمونها 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه. علوم پزشکی رفسنجان. تایید شده است (کد اخلاق IR.RUMS.REC.1397.027).
نتایج
در مطالعه حاضر تعداد 208 شیرخوار در دو گروه شیرخواران متولد شده از مادران مبتلا به GDM و مادران سالم مورد مطالعه قرار گرفتند. میانگین سنی مادران مبتلا به GDM حدود دو سال بیشتر از مادران سالم بود (P=0.001). محل زندگی اغلب مادران شهر (P=0.554) و اغلب مادران خانه دار (P=0.124) بودند. فراوانی مصرف سیگار در مادران مبتلا به GDM 2/9 درصد و در مادران سالم 3/8 درصد بود (P=0.701). فراوانی زایمان سزارین در مادران مبتلا به GDM و سالم بالا بود بهطوری که مادران مبتلا به GDM در 73/1 درصد موارد و مادران سالم 57/7 درصد زایمان سزارین داشتند (P=0.020). شیرخواران پسر در هر دو گروه فراوانی بیشتری داشتند (P=0.781). میانگین وزن بدو تولد شیرخواران مادران مبتلا به GDM بهطور قابل توجهی بالاتر از مادران سالم بود (P<0.001) اما از نظر قد اختلاف معنی داری نداشتند (P=0.148). میانگین دور سر شیرخواران در دو گروه اختلاف معناداری داشت (P<0.001) و از نظر وضعیت نحوه تغذیه شیرخواران، مصرف قطره آهن و مصرف قطره AD دو گروه شیرخواران تقریباً مشابه بودند (P>0.05). در نمودار 1 روند تغییرات شاخصهای وزن، قد و دور سر شیرخواران در دو گروه در طی زمانهای بدو تولد، 6 ماه، 12 ماه و 18 ماه بعد از تولد نشان داده شده است. همانطور که مشاهده میشود روند افزایشی در شاخصهای شیرخواران مادران مبتلا به GDM و مادران سالم وجود دارد. نتایج تغییرات میانگین و مقایسه شاخصهای وزن، قد و دور سر در دو گروه زنان مبتلا به GDM و زنان سالم در طی زمانهای بدو تولد، 6 ماهگی، 12 ماهگی و 18 ماهگی بعد از تولد با استفاده از آزمون One-Way Repeated Measure در جدول 2 نمایش داده شده است. همانطور که ملاحظه میگردد روند معنیداری در میانگین تغییرات وزن، قد و دور سر در هر گروه در طول زمان های مختلف اندازه گیری وجود داشت (P<0.001). همچنین روند این تغییرات بین دو گروه نیز معنادار بود (P<0.001).
جدول 1: مقایسه ویژگیهای دموگرافیک و شاخصهای آنتروپومتریک مادران و شیرخواران متولد شده از مادران سالم و مبتلا به GDM
.JPG)
داده های جدول بهصورت "انحراف معیار±میانگین" و یا "تعداد (درصد)" گزارش شده است.
*آزمون t مستقل، 0/05> p اختلاف معنیدار+آزمون مجذور کای،0/05> p اختلاف معنیدار
جدول 2: تغییرات میانگین شاخصهای وزن، قد و دور سر شیرخواران در زمان، زمان/گروه و بین دو گروه زنان مبتلا به دیابت بارداری و زنان سالم
.JPG)
* Greenhouse-Geisser test** Sphericity Assumed test

نمودار 1: روند تغییرات شاخصهای وزن، قد و دور سر در دو گروه شیرخواران مادران مبتلا به دیابت بارداری و مادران سالم
بحث
رشد شیرخواران پدیدهای است که متغیرهای زیـادی در تظــاهرات آن دخالــت دارنــد. اندازهگیریهای قد، وزن و دور سر از جمله شاخصهای آنتروپومتریک هستند که برای ارزیابی رشد جسمی و وضعت تغذیهای کودک بهکار می روند و از منابع مهم اطلاعاتی میباشند. هــر کــودک روند رشــد مخصوص به خود را دارد، با این حال رشد طبیعی کودکان دارای دامنه معینی است و رشد هرکـودک را بایـد در این حدود طبیعی بررسی نمود. بیماریهای مادر از جمله GDM یکی از عوامل تاثیرگذار بر رشد دوران جنینی و بعد از تولد نوزادان میباشد (24،25). نتایج مطالعه حاضر نشان داد میانگین وزن، قد و دور سر در شیرخواران مادران مبتلا به GDM، در زمانهای بدو تولد تا 18 ماهگی بیشتر از شیرخواران مادران سالم بود. اختلاف وزن در دو گروه شیرخواران از بدو تولد به وضوح مشاهده شد، در 6 ماهگی حداکثر اختلاف وجود داشت و در 18 ماهگی این اختلاف به حداقل مقدار خود رسید. بررسی روند قد شیرخواران در مادران مبتلا به GDM و سالم نشان داد اختلاف قدی شیرخواران در بدو تولد، 12 و 18 ماهگی در حداقل مقدار بوده و در 6 ماهگی اختلاف قدی نسبت به سایر زمانهای مشاهده شده بیشتر بود. نتایج مطالعه در بررسی روند دور سر شیرخواران در مادران مبتلا به GDM و سالم نشان داد اندازه دور سر شیرخواران در مادران مبتلا به GDM در تمامی زمانهای بررسی شده بیشتر از شیرخواران مادران سالم میباشد. این اختلاف در 12 ماهگی و 18 ماهگی دارای حداکثر مقدار بود. در همین راستا نتایج مطالعه Kesha و همکاران در بررسی پایش رشد کودکان مادران دیابتی نشان داد وزن هنگام تولد نوزادان مادران مبتلا به دیابت معمولا بیشتر از نوزادان عادی است (15). نتایج مطالعه McGrath و همکاران نشان داد علیرغم کاهش چشمگیر پیامدهای نامطلوب جدی برای زنان مبتلا به دیابت در بارداری، در این زنان رشد بیش از حد جنین و عوارض مرتبط با آن مانند هیپوگلیسمی نوزادان، دیستوسی شانه و بستری شدن در بخش مراقبتهای ویژه نوزادان افزایش مییابد. علاوه بر این، نوزادان LGA (Large for Gestational Age) در معرض خطر چاقی، دیابت و بیماریهای مزمن در سالهای بعدی زندگی هستند (16). نتایج مطالعه Touger و همکاران نشان داد نوزادان مادران مبتلا به دیابت در هنگام تولد وزن بیشتری نسبت به نوزادان زنان غیر مبتلا به دیابت داشتند و در 1/5 سالگی اگرچه انز نظر قدی کوتاهتر بودند اما وزن، وزن نسبی آنها، وزن متناسب با سن، جنس و قد مشابه در دو گروه نوزادان مشابه بود (17). همچنین خطر تولد نوزاد با وزن بالا در مادر مبتلا به GDM را 3-2 برابر گزارش شده است (18). نتایج مطالعه دیگری در هند نشان داد دیابت مادر در دوران بارداری با وزن بیشتر نوزادان همراه است و خطر ابتلا به دیابت و چاقی را در فرزندان افزایش می دهد (26). این رابطه حتی در بین خواهر و برادرهایی که قبل و بعد از شروع دیابت مادر متولد شده است نیز مشاهده شده است و میتواند حاکی از این نکته باشد که نقش محیط داخل رحمی در زنان دیابتی، علاوه بر انتقال حساسیت ژنتیکی بر روی جنین و نوزاد موثر است (27). در مطالعه Gillman و همکاران و Baptiste و همکاران نیز بین دیابت حاملگی و افزایش وزن به هنگام تولد و چاقی پس از آن ارتباط مستقیمی مشاهده شد (28،29). علیرغم نتایج مطالعاتی که همسو با نتایج مطالعه حاضر گزارش شد، در مطالعه متاآنالیزی که توسط Manerkar و همکاران انجام شد نتایج نشان داد در فاصله یک تا 6 ماه مقدار BMI (Body Mass Index) نوزادان مادران مبتلا به دیابت با فرزندان مادران سالم تفاوتی نداشت. همچنین کاهش روند افزایش قد و افزایش حجم چربی در 7 تا 12 ماهگی مشاهده شد. محققین خاطرنشان نمودند که همراهی بسیار کمی بین دیابت مادران با وزن و قد نوزادان پس از 12 ماه وجود دارد (30). فرزندان مادران مبتلا به دیابت الگوی رشد متفاوتی با همسالان خود در اوایل زندگی دارند، وزن هنگام تولد بالاتر داشته و پس از آن یک دوره رشد نسبتاً ضعیف همراه با کاهش رشد را تجربه میکنند (17). اگرچه مکانیسمهای اختصاصی که بهوسیله آنها هیپرگلیسمی باعث مختل شدن تکامل جنین و تاثیرات نامطلوب بر رشد نوزادان میشود بهطور کامل شناخته نشدهاند، اما در مطالعات علل مختلفی برای این موضوع ذکر شده است. وضعیت متابولیک مادر، عاملی مهمی در ماکروزومی جنین است. در بارداریهایی که با دیابت همراه شدهاند اگر قند خون مادر بهطور قابلتوجهی افزایش یابد، هیپرگلیسمی بهطور همزمان در جنین رخ میدهد که موجب تحریک و هیپرپلازی سلولهای پانکراس و در نهایت هیپرانسولینمی جبرانی شده که در ادامه باعث تشدید کاتابولیسم و در نتیجه افزایش مصرف انرژی، اکسیژن و حتی هیپوکسی جنین، اختلال در تشکیل عروق در بافتهای در حال تکامل جنین، اسیدوز متابولیک و افزایش مرگ و میر میشود (12،31،11). افزایش غلظت مواد غذایی مرکب در خون جنین موجب تحریک ترشح انسولین جنین میشود که محرک رشد بهویژه در بافتهای حساس به انسولین (مانند کبد، عضلات اسکلتی، عضلات قلب و چربی زیرجلدی) است، لذا این هیپرانسولینمی موجب ماکروزومی در نوزاد میشود. هیپرانسولینمی جنین همچنین باعث تحریک ذخیره گلیکوژن در کبد، افزایش فعالیت آنزیمهای دخیل در سنتز لیپید و تجمع چربی در بافتهای چربی میشود. این اثرات متابولیک ممکن است در وقوع عوارض متابولیک درازمدت در کودک دخیل باشند (11،25،32). علیرغم تاثیراتی که دیابت دوران بارداری مادر بر جنین و نوزاد میگذارد، محققین نقش عوامل دیگری از جمله ترکیبات شیر مادر را در اثرگذاری روی شاخصهای رشد نوزادان موثر میدانند. به طوریکه Yu و همکاران اظهار نمودند که ترکیبات شیر مادران دیابتی غنی از آدیپونکتین، هورمون رشد و انسولین است که متفاوت از ترکیبات شیر مادران غیر دیابتی است و این عامل ممکن است در ایجاد تغییرات شاخص های رشدی نوزادان مادران مبتلا به دیابت موثر باشد (33). مطالعه Plagemann و همکاران نیز اظهار نمودند احتمالاً تفاوت در مقدار پروتئین شیر مادران دیابتی باعث کوتاهتر شدن دوره شیرخواری و تأثیر بر BMI فرزندان این مادران میشود (34). اگرچه این فرضیه نیز همچنان مورد بحث میباشد و Kiraly و همکاران بر پایه مشاهدات خود اظهار نمودند که نوع تغذیه شیرخواران در پنج ماه اول پس از تولد در ارتباط با وزنگیری نوزاد نمیباشد (35) و لازم است این موضوع در مطالعات آتی به خوبی مورد بررسی قرار گیرد.
نتیجهگیری
بررسی روند شاخصهای رشدی شیرخواران متولد شده از مادران دیابتی و سالم حاکی از افزایش این شاخصها شامل میانگین وزن، قد و دور سر در شیرخواران مادران مبتلا به GDM بود. میزان اختلاف در بدو تولد در حداقل مقدار بود و در بیشتر موارد در 6 تا یکسالگی اختلاف بیشتری بین مقادیر شاخصها مشاهده شد.
سپاسگزاری
از واحد توسعه تحقیقات بالینی بیمارستان حضرت علی ابن ابیطالب ع رفسنجان به دلیل تصویب و حمایتهای لازم از اجرای این طرح تقدیر و تشکر میشود.
حامی مالی: دانشگاه علوم پزشکی رفسنجان
تعارض در منافع: وجود ندارد.
References:
1- Mcintyre HD, Catalano P, Zhang C, Desoye G, Mathiesen ER, Damm P. Gestational Diabetes Mellitus. Nat Rev Dis Primers 2019; 47(5): 1-19.
2- Alfadhli EM. Gestational Diabetes Mellitus. Saudi Med J 2015; 36(4): 399-407.
3- Khoshniyyat Niko M, Abbass Zadeh Ahranjani S, Larijani B. A Study of the Prevalence of Gestational Diabetes in Different Parts of Iran. Iran J Diabetes Lipid Disorders 2008; 8(1): 1-10.[Persian]
4- Shahbazian H, Nouhjah S, Shahbazian N, Jahanfar S, Latifi SM, Aleali A, et al. Gestational Diabetes Mellitus in an Iranian Pregnant Population Using IADPSG Criteria: Incidence, Contributing Factors and Outcomes. Diabetes Metab Syndr 2016; 10(4): 242-6.
5- Akbarizadeh MR, Naderifar M, Goli H. Complications Affecting Newborns of Diabetic Mothers. J Diabetes Nurs 2019; 7(3): 887-99.
6- Zhu Y, Zhang C. Prevalence of Gestational Diabetes and Risk of Progression to Type 2 Diabetes: A Global Perspective. Curr Diab Rep 2016; 16(1): 7.
7- Jafari-Shobeiri M, Ghojazadeh M, Azami-Aghdash S, et al. Prevalence and Risk Factors of Gestational Diabetes in Iran: A Systematic Review and Meta-Analysis. Iran J Public Health 2015; 44(8): 1036-44.
8- Plows JF, Stanley JL, Baker PN, Reynolds CM, Vickers MH. The Pathophysiology of Gestational Diabetes Mellitus. Int J Mol Sci 2018; 19(11): 3342.
9- Al-Noaemi MC, Shalayel MHF. Pathophysiology of Gestational Diabetes Mellitus: The Past, the Present and the Future. In: Radenkovic M, editor. Gestational Diabetes [Internet]. Available at:https://www.intechopen.com/Chapters/23177 doi: 10.5772/24315. Accessed July 10, 2022.
10- Hod M, Kapur A, Mcintyre HD. FIGO Working Group on Hyperglycemia in Pregnancy; FIGO Pregnancy and Prevention of Early NCD Committee. Evidence in Support of the International Association Of Diabetes In Pregnancy Study Groups' Criteria For Diagnosing Gestational Diabetes Mellitus Worldwide In 2019. Am J Obstet Gynecol 2019; 221(2): 109-16.
11- Teramo KA, Klemetti MM, Widness JA. Robust Increases in Erythropoietin Production by the Hypoxic Fetus is a Response to Protect the Brain and Other Vital Organs. Pediatr Res 2018; 84(6): 807-12.
12- Wentzel P, Eriksson UJ. Embryopathy and Diabetes. Gestational Diabetes. 28: Karger Publishers; 2020; 28: 132-44.
13- Wang Z, Kanguru L, Hussein J, Fitzmaurice A, Ritchie K. Incidence of Adverse Outcomes Associated with Gestational Diabetes Mellitus in Low- and Middle-Income Countries. Int J Gynaecol Obstet 2013; 121(1): 14-9.
14- Mission JF, Ohno MS, Cheng YW, Caughey AB. Gestational Diabetes Screening with the New IADPSG Guidelines: A Cost-Effectiveness Analysis. Am J Obstet Gynecol 2012; 207(4): 326.E1-9.
15- Baptiste-Roberts K, Nicholson WK, Wang NY, Brancati FL. Gestational Diabetes and Subsequent Growth Patterns of Offspring: The National Collaborative Perinatal Project. Matern Child Health J 2012; 16(1): 125-32.
16- Mcgrath RT, Glastras SJ, Hocking SL, Fulcher GR. Large-For-Gestational-Age Neonates in Type 1 Diabetes and Pregnancy: Contribution of Factors beyond Hyperglycemia. Diabetes Care 2018; 41(8): 1821-28.
17- Touger L, Looker HC, Krakoff J, Lindsay RS, Cook V, Knowler WC. Early Growth in Offspring of Diabetic Mothers. Diabetes Care 2005; 28(3): 585-9.
18- Leirgul E, Brodwall K, Greve G, Vollset SE, Holmstrøm H, Tell GS, Øyen N. Maternal Diabetes, Birth Weight, and Neonatal Risk of Congenital Heart Defects in Norway, 1994-2009. Obstet Gynecol 2016; 128(5): 1116-25.
19- Najafian M, Cheraghi M. Occurrence of Fetal Macrosomia Rate and Its Maternal and Neonatal Complications: A 5-Year Cohort Study. ISRN Obstet Gynecol 2012; 2012: 353791.
20- Gardosi J, Francis A, Turner S, Williams M. Customized Growth Charts: Rationale, Validation and Clinical Benefits. Am J Obstet Gynecol 2018; 218(2S): S609-S618.
21- Harding JE, Cormack BE, Alexander T, Alsweiler JM, Bloomfield FH. Advances in Nutrition of the Newborn Infant. Lancet 2017; 389: 1660-8.
22- Chiefari E, Arcidiacono B, Foti D, Brunetti A. Gestational Diabetes Mellitus: An Updated Overview. J Endocrinol Invest 2017; 40(9) :899-909.
23- Rajabi Naeini M, Dadashi Z. New Guidelines for Gestational Diabetes. Behvarz 2015; 28(94): 48-50. [Persian]
24- Lotfi M H, Rahimi Pordanjani S, Mohammad Zadeh M, Moghtli M. The Evaluate Prevalence Growth Disorders of Weight, Height and Head Circumference First 5 Years of Life in Children with Congenital Hypothyroidism City of Yazd in 2014. RJMS 2016; 23(143): 34-46. [Persian]
25- Zamanfar D, Farhadi R, Shahbaznejad L. Neonate of Diabetic Mother, Pathogenesis and Complications. Clin Exc 2014; 2(2): 90-103. [Persian]
26- Pettitt DJ, Baird HR, Aleck KA, Bennett PH, Knowler WC. Excessive Obesity in Offspring of Pima Indian Women with Diabetes during Pregnancy. N Engl J Med 1983; 308(5): 242-5.
27- Dabelea D, Hanson RL, Lindsay RS, Pettitt DJ, Imperatore G, Gabir MM, et al. Study of Discordant Sibships. Diabetes 2000; 49(12): 2208-11.
28- Gillman MW, Rifas-Shiman S, Berkey CS, Field AE, Colditz GA. Maternal Gestational Diabetes, Birth Weight, and Adolescent Obesity. Pediatrics 2003; 111(3): E221-E6.
29- Baptiste-Roberts K, Nicholson WK, Wang NY, Brancati FL. Gestational Diabetes and Subsequent Growth Patterns of Offspring: The National Collaborative Perinatal Project. Matern Child Health J 2012; 16(1): 125-32.
30- Manerkar K, Harding J, Conlon C, Mckinlay C. Maternal Gestational Diabetes and Infant Feeding, Nutrition and Growth: A Systematic Review and Meta-Analysis. Brit J Nutr 2020; 123(11): 1201-15.
31- Cadaret CN, Merrick EM, Barnes TL, Beede KA, Posont RJ, Petersen JL, et al. Sustained Maternal Inflammation During the Early Third-Trimester Yields Intrauterine Growth Restriction, Impaired Skeletal Muscle Glucose Metabolism, and Diminished Β-Cell Function in Fetal Sheep. J Anim Sci 2019; 97(12): 4822-33.
32- Barthell JE, Georgieff MK. Infants of Diabetic Mothers. Neonatol Netw 2012; 32(6): 379-86.
33- Yu X, Rong SS, Sun X, Ding G, Wan W, Zou L, et al. Associations of Breast Milk Adiponectin, Leptin, Insulin and Ghrelin with Maternal Characteristics and Early Infant Growth: A Longitudinal Study. Br J Nutr 2018; 120(12): 1380-7.
34- Plagemann A, Harder T, Franke K, Kohlhoff R. Long-Term Impact of Neonatal Breast-Feeding on Body Weight and Glucose Tolerance in Children of Diabetic Mothers. Diabetes Care 2002; 25(1): 16-22.
35-Kiraly CM, Turk MT, Kalarchian MA, Shaffer C. Exploring Factors Linked to Weight Status in Salvadoran Infants. Hisp Health Care Int 2021; 19(2): 95-104.
2- Alfadhli EM. Gestational Diabetes Mellitus. Saudi Med J 2015; 36(4): 399-407.
3- Khoshniyyat Niko M, Abbass Zadeh Ahranjani S, Larijani B. A Study of the Prevalence of Gestational Diabetes in Different Parts of Iran. Iran J Diabetes Lipid Disorders 2008; 8(1): 1-10.[Persian]
4- Shahbazian H, Nouhjah S, Shahbazian N, Jahanfar S, Latifi SM, Aleali A, et al. Gestational Diabetes Mellitus in an Iranian Pregnant Population Using IADPSG Criteria: Incidence, Contributing Factors and Outcomes. Diabetes Metab Syndr 2016; 10(4): 242-6.
5- Akbarizadeh MR, Naderifar M, Goli H. Complications Affecting Newborns of Diabetic Mothers. J Diabetes Nurs 2019; 7(3): 887-99.
6- Zhu Y, Zhang C. Prevalence of Gestational Diabetes and Risk of Progression to Type 2 Diabetes: A Global Perspective. Curr Diab Rep 2016; 16(1): 7.
7- Jafari-Shobeiri M, Ghojazadeh M, Azami-Aghdash S, et al. Prevalence and Risk Factors of Gestational Diabetes in Iran: A Systematic Review and Meta-Analysis. Iran J Public Health 2015; 44(8): 1036-44.
8- Plows JF, Stanley JL, Baker PN, Reynolds CM, Vickers MH. The Pathophysiology of Gestational Diabetes Mellitus. Int J Mol Sci 2018; 19(11): 3342.
9- Al-Noaemi MC, Shalayel MHF. Pathophysiology of Gestational Diabetes Mellitus: The Past, the Present and the Future. In: Radenkovic M, editor. Gestational Diabetes [Internet]. Available at:https://www.intechopen.com/Chapters/23177 doi: 10.5772/24315. Accessed July 10, 2022.
10- Hod M, Kapur A, Mcintyre HD. FIGO Working Group on Hyperglycemia in Pregnancy; FIGO Pregnancy and Prevention of Early NCD Committee. Evidence in Support of the International Association Of Diabetes In Pregnancy Study Groups' Criteria For Diagnosing Gestational Diabetes Mellitus Worldwide In 2019. Am J Obstet Gynecol 2019; 221(2): 109-16.
11- Teramo KA, Klemetti MM, Widness JA. Robust Increases in Erythropoietin Production by the Hypoxic Fetus is a Response to Protect the Brain and Other Vital Organs. Pediatr Res 2018; 84(6): 807-12.
12- Wentzel P, Eriksson UJ. Embryopathy and Diabetes. Gestational Diabetes. 28: Karger Publishers; 2020; 28: 132-44.
13- Wang Z, Kanguru L, Hussein J, Fitzmaurice A, Ritchie K. Incidence of Adverse Outcomes Associated with Gestational Diabetes Mellitus in Low- and Middle-Income Countries. Int J Gynaecol Obstet 2013; 121(1): 14-9.
14- Mission JF, Ohno MS, Cheng YW, Caughey AB. Gestational Diabetes Screening with the New IADPSG Guidelines: A Cost-Effectiveness Analysis. Am J Obstet Gynecol 2012; 207(4): 326.E1-9.
15- Baptiste-Roberts K, Nicholson WK, Wang NY, Brancati FL. Gestational Diabetes and Subsequent Growth Patterns of Offspring: The National Collaborative Perinatal Project. Matern Child Health J 2012; 16(1): 125-32.
16- Mcgrath RT, Glastras SJ, Hocking SL, Fulcher GR. Large-For-Gestational-Age Neonates in Type 1 Diabetes and Pregnancy: Contribution of Factors beyond Hyperglycemia. Diabetes Care 2018; 41(8): 1821-28.
17- Touger L, Looker HC, Krakoff J, Lindsay RS, Cook V, Knowler WC. Early Growth in Offspring of Diabetic Mothers. Diabetes Care 2005; 28(3): 585-9.
18- Leirgul E, Brodwall K, Greve G, Vollset SE, Holmstrøm H, Tell GS, Øyen N. Maternal Diabetes, Birth Weight, and Neonatal Risk of Congenital Heart Defects in Norway, 1994-2009. Obstet Gynecol 2016; 128(5): 1116-25.
19- Najafian M, Cheraghi M. Occurrence of Fetal Macrosomia Rate and Its Maternal and Neonatal Complications: A 5-Year Cohort Study. ISRN Obstet Gynecol 2012; 2012: 353791.
20- Gardosi J, Francis A, Turner S, Williams M. Customized Growth Charts: Rationale, Validation and Clinical Benefits. Am J Obstet Gynecol 2018; 218(2S): S609-S618.
21- Harding JE, Cormack BE, Alexander T, Alsweiler JM, Bloomfield FH. Advances in Nutrition of the Newborn Infant. Lancet 2017; 389: 1660-8.
22- Chiefari E, Arcidiacono B, Foti D, Brunetti A. Gestational Diabetes Mellitus: An Updated Overview. J Endocrinol Invest 2017; 40(9) :899-909.
23- Rajabi Naeini M, Dadashi Z. New Guidelines for Gestational Diabetes. Behvarz 2015; 28(94): 48-50. [Persian]
24- Lotfi M H, Rahimi Pordanjani S, Mohammad Zadeh M, Moghtli M. The Evaluate Prevalence Growth Disorders of Weight, Height and Head Circumference First 5 Years of Life in Children with Congenital Hypothyroidism City of Yazd in 2014. RJMS 2016; 23(143): 34-46. [Persian]
25- Zamanfar D, Farhadi R, Shahbaznejad L. Neonate of Diabetic Mother, Pathogenesis and Complications. Clin Exc 2014; 2(2): 90-103. [Persian]
26- Pettitt DJ, Baird HR, Aleck KA, Bennett PH, Knowler WC. Excessive Obesity in Offspring of Pima Indian Women with Diabetes during Pregnancy. N Engl J Med 1983; 308(5): 242-5.
27- Dabelea D, Hanson RL, Lindsay RS, Pettitt DJ, Imperatore G, Gabir MM, et al. Study of Discordant Sibships. Diabetes 2000; 49(12): 2208-11.
28- Gillman MW, Rifas-Shiman S, Berkey CS, Field AE, Colditz GA. Maternal Gestational Diabetes, Birth Weight, and Adolescent Obesity. Pediatrics 2003; 111(3): E221-E6.
29- Baptiste-Roberts K, Nicholson WK, Wang NY, Brancati FL. Gestational Diabetes and Subsequent Growth Patterns of Offspring: The National Collaborative Perinatal Project. Matern Child Health J 2012; 16(1): 125-32.
30- Manerkar K, Harding J, Conlon C, Mckinlay C. Maternal Gestational Diabetes and Infant Feeding, Nutrition and Growth: A Systematic Review and Meta-Analysis. Brit J Nutr 2020; 123(11): 1201-15.
31- Cadaret CN, Merrick EM, Barnes TL, Beede KA, Posont RJ, Petersen JL, et al. Sustained Maternal Inflammation During the Early Third-Trimester Yields Intrauterine Growth Restriction, Impaired Skeletal Muscle Glucose Metabolism, and Diminished Β-Cell Function in Fetal Sheep. J Anim Sci 2019; 97(12): 4822-33.
32- Barthell JE, Georgieff MK. Infants of Diabetic Mothers. Neonatol Netw 2012; 32(6): 379-86.
33- Yu X, Rong SS, Sun X, Ding G, Wan W, Zou L, et al. Associations of Breast Milk Adiponectin, Leptin, Insulin and Ghrelin with Maternal Characteristics and Early Infant Growth: A Longitudinal Study. Br J Nutr 2018; 120(12): 1380-7.
34- Plagemann A, Harder T, Franke K, Kohlhoff R. Long-Term Impact of Neonatal Breast-Feeding on Body Weight and Glucose Tolerance in Children of Diabetic Mothers. Diabetes Care 2002; 25(1): 16-22.
35-Kiraly CM, Turk MT, Kalarchian MA, Shaffer C. Exploring Factors Linked to Weight Status in Salvadoran Infants. Hisp Health Care Int 2021; 19(2): 95-104.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







