دوره 30، شماره 4 - ( تیر 1401 )
جلد 30 شماره 4 صفحات 4777-4764 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Pourmahmoudian M J, Kalantar S M, Haghiralsadat B F. Design, Synthesis and Characterization of Nano niosomal Delivery system Containing paclitaxel drug for Drug Delivery to Osteosarcoma Cell Line (Saos-2). JSSU 2022; 30 (4) :4764-4777
URL: http://jssu.ssu.ac.ir/article-1-5479-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5479-fa.html
پورمحمودیان محمدجواد، کلانتر سید مهدی، حقیرالسادات بیبی فاطمه. طراحی، ساخت و مشخصهیابی نانو حاملهای نیوزومی حاوی داروی پاکلی تاکسل جهت دارورسانی به رده سلولی استئوسارکوما (Saos-2). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (4) :4764-4777
واژههای کلیدی: دارورسانی، استئوسارکوما، نیوزوم پگیله، پاکلی تاکسل، مقاومت دارویی چندگانه، Saos-2، HFF
متن کامل [PDF 1313 kb]
(313 دریافت)
| چکیده (HTML) (700 مشاهده)
متن کامل: (516 مشاهده)
مقدمه
تومورهای استخوان یکی از قدیمیترین نوع تومورها در پاتولوژی است و در تمام کشورها با تمام نژادها بروز میکند. در ایالت متحده امریکا، هرساله بیش از 800 نفر مبتلا به این تومورها تشخیص داده میشوند (1). استئوسارکوما شایعترین تومور سرطانی اولیه در استخوان است که بیشتر در کودکان و بالغین جوان شیوع دارد (2). علت دقیق ایجاد سرطان استخوان مشخص نیست، اما شواهد تحقیقاتی حاکی از آن است که جهش در DNA سلولهای استخوان و نیز سایر جهشهای قابل اکتساب پس از تولد در سلولهای مذکور، عامل اصلی این نوع از بدخیمی است (3). شیمیدرمانی از متداولترین استراتژیها در درمان سرطان است و تقریباً در تمام انواع سرطانها، جایگاه ویژهای دارد (4). جراحی تومور استخوان تأثیرات زیادی بر کودکان دارد و همواره نیازمند به شیمیدرمانی بهعنوان مکمل درمانی هست، با این وجود این روش بسیار دردناک، فرسایشی و همراه با فشارهای مالی و روحی برای بیمار و اطرافیان وی است. و همچنین روشهای درمانی مرسوم و فعلی برای استئوسارکوما، بهویژه انواعی که قابلیت متاستاز دارند، اغلب بهاندازه کافی مؤثر نیستند (5). علاوه براین، توسعه مقاومت چندگانه دارویی، یکی از موانع عمدهای است که در استراتژی شیمیدرمانی استئوسارکوما بهطور فزایندهای در حال مشاهده است و یک چالش قابلتوجه برای درمان موفقیتآمیز سرطان به شمار میرود (6). استفاده از نانوسامانهها جهت دارورسانی، راهحل جدیدی برای افزایش اثربخشی درمانی داروهای ضد سرطان به دلیل توانایی آنها در انتقال هدفمند و کنترلشده دارو به تومورها است و میتواند اثرات سیستمیک ناخواسته عوامل شیمیدرمانی را محدود کند و همچنین مقاومت دارویی را کاهش دهد (7). دراینبین، نیوزومها، بهعنوان یکی از جدیدترین نانو سامانهها جهت دارورسانی، بسیار مورد توجه قرار گرفتهاند. نیوزومها، وزیکولهایی هستند که از خود تجمعی سورفکتانتهای غیر یونی در محیط آب، توسط آرایش خودبهخودی از طریق میان کنشهای آبدوستیآبگریزی شکل میگیرند و ساختار دولایه محصوری را ایجاد میکنند، بهعبارتدیگر در محیط آبی، نواحی آبگریز آنها تمایل به تجمع دور یکدیگر، و نواحی آبدوست آنها، تمایل به تماس با فاز آبی را دارد (8,9). اهمیت چنین سیستمی در دارورسانی، قابلیت حمل داروهای آبدوست و آبگریز است بهصورت همزمان است، که سبب افزایش حلالیت داروهای آبگریز و کاهش معنیدار غلظت مؤثر داروها میشود (10). پاکلیتاکسل یکی از پراستفادهترین داروهای شیمیدرمانی هست که در درمان سرطان سینه، تخمدان، ریه و سارکوم کاپوسی استفاده میشود؛ همچنین در مطالعات اخیر با استفاده دوز پایین پاکلیتاکسل در بیمارهای غیر سرطانی مانند بیماریهای پوستی، کلیوی، فیبروز کبدی، التهاب، بازسازی آکسون و تنگی عروقکرونر مورداستفاده قرارگرفته است (11,12). پاکلیتاکسل یک داروی آنتی نئوپلاستیک از خانواده داروهای مؤثر بر اسکلت سلولی محسوب میشود که ساختار توبولین ها را در سلول هدف قرار میدهد؛ در ادامه، اثر این دارو با اختلال در آرایش دوکهای میتوزی و عدم جدا شدن صحیح کروموزومها از یکدیگر دنبال میشود که در نهایت تقسیم سلولی را از مسیر درست خود منحرف میسازد (13). در پژوهشی توسط wang در سال 2000 به بررسی اثر پاکلیتاکسل بر مرگ سلولهای سرطانی پرداختند. پاکلیتاکسل بااتصال به میکروتوبولها باعث توقف چرخه سلولی در فاز میتوزی شده که درنهایت منجر به آپوپتوز سلولی میشود (14). عالمی و همکارانش در سال 2018 به بررسی اثر داروی پاکلیتاکسل و کورکومین که در نانو حاملهای نیوزومی بارگذاری کرده بودند و بررسی اثر همافزایی این سامانه بر روی سلولهای سرطان سینه پرداختند. یافتههای آنها یک رویکرد موفقیتآمیز در درمان سرطان را نشان داد و حاکی از آن بود که این ترکیب دارویی اثر سایتوتوکسیتی قابلملاحظهای بر روی رده سلولی MCF7 داشته است (15). Bayindir ZS و همکارانش در سال 2015 به بررسی و مقایسه اثر فارماکوکینتیک داروی پاکلیتاکسل بهوسیله بارگذاری آن در یک حامل نیوزومی در رتها پرداختند. این محققان در تزریق وریدی سامانه دارویی مذکور در رتها، افزایش قابلملاحظه نیمهعمر داروی پاکلیتاکسل مشاهده نمودند (16). هدف از مطالعه حاضر، طراحی، ساخت و مشخصهیابی نانو حاملهای نیوزومی جهت انتقال داروی پاکلیتاکسل به رده سلولیSaos-2 بهعنوان مدلی از استئوسارکومای دارای مقاومت چندگانه دارویی است. در این راستا، نسبتهای مختلفی از کلسترول و سورفاکتانتهای مختلف جهت سنتز نانو سامانههای نیوزومی مورداستفاده قرار گرفت و میزان بارگیری داروی پاکلیتاکسل در نانو سامانههای نیوزومی و همچنین میزان رهایش این دارو ارزیابی و تعیین شد. درنهایت میزان سمیت سلولی نانو سامانه نیوزومی بهینه حاوی دارو پاکلیتاکسل در مقایسه با داروی پاکلیتاکسل بهتنهایی در رده سلولی Saos-2 بهعنوان مدلی از استوسارکوما و رده سلولی فیبروبلاستی نرمال (HFF) از طریق آزمون MTT تعیین شد.
روش بررسی
در مطالعه حاضر، سورفکتانتهای غیر یونی (Span40، Span60، Span80، Tween60 و Tween80)،DSPE-mPEG(2000) ، کلسترول، کیت MTT، پاکلیتاکسل و کیسه دیالیز (MWCO 12000 Da) از شرکت سیگما (Sigma Aldrich, USA)؛ کلروفورم، ایزوپروپانول، متانول از شرکت مرک (Merck, Germany)، محیط کشت DMEM high glucose از شرکت گیبکو (Gibco, USA)، سرم جنین گاوی (FBS)، بافر فسفات سالین (PBS)، آنتیبیوتیک پنیسیلین-استرپتومایسین (Pen-Strep, 10,000 U/mL -10 mg/mL) و تریپسین EDTA از شرکت زیستایده نوترکیب (ایران) تهیه و استفاده شد. همچنین رده سلولی Saso-2 از بانک سلولی انستیتو پاستور ایران و رده سلولی فیبروبلاست نرمال (HFF) از بانک سلول مرکز تحقیقات بیولوژی سلولهای بنیادی (یزد، ایران) تهیه گردید.
ترسیم نمودار کالیبراسیون پاکلیتاکسل
غلظتهای مختلف از داروی پاکلیتاکسل در ایزوپروپانول و بافر فسفات سالین (PBS) به روش سری استاندارد تهیه شد. سپس جذب نوری آنها در طولموج 227 نانومتر توسط دستگاه اسپکتروفتومتر (CECIL 7250, Bio Aquarius, UK) اندازهگیری گردید. در نهایت نمودار کالیبراسیون و معادله خط داروی پاکلیتاکسل با استفاده از نرمافزار Microsoft Excel 2013 به دست آمد.
سنتز نانو سامانه نیوزومی با داروی پاکلیتاکسل
از روش آبپوشانی لایهنازک جهت ساخت نانو سامانههای نیوزومی در این مطالعه استفاده شد (17). بهطور خلاصه، کلسترول و سورفکتانتهای غیر یونی مختلف در کلروفورم حل شد تا ترکیب کلسترول (25%)سروفکتانت (75%) حاصل شود (جدول 1). سپس داروی پاکلیتاکسل با نسبت دارو (1)-لیپید (10) به محلول قبلی اضافه شد. پس از همگن شدن محلول حاوی کلسترولسورفاکتانتدارو در روتاری (Heidolph, Germany) در دمای ℃ 40، حلال از طریق ایجاد خلأ حذف و لایهنازک تشکیل شد. جهت اطمینان از حذف کامل حلال، لایهنازک تشکیلشده به مدت ۲۴ ساعت در دمای ℃ 4 در یخچال قرار گرفت. سپس لایهنازک تشکیلشده با 10 میلیلیتر بافر فسفات (PBS, pH=7.4) در دمای ℃ 45 به مدت 60 دقیقه هیدراته شد تا سوسپانسیون نیوزومی حاوی پاکلیتاکسل بهدست آید. برای کاهش اندازه نیوزومهای چندلایه و تشکیل نیوزومهای کوچک تک لایه از اولتراسونیک پروبی (UP200Ht, Hielscher, Germany) با توان ۶۰ وات، به مدت ۳۰ دقیقه (15 ثانیه روشن و 10 ثانیه خاموش) استفاده شد. سپس بهمنظور جداسازی ذرات با اندازه بزرگتر از 200 نانومتر و همگن شدن محلول بهدستآمده، فیلتراسیون با استفاده از فیلتر سرسرنگی 0/2 میکرون انجام شد.
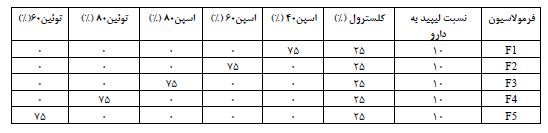
جدول 1: فرمولاسیونهای مختلف پاکلیتاکسل استفادهشده در مطاله حاضر.
حذف داروی آزاد و تعیین درصد بارگذاری دارو در وزیکولهای نیوزومی
جهت حذف داروی آزاد، سوسپانسیون همگن و فیلترشده، به درون کیسه دیالیز ریخته شد و کیسه دیالیز به مدت 6 ساعت درون محلول دیالیز (PBS) در دمای ℃ 4 قرار داده شد. هر یک ساعت، محلول دیالیز تعویض شد تا داروی آزاد بارگیری نشده بهخوبی حذف گردد. پس از حذف داروی آزاد، سوسپانسیون نیوزومی با نسبت 1 به 10 با ایزوپروپانول مخلوط و در دمای اتاق به مدت 1 ساعت انکوبه شد تا با تخریب ساختار نانو سامانه نیوزومی، داروی بارگذاری شده درون آن، آزاد شود. سپس جذب نوری آن را در طولموج 227 نانومتر توسط دستگاه اسپکتروفتومتر اندازهگیری و مقدار دارو با استفاده معادله خط نمودار استاندارد داروی پاکلیتاکسل در ایزوپروپانول تعیین شد. درنهایت بازده بارگذاری دارو با استفاده از فرمول زیر محاسبه گردید.
"بازده بارگذاری دارو (%)=" (" میزان داروی " درونگیری" شده" )/(" میزان داروی اولیه " مورداستفاده" شده " ) "×100"
بررسی رهایش داروی پاکلیتاکسل از فرمولاسیونهای مختلف نانو سامانههای نیوزومی
رهایش داروی پاکلیتاکسل از فرمولاسیونهای مختلف نانو سامانههای نیوزومی، با استفاده از دیالیز در PBS به مدت ۷۲ ساعت در دمای ℃۳۷ و pH=7/4 مطابق با شرایط فیزیولوژیک بافت نرمال انجام پذیرفت. همچنین جهت شبیهسازی شرایط فیزیولوژیک بافت توموری، pH=6/5و دمای ℃42 در نظر گرفته شد. بدین منظور، 10 میلیلیتر از نیوزومهای حاوی دارو، داخل کیسه دیالیز ریخته شد. 1 میلیلیتر از محلول دیالیز در زمانهای مشخص جمعآوری و بلافاصله با همان میزان از PBS تازه جایگزین شد. میزان جذب نوری نمونهها در طولموج 277 نانومتر با استفاده از دستگاه اسپکتروفتومتر اندازهگیری شد و سپس با استفاده از منحنی استاندارد داروی پاکلیتاکسل در PBS، میزان رهایش تجمعی دارو در مدتزمانهای مختلف، تعیین گردید.
تعیین و انتخاب فرمولاسیون بهینه
انتخاب فرمولاسیون بهینه جهت سنتز نانو سامانه نیوزومی حاوی پاکلیتاکسل بر اساس بیشترین میزان بارگذاری و پروفایل رهایش انتخاب شد. سپس بهمنظور بهبود ویژگیهای فیزیکی-شیمیایی فرمولاسیون بهینه نیوزومی حاصل (کارایی بارگذاری، پایداری و رهایش پیوسته دارو)، به فرمولاسیون نیوزومی بهینه میزان 5 درصد mPEG(2000)- DSPEاضافه شد. در آخر فرمولاسیون پگیله حاوی دارو جهت بررسی اندازه، شارژ سطحی، شکل ظاهری و سمیت سلولی موردبررسی قرار گرفت.
تعیین اندازه نانو ذرات و ضریب پراکندگی و پتانسیل زتا نانو نیوزومها
قطر هیدرودینامیک نانو سامانههای نیوزومی، شارژ سطحی و میانگین شاخص پراکندگی از طریق تکنیک پراش دینامیکی نور ((DLS و با استفاده از دستگاه زتاسایزر (Zetasizer Nano ZS,Malvern Panalytical, UK) تعیین گردید. بدین منظور، نمونههای رقیقشده با غلظت mg/ml 0/1 تهیه و بلافاصله پس از آمادهسازی، نور پراکنده در دمای اتاق با زاویه 90 درجه تشخیص داده شد و مورد آنالیز قرار گرفت.
تصویربرداری از نانو نیوزومها
بررسی مورفولوژی سطحی نانو سامانه بهینه پگیلهشده نیوزومی حاوی پاکلیتاکسل با استفاده از میکروسکوپ الکترونی روبشی (SEM) باقدرت 100 وات صورت گرفت. بدین منظور، 10 میکرولیتر از سوسپانسیون حاوی نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل بر روی لام شیشهای ریخته شد تا در دمای محیط خشکشده و یک لایهنازک بر روی لام تشکیل گردد. سپس نمونه با یکلایه طلا بهمنظور ایجاد رسانایی، پوششدار شد و با استفاده از میکروسکوپ الکترونی روبشی (FEG-SEM MIRA3 TESCAN, Czech Republic) تصویربرداری گردید. بررسی اثر سمیت سلولی نانو سامانه نیوزومی حاوی پاکلیتاکسل با استفاده از آزمون MTT
بهمنظور پی بردن به مقدار اثربخشی سامانه طراحیشده، میزان کشندگی فرم آزاد داروی پاکلیتاکسل و نانو سامانه نیوزومی حاوی پاکلیتاکسل بر روی رده سلولی Saos-2 و همچنین میزان سمیت نانو سامانه نیوزومی فاقد دارو در رده سلولی Saos-2 و رده سلولی فیبروبلاست نرمال (HFF) از طریق آزمون MTT مورد ارزیابی قرار گرفت. سلولهای مذکور در محیط کشت DMEM به همراه 10 درصد FBS و 1 درصد Pen-Strep (در انکوباتور با ℃۳۷، 5 درصد CO2 و 95 درصد رطوبت) کشت داده شدند. بهمنظور انجام آزمون MTT، سلولها با تراکم 104 سلول در هر چاهک پلیت ۹۶ خانه کشت داده شد و به مدت ۲۴ ساعت انکوبه گردید تا سلولها به کف پلیت بچسبند. سپس سلولها با حجم یکسانی از محیط کشت تازه (گروه کنترل)، محیط کشت تازه به همراه غلظتهای مختلف نانو سامانه بهینه نیوزمی پگیله بدون دارو، نانو سامانه بهینه نیوزمی پگیله حاوی پاکلیتاکسل (Nio-PTX) و پاکلیتاکسل آزاد (Free-PTX) (گروه تیمار) و در تکرارهای چهارتایی به مدت 48 ساعت تیمار شدند. پس از آن، میزان 10 میکرولیتر از محلول MTT با غلظتmg/ml 5 به چاهکها اضافه گردید و پس از 4 ساعت انکوباسیون، محیط چاهکها کاملاً دور ریخته شد و 100 میکرو لیتر DMSO به هر چاهک اضافه گردید. در انتها، جذب نوری در طولموج nm 570 با استفاده از میکروپلیت¬ریدر (ELx800, Biotek, USA) اندازهگیری شد و درصد زندهمانی سلولها با استفاده از معادله ذیل محاسبه شد:
"درصد زندهمانی سلولها" =(("میانگین جذب نوری نمونه" -"میانگین جذب نوری بلانک" ))/(("میانگین جذب نوری کنترل" -"میانگین جذب نوری بلانک" ) )×100
تجزیه وتحلیل آماری
بهمنظور بررسی آماری نتایج از نرمافزار Graphpad Prism ورژن 8، آنالیز ANOVA و آزمون مقایسه میانگین Tukey استفاده شد و سطوح معناداری نتایج برحسب P <0/05 سنجیده و گزارش گردید. علاوهبر این، رگرسیون غیرخطی جهت تعیین میزان IC50 مورداستفاده قرار گرفت.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی و خدمات درمانی شهید صدوقی یزد تائید شده است (کد اخلاق IR.SSU.MEDICINE.REC.1400.086).
نتایج
انتخاب فرمولاسیون نیوزومی مناسب
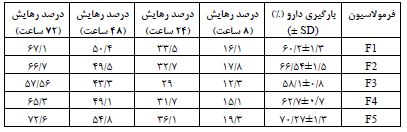
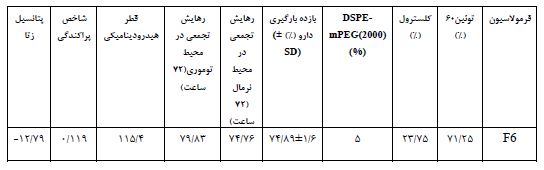
با توجه به این نکته که میزان بارگذاری دارو و نرخ رهایش از اساسیترین جنبههای کاربردی نانو حاملهای دارورسانی محسوب میشود، میزان درونگیری دارو و پروفایل رهایش فرمولاسیونهای حاوی داروی پاکلیتاکسل مورد بررسی قرارگرفته و فرمولاسیون بهینه انتخاب شد. بدین منظور، فرمولاسیونهای مختلف بهمنظور بهدست آوردن فرمولاسیون بهینه میزان بازده بارگذاری و رهایش دارو بررسی شدند (جدول2). سرانجام فرمولF5 (توئین60-کلسترول با نسبت 25:75) بهعنوان فرمولاسیون نهایی و بهینه برگزیده شد. در این فرمولاسیون میزان بارگیری دارو 70/27% و رهایش تجمعی دارو درمدت زمان 72 ساعت 72/6% اندازهگیری شد. با توجه به اثرگذاری پلیاتیلنگلیکول (PEG) برافزایش نیمهعمر و پایداری نانو حاملهای لیپیدی، بهمنظور بهبود ویژگیهای فیزیکی-شیمیایی (اندازه ذرات، کارایی بارگیری، رهایش دارو و بهبود ورود به سلول) به فرمولاسیون بهینه (F5) میزان 5 درصد PEG به فرم DSPE-mPEG(2000) اضافه گردید و فرمولاسیون بهینه نیوزومی پگیلهشده (F6) حاصل شد. در ادامه، بارگیری داروی پاکلیتاکسل در این فرمولاسیون 74.89 درصد اندازهگیری شد که در حدود دو درصد بیشتر از فرمولاسیون F5 بود.
رهایش داروی پاکلیتاکسل از نانو سامانه بهینه نیوزومی پگیله در محیط برون تن
جهت بررسی رهایش داروی پاکلیتاکسل از نانو سامانه بهینه نیوزومی پگیله در هر دو بافت سالم و توموری، شرایط فیزیولوژیک این بافتها شبیهسازی شد. بر همین اساس pH=7/4 و دمای ℃37 برای بافت سالم و pH=6/5 و دمای ℃42 برای بافت توموری در نظر گرفته شده و الگوی رهایش در هر دو محیط مورد ارزیابی قرار گرفت. بر اساس شکل 5 می¬توان چنین نتیجه گرفت که رهایش دارو از نانو سامانه طراحیشده دارای الگوی منظم و با آهستگی و پیوستگی مناسبی در شرایط فیزیولوژیک متفاوت هست.
اندازه شاخص پراکندگی ذرات و پتانسیل زتا
بر اساس نتایج، نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل میانگین سایز 115/4 نانومتر و شارژ سطحی 12/97- میلی ولت داشت و میزان شاخص پراکندگی آن (PDI) 0/119 بود. این نتایج در شکلهای 2و3 (به ترتیب سایز، PDIو شارژ سطحی) قابلمشاهده میباشند.
بررسی شکل ظاهری نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل با استفاده از میکروسکوپ الکترونی روبشی (SEM)
با توجه به تصویر نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل حاصل از میکروسکوپ الکترونی روبشی (شکل 4)، نانو سامانهها وزیکولی و کروی بوده و سطح وزیکولها صاف و هموار هستند. علاوهبراین، این تصویر نشان میدهد نانو سامانههای تولیدشده از نظر اندازه و شکل، توزیع همگنی دارند.
جدول 2: بازده بارگیری دارو (%EE) و رهایش دارو (%R) در فرمولاسیونهای نیوزومی منتخب حاوی داروی پاکلیتاکسل
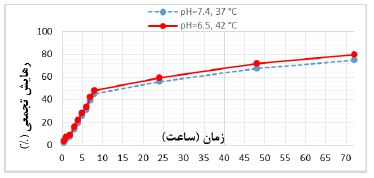
شکل 1 : رهایش پاکلیتاکسل از نانو سامانه بهینه نیوزومی پگیله (فرمولاسیون F6)
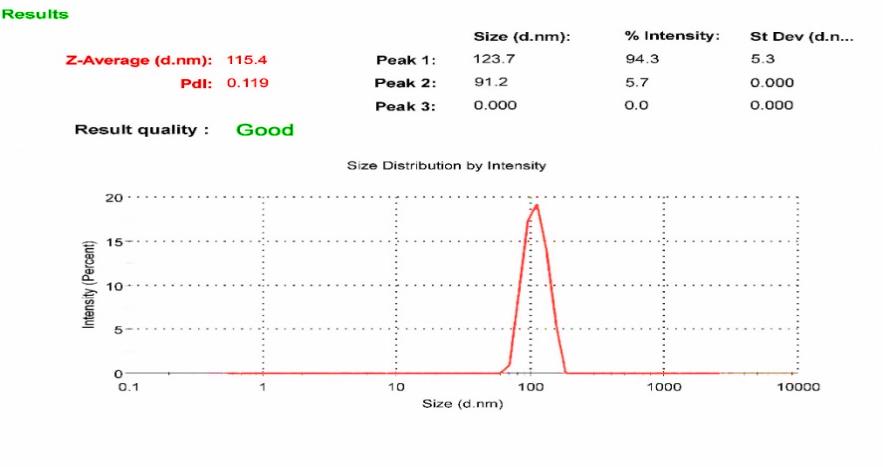
شکل 2: سایز و شاخص پراکندگی (PDI) نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل

شکل 3 : توزیع بار و شارژ سطحی نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل

شکل 4 : تصاویر SEM از نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل.
آزمایش سمیت سلولی به روش MTT
نتایج سمیت سلولی حاصل از آزمون MTT نشان داد که هر دو فرم آزاد و نیوزومی داروی پاکلیتاکسل دارای اثر سمیت در رده سلولی سرطان استئوسارکوما (Saos-2) است (IC50=50.66 µg/ml برای فرم آزاد پاکلیتاکسل و IC50=25.99 µg/ml برای فرم نیوزومی) (شکل 5-الف و 5-ب)، که نشاندهنده این موضوع است که فرم نیوزومی داروی پاکلیتاکسل دارای سمیتی در حدود 1/94 برابر بیشتر از فرم آزاد این دارو است. از طرف دیگر، بر اساس نتایج، نانو سامانه بهینه نیوزومی پگیله فاقد دارو، در غلظتهای مورد مطالعه اثر سمیت ناچیزی هم در رده سلولی Saos-2 و HFF از خود نشان میدهند، بهطوریکه IC50 نانو سامانه نیوزومی فاقد دارو در رده سلولی Saos-2 و HFF به ترتیب 1/689 و 1/327 میلیگرم در میلیلیتر تعیین شد و حداکثر غلظتی که از این نانو سامانه در مطالعه حاضر مورد استفاده قرار گرفت، مقدار 100 میکروگرم در میلیلیتر بوده که بیش از 10 برابر کمتر از میزان IC50 آن بوده است (شکل 5-ج و 5-د). علاوهبراین، بررسی آماری نتایج حاصل از MTT نشان داد که نانو سامانه نیوزومی حاوی پاکلیتاکسل، اثر سمیت بیشتری نسبت به فرم آزاد این دارو در تمامی غلظت¬های مورداستفاده، بهجز غلظت 5 میکروگرم در میلیلیتر، داشته است (P>0.01، شکل 6).
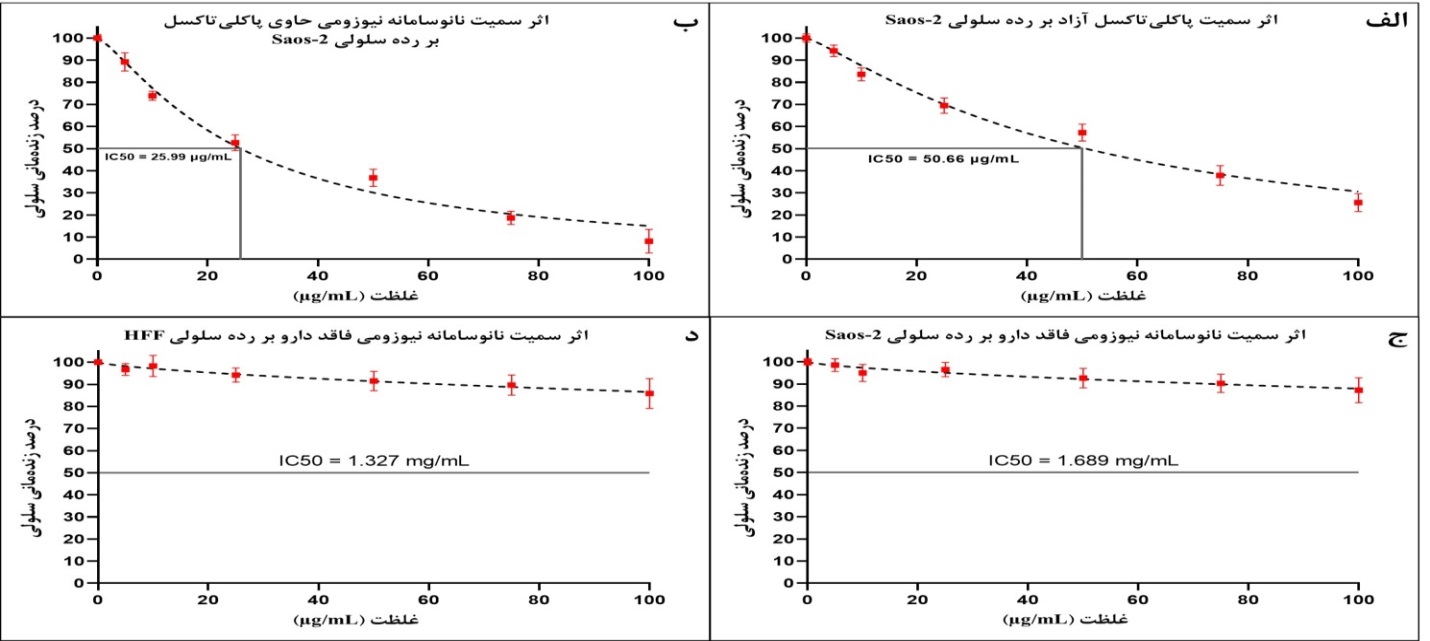
شکل 5 : نتایج حاصل از آزمون MTT. الف: اثر سمیت و میزان IC50 پاکلیتاکسل آزاد بر رده سلولی Saos-2، ب: اثر سمیت و میزان IC50 نانو سامانه نیوزومی حاوی پاکلیتاکسل بر رده سلولی Saos-2، ج: اثر سمیت و میزان IC50 نانو سامانه نیوزومی فاقد دارو بر رده سلولی Saos-2 و د: اثر سمیت و میزان IC50 نانو سامانه نیوزومی فاقد دارو در رده سلولی HFF.
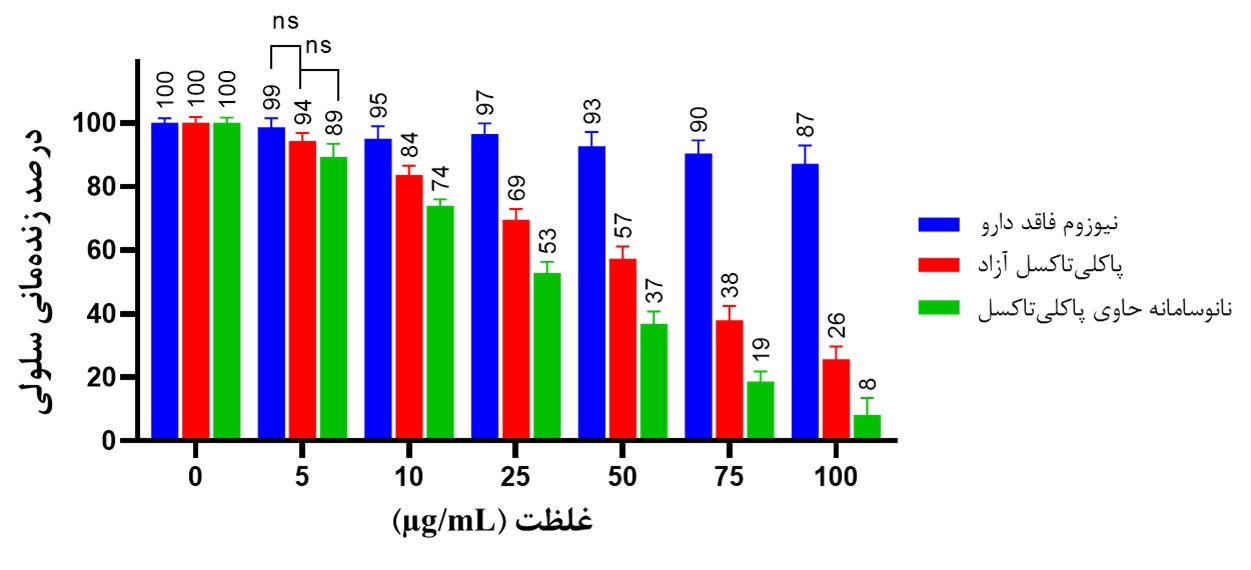
شکل 6: نمودار اثر سمیت فرم آزاد داروی پاکلیتاکسل، فرم نیوزومی آن و نانو سامانه نیوزومی فاقد دارو در رده سلولی Saos-2. نتایج حاصل از آزمون ANOVA دوطرفه و مقایسه میانگین Tukey نشان داد که بهجز غلظت 5 میکروگرم در میلیلیتر، در تمامی غلظتهای دیگر، اثر سمیت در فرم-های مختلف تیمار دارای تفاوت معنادار در سطح P>0.01 است (ns=عدم وجود تفاوت معنادار).
بحث
استئوسارکوما، یکی از شایعترین سرطانهای بدخیم استخوان است که بیشتر نوجوانان بین 10 تا 24 سال را تحت تأثیر قرار میدهد (18). در استراتژیهای درمانی، شیمیدرمانی میتواند میزان انتشار این سرطان را بسیار کاهش دهد، با این وجود، ظهور مقاومت چندگانه دارویی در این نوع از سرطان، کارآمدی داروهای شیمیدرمانی را بهطور قابلتوجهی کاهش داده است (6). از طرف دیگر، روشهای دارورسانی مبتنی بر فناوری نانو در دنیای امروز، دروازه جدید و امیدبخشی در حوزه تشخیصی و درمانی به روی ما گشوده است. استفاده از نانو داروها از طریق افزایش دسترسپذیری و جذب دارو، کاهش پاکسازی دارو از جریان خون به دلیل اندازه کوچک و اصلاح سطحی ذرات (پگیلاسیون)، می-تواند کارایی و هدفمندی استفاده از داروهای شیمیدرمانی را بهطور مؤثری افزایش دهد (19). به همین منظور در مطالعه حاضر، جهت دارورسانی داروی پاکلیتاکسل به رده سلولی Saos-2 بهعنوان مدلی از استئوسارکوما، از نانو سامانههای نیوزومی استفاده شد. نیوزومها، به دلیل ویژگیهای منحصربهفردی که دارند، امروزه در استراتژیهای دارورسانی مبتنی بر فناوری نانو بسیار موردتوجه قرارگرفتهاند و مطالعات بسیاری در استفاده از این نانو سامانهها در دارورسانی سرطان تاکنون صورت گرفته است (20–23). در مطالعه حاضر، از فرمولاسیونهای مختلف با نسبت 75:25 کلسترول به سورفکتانت جهت ساخت نانو سامانههای نیوزومی استفاده شد. در همین راستا سورفکتانتهای اسپن40 (فرمول 1)، اسپن60 (فرمول 2)، اسپن80 (فرمول 3)، توئین 80(فرمول4) و توئین60 (فرمول 5) مورد استفاده قرار گرفت. مطالعات نشان دادهاند که اسپنها، گروه سر یکسان و زنجیره آلکیل متفاوت دارند که با افزایش طول زنجیره آلکیل میزان لود افزایش مییابد (24). در مطالعه حاضر نیز، میزان لود فرمولاسیون دو با اسپن 60 (زنجیره آلکیل 18 کربنی) از فرمولاسیون یک با اسپن 40 (زنجیره آلکیل 16 کربنی) بیشتر بوده است. بااینحال اسپن80 با زنجیره آلکیل 18 کربنی، میزان لود کمتری نشان را داد (Span60> Span40> Span80). این امر میتواند به این دلیل باشد که اسپن80 گروه اشباعنشده در ساختار خود دارد (25). در مورد توئین نیز این قاعده صادق است، باوجود اینکه توئین60 و توئین80 هر دو 18 کربن در زنجیره آلکیل خود دارند، فرمولاسیون حاوی توئین80 به دلیل وجود گروه اشباع نشده در ساختار خود لود کمتری را از خود نشان داد Tween60>Tween80)). استفاده از سورفکتانت توئین60 در فرمولاسیونهای استفادهشده در کنار کلسترول موجب ایجاد وزیکولهای پایدار شد که تمایل غشای نانو سامانه را به مولکولهای هیدرووفوب افزایش میدهد. از سوی دیگر فرمولاسیون تهیهشده از توئین 60 در مقایسه با فرمولاسیون تهیهشده از اسپن60 میزان رهایش مطلوبتری را نشان داد که با سایر پژوهش¬ها نیز همراستا است (26). در ادامه با اضافه کردن 5% فسفولیپید پگیله DSPE-mPEG(2000) به فرمول 5، افزایش پایداری و بازده بارگیری مشاهده شد. مطالعات متعدد نشان داده است که پگیلهشدن، پوشاندن و پنهانکردن نیوزومها را از سیستم ایمنی میزبان بهبود بخشیده و فیلتراسیون کلیوی را کاهش میدهد؛ بنابراین نیمهعمر بیشتری در شرایط درونتن (in vivo) بروز میدهد (27). پگیله شدن همچنین PDI نیوزومها را کاهش داده و سبب بهبود پایداری نیوزومها میگردد و از طریق کاهش PDI، تراکم و تجمع نانو سامانه بهصورت توده را کاهش میدهد (28). بهعنوان مثال، هونگ و همکاران در مطالعهای بهمنظور افزایش پایداری سامانه لیپوزومی از فسفولیپیدهای مختلف DPCC، DSPE و EggPC/CH به همراه PEG استفاده کردند که افزایش قابلتوجه پایداری سامانه را در هنگام استفاده از PEGدر سطح نانوذره گزارش کردند (29). از طرف دیگر، اندازه نانوذره، از عوامل بسیار مهم و تأثیرگذار در تجمع دارو در سایت تومور، بازده درمان، تراوشپذیری از رگها و پایداری نانو حاملها است (30) بهطوریکه نتایج حاصل از تحقیقات نشان دادهاند حاملهایی با اندازه کوچکتر، ارائهکننده هدفگیری و تجمع بهتری در سایت عمل بودهاند (31). در مطالعه حاضر، نتایج نشان داد که نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل دارای قطر هیدرودینامیکی با متوسط اندازه 115/4 بوده است که همراستا با مطالعات پیشین است و همچنین اندازه مطلوبی محسوب میشود (17,32,33). Hnog Sook و همکاران در سال 2015 بهمنظور افزایش پایداری سامانه لیپوزومی از فسفولیپیدهای مختلف DPCC،DSPE و EggPC/CH به همراه PEG استفاده کردند که افزایش قابلتوجه پایداری سامانه را در هنگام استفاده از PEGدر سطح نانوذره مشاهده کردند (29). در مطالعهای که توسط Bayindir و همکاران انجام شد، الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی بررسی شد. در این مطالعه مشخص شد الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی حاوی توئین ۶۰ و کلسترول موجب رهایش ابتدایی سریع دارو در فاز اول خواهد شد. با این وجود رهایش دارو در فاز دوم، آهستهتر دنبال میشود (16). در مطالعهای که توسط Manosroi و همکارانش انجام شد اثر وجود کلسترول را در فرمولاسیون نیوزومی حاوی تویین 60 بررسی کردند. نتایج نشان داد که کارایی بارگذاری دارو تحت تاثیر طول زنجیره آلکیل سورفکتانت غیر یونی و مقدار کلسترول به کار برده شده در تهیه وزیکولها بستگی دارد. مشخص شد که تویین 60 بدون حضور کلسترول امکان تشکیل نیوزوم را ندارد و با اضافه کردن کلسترول، نیوزوم با حداکثر بارگذاری دارو تشکیل میشود. بهعلاوه مشخص شد که سورفکتانت غیر یونی با زنجیره آلکیل 18 کربنِ مانند تویین 60 کارایی بارگذاری بالاتری نسبت به سورفکتانت غیر یونی با زنجیره آلکیل 12 کربنِ مانند تویین 20 دارد (34). بهطور خلاصه در مطالعه حاضر فرمولاسیون بهینه نیوزومی پگیله (فرمول6) حاوی توئین60 و کلسترول و فسفولیپید پگیله DSPE-mPEG(2000) با نسبت (75:25:5) از چند جهت دارای ویژگی¬های مطلوبی بود، ازجمله: قطر کوچک، رهایش کنترلشده دارو و بازده درونگیری بالا (جدول3). این نتایج با مطالعه که توسط بایندیر و همکاران انجام شد مطابقت دارد، در آن مطالعه الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی بررسی و مشخص شد الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی حاوی توئین۶۰ و کلسترول موجب رهایش ابتدایی سریع دارو در فاز اول خواهد شد، بااینوجود رهایش دارو در فاز دوم، آهستهتر دنبال میشود (16). علاوه بر آنچه ذکر گردید، نتایج آزمون MTT نشان داد که نانو سامانه بهینه نیوزومی پگیله حاوی پاکلی¬تاکسل بهطور قابلتوجهی در افزایش سمیت داروی پاکلیتاکسل در عین کاهش غلظت داروی استفادهشده، مؤثر عمل کرده است بهطوریکه IC50 نانو سامانه حاوی دارو در حدود 1/94 برابر بیشتر از مقدار IC50 دارو بود، درحالیکه نانو سامانه فاقد دارو سمیت قابلتوجهی چه در رده سلولی سرطانی Saos-2 و چه در رده سلولی نرمال HFF نداشت. این موضوع در کنار کاهش نسبت لیپید به دارو (L/D) بهکاررفته در فرمولاسیونهای نیوزومی که تنها 10% بوده است، نشان میدهد میزان داروی مورداستفاده نسبت به مطالعات پیشین کاهش پیدا کرده است (35–37). بهعبارتدیگر، با استناد به نتایج حاصل از تستهای سلولی میتوان ادعا نمود این پژوهش توانسته دوز مؤثر دارو را کم و درعینحال، خواص دارویی و درمانی آن را حفظ نماید.
جدول 3: مشخصات کلی نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل
نتیجهگیری
استفاده از نانو حاملهای دارویی بهعنوان رویکردی مؤثر برای تحویل هوشمند دارو در سالهای اخیر بسیار موردتوجه بوده است. طی این سالها استفاده از نانو حاملهایی که دارورسانی را بهصورت غیر هدفمند و یا هدفمند به سلولهای سرطانی تحویل نماید، با موفقیتهای چشمگیری همراه بوده است. استفاده از سیستمهای دارورسانی بر پایه سورفکتانتها همچون نیوزوم به دلیل شباهت ساختاری با غشای سلول و بدن انسان، موانع عبور از رگهای خونی و بافتهای متعدد را پشت سر میگذارد. همچنین تحویل داروهای شیمیایی مانند پاکلیتاکسل درون یک فضای محصورشده و کروی در مقیاس نانو عوارض سیتوتوکسیتی آن را برای سلولهای سالم تا حد زیادی کاهش میدهد. در این مطالعه، نانو سامانه نیوزومی طراحی و ساخته شد که علاوه برداشتن اندازه کوچک و قطر هیدرودینامیکی مناسب، مورفولوژی کروی و پایداری شیمیایی و شاخص پراکندگی مناسب، قادر به بارگیری و رهایش داروی پاکلیتاکسل با کارایی بالا بودند. علاوه بر این، نانو سامانه نیوزومی طراحی و ساختهشده با موفقیت توانست داروی موردنظر را بهصورت مؤثر به سلولهای سرطانی تحویل دهد و علیرغم میزان کمتر دارو در مقایسه با داروی آزاد، در این سلولها توانست سمیت بیشتری ایجاد نماید. همچنین اصلاح سطحی نانو حامل با پلیاتیلن گلیکول علاوه بر ایجاد پایداری نانو سامانه و کاهش شاخص پراکندگی آن در مطالعه حاضر، میتواند در مطالعات درونتنی نیز بهعنوان یک عامل برتری دهنده نسبت به داروی آزاد مورد بررسی و مطالعه قرار گیرد. بنابراین با توجه به اینکه نانو سامانه حاضر در شرایط حاکم بر سلولهای سرطانی بهصورت نیمه هدفمند عمل نموده، میتوان چنین پیشنهاد نمود سامانه مذکور قابلیت این را دارد تا در مطالعات برونتنی در مدلهای آزمایشگاهی، بهعنوان یک کاندید درمانی امیدبخش مورد مطالعه قرار گیرد.
سپاسگزاری
این مقاله حاصل بخشی از پایاننامه آقای محمدجواد پورمحمودیان دانشجو کارشناسی ارشد زیستفناوری پزشکی از دانشکده پزشکی دانشگاه علوم پزشکی شهید صدوقی یزد هست که در مرکز تحقیقات زیستفناوری پردیس بینالملل دانشگاه علوم پزشکی شهید صدوقی یزد انجام گرفت. صمیمانه از اساتید و مسئولین محترم این مرکز در خصوص تسهیل بهرهمندی از فضای آزمایشگاهی و دستگاهی تشکر میگردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
تومورهای استخوان یکی از قدیمیترین نوع تومورها در پاتولوژی است و در تمام کشورها با تمام نژادها بروز میکند. در ایالت متحده امریکا، هرساله بیش از 800 نفر مبتلا به این تومورها تشخیص داده میشوند (1). استئوسارکوما شایعترین تومور سرطانی اولیه در استخوان است که بیشتر در کودکان و بالغین جوان شیوع دارد (2). علت دقیق ایجاد سرطان استخوان مشخص نیست، اما شواهد تحقیقاتی حاکی از آن است که جهش در DNA سلولهای استخوان و نیز سایر جهشهای قابل اکتساب پس از تولد در سلولهای مذکور، عامل اصلی این نوع از بدخیمی است (3). شیمیدرمانی از متداولترین استراتژیها در درمان سرطان است و تقریباً در تمام انواع سرطانها، جایگاه ویژهای دارد (4). جراحی تومور استخوان تأثیرات زیادی بر کودکان دارد و همواره نیازمند به شیمیدرمانی بهعنوان مکمل درمانی هست، با این وجود این روش بسیار دردناک، فرسایشی و همراه با فشارهای مالی و روحی برای بیمار و اطرافیان وی است. و همچنین روشهای درمانی مرسوم و فعلی برای استئوسارکوما، بهویژه انواعی که قابلیت متاستاز دارند، اغلب بهاندازه کافی مؤثر نیستند (5). علاوه براین، توسعه مقاومت چندگانه دارویی، یکی از موانع عمدهای است که در استراتژی شیمیدرمانی استئوسارکوما بهطور فزایندهای در حال مشاهده است و یک چالش قابلتوجه برای درمان موفقیتآمیز سرطان به شمار میرود (6). استفاده از نانوسامانهها جهت دارورسانی، راهحل جدیدی برای افزایش اثربخشی درمانی داروهای ضد سرطان به دلیل توانایی آنها در انتقال هدفمند و کنترلشده دارو به تومورها است و میتواند اثرات سیستمیک ناخواسته عوامل شیمیدرمانی را محدود کند و همچنین مقاومت دارویی را کاهش دهد (7). دراینبین، نیوزومها، بهعنوان یکی از جدیدترین نانو سامانهها جهت دارورسانی، بسیار مورد توجه قرار گرفتهاند. نیوزومها، وزیکولهایی هستند که از خود تجمعی سورفکتانتهای غیر یونی در محیط آب، توسط آرایش خودبهخودی از طریق میان کنشهای آبدوستیآبگریزی شکل میگیرند و ساختار دولایه محصوری را ایجاد میکنند، بهعبارتدیگر در محیط آبی، نواحی آبگریز آنها تمایل به تجمع دور یکدیگر، و نواحی آبدوست آنها، تمایل به تماس با فاز آبی را دارد (8,9). اهمیت چنین سیستمی در دارورسانی، قابلیت حمل داروهای آبدوست و آبگریز است بهصورت همزمان است، که سبب افزایش حلالیت داروهای آبگریز و کاهش معنیدار غلظت مؤثر داروها میشود (10). پاکلیتاکسل یکی از پراستفادهترین داروهای شیمیدرمانی هست که در درمان سرطان سینه، تخمدان، ریه و سارکوم کاپوسی استفاده میشود؛ همچنین در مطالعات اخیر با استفاده دوز پایین پاکلیتاکسل در بیمارهای غیر سرطانی مانند بیماریهای پوستی، کلیوی، فیبروز کبدی، التهاب، بازسازی آکسون و تنگی عروقکرونر مورداستفاده قرارگرفته است (11,12). پاکلیتاکسل یک داروی آنتی نئوپلاستیک از خانواده داروهای مؤثر بر اسکلت سلولی محسوب میشود که ساختار توبولین ها را در سلول هدف قرار میدهد؛ در ادامه، اثر این دارو با اختلال در آرایش دوکهای میتوزی و عدم جدا شدن صحیح کروموزومها از یکدیگر دنبال میشود که در نهایت تقسیم سلولی را از مسیر درست خود منحرف میسازد (13). در پژوهشی توسط wang در سال 2000 به بررسی اثر پاکلیتاکسل بر مرگ سلولهای سرطانی پرداختند. پاکلیتاکسل بااتصال به میکروتوبولها باعث توقف چرخه سلولی در فاز میتوزی شده که درنهایت منجر به آپوپتوز سلولی میشود (14). عالمی و همکارانش در سال 2018 به بررسی اثر داروی پاکلیتاکسل و کورکومین که در نانو حاملهای نیوزومی بارگذاری کرده بودند و بررسی اثر همافزایی این سامانه بر روی سلولهای سرطان سینه پرداختند. یافتههای آنها یک رویکرد موفقیتآمیز در درمان سرطان را نشان داد و حاکی از آن بود که این ترکیب دارویی اثر سایتوتوکسیتی قابلملاحظهای بر روی رده سلولی MCF7 داشته است (15). Bayindir ZS و همکارانش در سال 2015 به بررسی و مقایسه اثر فارماکوکینتیک داروی پاکلیتاکسل بهوسیله بارگذاری آن در یک حامل نیوزومی در رتها پرداختند. این محققان در تزریق وریدی سامانه دارویی مذکور در رتها، افزایش قابلملاحظه نیمهعمر داروی پاکلیتاکسل مشاهده نمودند (16). هدف از مطالعه حاضر، طراحی، ساخت و مشخصهیابی نانو حاملهای نیوزومی جهت انتقال داروی پاکلیتاکسل به رده سلولیSaos-2 بهعنوان مدلی از استئوسارکومای دارای مقاومت چندگانه دارویی است. در این راستا، نسبتهای مختلفی از کلسترول و سورفاکتانتهای مختلف جهت سنتز نانو سامانههای نیوزومی مورداستفاده قرار گرفت و میزان بارگیری داروی پاکلیتاکسل در نانو سامانههای نیوزومی و همچنین میزان رهایش این دارو ارزیابی و تعیین شد. درنهایت میزان سمیت سلولی نانو سامانه نیوزومی بهینه حاوی دارو پاکلیتاکسل در مقایسه با داروی پاکلیتاکسل بهتنهایی در رده سلولی Saos-2 بهعنوان مدلی از استوسارکوما و رده سلولی فیبروبلاستی نرمال (HFF) از طریق آزمون MTT تعیین شد.
روش بررسی
در مطالعه حاضر، سورفکتانتهای غیر یونی (Span40، Span60، Span80، Tween60 و Tween80)،DSPE-mPEG(2000) ، کلسترول، کیت MTT، پاکلیتاکسل و کیسه دیالیز (MWCO 12000 Da) از شرکت سیگما (Sigma Aldrich, USA)؛ کلروفورم، ایزوپروپانول، متانول از شرکت مرک (Merck, Germany)، محیط کشت DMEM high glucose از شرکت گیبکو (Gibco, USA)، سرم جنین گاوی (FBS)، بافر فسفات سالین (PBS)، آنتیبیوتیک پنیسیلین-استرپتومایسین (Pen-Strep, 10,000 U/mL -10 mg/mL) و تریپسین EDTA از شرکت زیستایده نوترکیب (ایران) تهیه و استفاده شد. همچنین رده سلولی Saso-2 از بانک سلولی انستیتو پاستور ایران و رده سلولی فیبروبلاست نرمال (HFF) از بانک سلول مرکز تحقیقات بیولوژی سلولهای بنیادی (یزد، ایران) تهیه گردید.
ترسیم نمودار کالیبراسیون پاکلیتاکسل
غلظتهای مختلف از داروی پاکلیتاکسل در ایزوپروپانول و بافر فسفات سالین (PBS) به روش سری استاندارد تهیه شد. سپس جذب نوری آنها در طولموج 227 نانومتر توسط دستگاه اسپکتروفتومتر (CECIL 7250, Bio Aquarius, UK) اندازهگیری گردید. در نهایت نمودار کالیبراسیون و معادله خط داروی پاکلیتاکسل با استفاده از نرمافزار Microsoft Excel 2013 به دست آمد.
سنتز نانو سامانه نیوزومی با داروی پاکلیتاکسل
از روش آبپوشانی لایهنازک جهت ساخت نانو سامانههای نیوزومی در این مطالعه استفاده شد (17). بهطور خلاصه، کلسترول و سورفکتانتهای غیر یونی مختلف در کلروفورم حل شد تا ترکیب کلسترول (25%)سروفکتانت (75%) حاصل شود (جدول 1). سپس داروی پاکلیتاکسل با نسبت دارو (1)-لیپید (10) به محلول قبلی اضافه شد. پس از همگن شدن محلول حاوی کلسترولسورفاکتانتدارو در روتاری (Heidolph, Germany) در دمای ℃ 40، حلال از طریق ایجاد خلأ حذف و لایهنازک تشکیل شد. جهت اطمینان از حذف کامل حلال، لایهنازک تشکیلشده به مدت ۲۴ ساعت در دمای ℃ 4 در یخچال قرار گرفت. سپس لایهنازک تشکیلشده با 10 میلیلیتر بافر فسفات (PBS, pH=7.4) در دمای ℃ 45 به مدت 60 دقیقه هیدراته شد تا سوسپانسیون نیوزومی حاوی پاکلیتاکسل بهدست آید. برای کاهش اندازه نیوزومهای چندلایه و تشکیل نیوزومهای کوچک تک لایه از اولتراسونیک پروبی (UP200Ht, Hielscher, Germany) با توان ۶۰ وات، به مدت ۳۰ دقیقه (15 ثانیه روشن و 10 ثانیه خاموش) استفاده شد. سپس بهمنظور جداسازی ذرات با اندازه بزرگتر از 200 نانومتر و همگن شدن محلول بهدستآمده، فیلتراسیون با استفاده از فیلتر سرسرنگی 0/2 میکرون انجام شد.
جدول 1: فرمولاسیونهای مختلف پاکلیتاکسل استفادهشده در مطاله حاضر.

حذف داروی آزاد و تعیین درصد بارگذاری دارو در وزیکولهای نیوزومی
جهت حذف داروی آزاد، سوسپانسیون همگن و فیلترشده، به درون کیسه دیالیز ریخته شد و کیسه دیالیز به مدت 6 ساعت درون محلول دیالیز (PBS) در دمای ℃ 4 قرار داده شد. هر یک ساعت، محلول دیالیز تعویض شد تا داروی آزاد بارگیری نشده بهخوبی حذف گردد. پس از حذف داروی آزاد، سوسپانسیون نیوزومی با نسبت 1 به 10 با ایزوپروپانول مخلوط و در دمای اتاق به مدت 1 ساعت انکوبه شد تا با تخریب ساختار نانو سامانه نیوزومی، داروی بارگذاری شده درون آن، آزاد شود. سپس جذب نوری آن را در طولموج 227 نانومتر توسط دستگاه اسپکتروفتومتر اندازهگیری و مقدار دارو با استفاده معادله خط نمودار استاندارد داروی پاکلیتاکسل در ایزوپروپانول تعیین شد. درنهایت بازده بارگذاری دارو با استفاده از فرمول زیر محاسبه گردید.
"بازده بارگذاری دارو (%)=" (" میزان داروی " درونگیری" شده" )/(" میزان داروی اولیه " مورداستفاده" شده " ) "×100"
بررسی رهایش داروی پاکلیتاکسل از فرمولاسیونهای مختلف نانو سامانههای نیوزومی
رهایش داروی پاکلیتاکسل از فرمولاسیونهای مختلف نانو سامانههای نیوزومی، با استفاده از دیالیز در PBS به مدت ۷۲ ساعت در دمای ℃۳۷ و pH=7/4 مطابق با شرایط فیزیولوژیک بافت نرمال انجام پذیرفت. همچنین جهت شبیهسازی شرایط فیزیولوژیک بافت توموری، pH=6/5و دمای ℃42 در نظر گرفته شد. بدین منظور، 10 میلیلیتر از نیوزومهای حاوی دارو، داخل کیسه دیالیز ریخته شد. 1 میلیلیتر از محلول دیالیز در زمانهای مشخص جمعآوری و بلافاصله با همان میزان از PBS تازه جایگزین شد. میزان جذب نوری نمونهها در طولموج 277 نانومتر با استفاده از دستگاه اسپکتروفتومتر اندازهگیری شد و سپس با استفاده از منحنی استاندارد داروی پاکلیتاکسل در PBS، میزان رهایش تجمعی دارو در مدتزمانهای مختلف، تعیین گردید.
تعیین و انتخاب فرمولاسیون بهینه
انتخاب فرمولاسیون بهینه جهت سنتز نانو سامانه نیوزومی حاوی پاکلیتاکسل بر اساس بیشترین میزان بارگذاری و پروفایل رهایش انتخاب شد. سپس بهمنظور بهبود ویژگیهای فیزیکی-شیمیایی فرمولاسیون بهینه نیوزومی حاصل (کارایی بارگذاری، پایداری و رهایش پیوسته دارو)، به فرمولاسیون نیوزومی بهینه میزان 5 درصد mPEG(2000)- DSPEاضافه شد. در آخر فرمولاسیون پگیله حاوی دارو جهت بررسی اندازه، شارژ سطحی، شکل ظاهری و سمیت سلولی موردبررسی قرار گرفت.
تعیین اندازه نانو ذرات و ضریب پراکندگی و پتانسیل زتا نانو نیوزومها
قطر هیدرودینامیک نانو سامانههای نیوزومی، شارژ سطحی و میانگین شاخص پراکندگی از طریق تکنیک پراش دینامیکی نور ((DLS و با استفاده از دستگاه زتاسایزر (Zetasizer Nano ZS,Malvern Panalytical, UK) تعیین گردید. بدین منظور، نمونههای رقیقشده با غلظت mg/ml 0/1 تهیه و بلافاصله پس از آمادهسازی، نور پراکنده در دمای اتاق با زاویه 90 درجه تشخیص داده شد و مورد آنالیز قرار گرفت.
تصویربرداری از نانو نیوزومها
بررسی مورفولوژی سطحی نانو سامانه بهینه پگیلهشده نیوزومی حاوی پاکلیتاکسل با استفاده از میکروسکوپ الکترونی روبشی (SEM) باقدرت 100 وات صورت گرفت. بدین منظور، 10 میکرولیتر از سوسپانسیون حاوی نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل بر روی لام شیشهای ریخته شد تا در دمای محیط خشکشده و یک لایهنازک بر روی لام تشکیل گردد. سپس نمونه با یکلایه طلا بهمنظور ایجاد رسانایی، پوششدار شد و با استفاده از میکروسکوپ الکترونی روبشی (FEG-SEM MIRA3 TESCAN, Czech Republic) تصویربرداری گردید. بررسی اثر سمیت سلولی نانو سامانه نیوزومی حاوی پاکلیتاکسل با استفاده از آزمون MTT
بهمنظور پی بردن به مقدار اثربخشی سامانه طراحیشده، میزان کشندگی فرم آزاد داروی پاکلیتاکسل و نانو سامانه نیوزومی حاوی پاکلیتاکسل بر روی رده سلولی Saos-2 و همچنین میزان سمیت نانو سامانه نیوزومی فاقد دارو در رده سلولی Saos-2 و رده سلولی فیبروبلاست نرمال (HFF) از طریق آزمون MTT مورد ارزیابی قرار گرفت. سلولهای مذکور در محیط کشت DMEM به همراه 10 درصد FBS و 1 درصد Pen-Strep (در انکوباتور با ℃۳۷، 5 درصد CO2 و 95 درصد رطوبت) کشت داده شدند. بهمنظور انجام آزمون MTT، سلولها با تراکم 104 سلول در هر چاهک پلیت ۹۶ خانه کشت داده شد و به مدت ۲۴ ساعت انکوبه گردید تا سلولها به کف پلیت بچسبند. سپس سلولها با حجم یکسانی از محیط کشت تازه (گروه کنترل)، محیط کشت تازه به همراه غلظتهای مختلف نانو سامانه بهینه نیوزمی پگیله بدون دارو، نانو سامانه بهینه نیوزمی پگیله حاوی پاکلیتاکسل (Nio-PTX) و پاکلیتاکسل آزاد (Free-PTX) (گروه تیمار) و در تکرارهای چهارتایی به مدت 48 ساعت تیمار شدند. پس از آن، میزان 10 میکرولیتر از محلول MTT با غلظتmg/ml 5 به چاهکها اضافه گردید و پس از 4 ساعت انکوباسیون، محیط چاهکها کاملاً دور ریخته شد و 100 میکرو لیتر DMSO به هر چاهک اضافه گردید. در انتها، جذب نوری در طولموج nm 570 با استفاده از میکروپلیت¬ریدر (ELx800, Biotek, USA) اندازهگیری شد و درصد زندهمانی سلولها با استفاده از معادله ذیل محاسبه شد:
"درصد زندهمانی سلولها" =(("میانگین جذب نوری نمونه" -"میانگین جذب نوری بلانک" ))/(("میانگین جذب نوری کنترل" -"میانگین جذب نوری بلانک" ) )×100
تجزیه وتحلیل آماری
بهمنظور بررسی آماری نتایج از نرمافزار Graphpad Prism ورژن 8، آنالیز ANOVA و آزمون مقایسه میانگین Tukey استفاده شد و سطوح معناداری نتایج برحسب P <0/05 سنجیده و گزارش گردید. علاوهبر این، رگرسیون غیرخطی جهت تعیین میزان IC50 مورداستفاده قرار گرفت.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی و خدمات درمانی شهید صدوقی یزد تائید شده است (کد اخلاق IR.SSU.MEDICINE.REC.1400.086).
نتایج
انتخاب فرمولاسیون نیوزومی مناسب
با توجه به این نکته که میزان بارگذاری دارو و نرخ رهایش از اساسیترین جنبههای کاربردی نانو حاملهای دارورسانی محسوب میشود، میزان درونگیری دارو و پروفایل رهایش فرمولاسیونهای حاوی داروی پاکلیتاکسل مورد بررسی قرارگرفته و فرمولاسیون بهینه انتخاب شد. بدین منظور، فرمولاسیونهای مختلف بهمنظور بهدست آوردن فرمولاسیون بهینه میزان بازده بارگذاری و رهایش دارو بررسی شدند (جدول2). سرانجام فرمولF5 (توئین60-کلسترول با نسبت 25:75) بهعنوان فرمولاسیون نهایی و بهینه برگزیده شد. در این فرمولاسیون میزان بارگیری دارو 70/27% و رهایش تجمعی دارو درمدت زمان 72 ساعت 72/6% اندازهگیری شد. با توجه به اثرگذاری پلیاتیلنگلیکول (PEG) برافزایش نیمهعمر و پایداری نانو حاملهای لیپیدی، بهمنظور بهبود ویژگیهای فیزیکی-شیمیایی (اندازه ذرات، کارایی بارگیری، رهایش دارو و بهبود ورود به سلول) به فرمولاسیون بهینه (F5) میزان 5 درصد PEG به فرم DSPE-mPEG(2000) اضافه گردید و فرمولاسیون بهینه نیوزومی پگیلهشده (F6) حاصل شد. در ادامه، بارگیری داروی پاکلیتاکسل در این فرمولاسیون 74.89 درصد اندازهگیری شد که در حدود دو درصد بیشتر از فرمولاسیون F5 بود.
رهایش داروی پاکلیتاکسل از نانو سامانه بهینه نیوزومی پگیله در محیط برون تن
جهت بررسی رهایش داروی پاکلیتاکسل از نانو سامانه بهینه نیوزومی پگیله در هر دو بافت سالم و توموری، شرایط فیزیولوژیک این بافتها شبیهسازی شد. بر همین اساس pH=7/4 و دمای ℃37 برای بافت سالم و pH=6/5 و دمای ℃42 برای بافت توموری در نظر گرفته شده و الگوی رهایش در هر دو محیط مورد ارزیابی قرار گرفت. بر اساس شکل 5 می¬توان چنین نتیجه گرفت که رهایش دارو از نانو سامانه طراحیشده دارای الگوی منظم و با آهستگی و پیوستگی مناسبی در شرایط فیزیولوژیک متفاوت هست.
اندازه شاخص پراکندگی ذرات و پتانسیل زتا
بر اساس نتایج، نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل میانگین سایز 115/4 نانومتر و شارژ سطحی 12/97- میلی ولت داشت و میزان شاخص پراکندگی آن (PDI) 0/119 بود. این نتایج در شکلهای 2و3 (به ترتیب سایز، PDIو شارژ سطحی) قابلمشاهده میباشند.
بررسی شکل ظاهری نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل با استفاده از میکروسکوپ الکترونی روبشی (SEM)
با توجه به تصویر نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل حاصل از میکروسکوپ الکترونی روبشی (شکل 4)، نانو سامانهها وزیکولی و کروی بوده و سطح وزیکولها صاف و هموار هستند. علاوهبراین، این تصویر نشان میدهد نانو سامانههای تولیدشده از نظر اندازه و شکل، توزیع همگنی دارند.
جدول 2: بازده بارگیری دارو (%EE) و رهایش دارو (%R) در فرمولاسیونهای نیوزومی منتخب حاوی داروی پاکلیتاکسل


شکل 1 : رهایش پاکلیتاکسل از نانو سامانه بهینه نیوزومی پگیله (فرمولاسیون F6)

شکل 2: سایز و شاخص پراکندگی (PDI) نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل

شکل 3 : توزیع بار و شارژ سطحی نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل

شکل 4 : تصاویر SEM از نانو سامانه بهینه نیوزومی پگیله حاوی داروی پاکلیتاکسل.
آزمایش سمیت سلولی به روش MTT
نتایج سمیت سلولی حاصل از آزمون MTT نشان داد که هر دو فرم آزاد و نیوزومی داروی پاکلیتاکسل دارای اثر سمیت در رده سلولی سرطان استئوسارکوما (Saos-2) است (IC50=50.66 µg/ml برای فرم آزاد پاکلیتاکسل و IC50=25.99 µg/ml برای فرم نیوزومی) (شکل 5-الف و 5-ب)، که نشاندهنده این موضوع است که فرم نیوزومی داروی پاکلیتاکسل دارای سمیتی در حدود 1/94 برابر بیشتر از فرم آزاد این دارو است. از طرف دیگر، بر اساس نتایج، نانو سامانه بهینه نیوزومی پگیله فاقد دارو، در غلظتهای مورد مطالعه اثر سمیت ناچیزی هم در رده سلولی Saos-2 و HFF از خود نشان میدهند، بهطوریکه IC50 نانو سامانه نیوزومی فاقد دارو در رده سلولی Saos-2 و HFF به ترتیب 1/689 و 1/327 میلیگرم در میلیلیتر تعیین شد و حداکثر غلظتی که از این نانو سامانه در مطالعه حاضر مورد استفاده قرار گرفت، مقدار 100 میکروگرم در میلیلیتر بوده که بیش از 10 برابر کمتر از میزان IC50 آن بوده است (شکل 5-ج و 5-د). علاوهبراین، بررسی آماری نتایج حاصل از MTT نشان داد که نانو سامانه نیوزومی حاوی پاکلیتاکسل، اثر سمیت بیشتری نسبت به فرم آزاد این دارو در تمامی غلظت¬های مورداستفاده، بهجز غلظت 5 میکروگرم در میلیلیتر، داشته است (P>0.01، شکل 6).

شکل 5 : نتایج حاصل از آزمون MTT. الف: اثر سمیت و میزان IC50 پاکلیتاکسل آزاد بر رده سلولی Saos-2، ب: اثر سمیت و میزان IC50 نانو سامانه نیوزومی حاوی پاکلیتاکسل بر رده سلولی Saos-2، ج: اثر سمیت و میزان IC50 نانو سامانه نیوزومی فاقد دارو بر رده سلولی Saos-2 و د: اثر سمیت و میزان IC50 نانو سامانه نیوزومی فاقد دارو در رده سلولی HFF.

شکل 6: نمودار اثر سمیت فرم آزاد داروی پاکلیتاکسل، فرم نیوزومی آن و نانو سامانه نیوزومی فاقد دارو در رده سلولی Saos-2. نتایج حاصل از آزمون ANOVA دوطرفه و مقایسه میانگین Tukey نشان داد که بهجز غلظت 5 میکروگرم در میلیلیتر، در تمامی غلظتهای دیگر، اثر سمیت در فرم-های مختلف تیمار دارای تفاوت معنادار در سطح P>0.01 است (ns=عدم وجود تفاوت معنادار).
بحث
استئوسارکوما، یکی از شایعترین سرطانهای بدخیم استخوان است که بیشتر نوجوانان بین 10 تا 24 سال را تحت تأثیر قرار میدهد (18). در استراتژیهای درمانی، شیمیدرمانی میتواند میزان انتشار این سرطان را بسیار کاهش دهد، با این وجود، ظهور مقاومت چندگانه دارویی در این نوع از سرطان، کارآمدی داروهای شیمیدرمانی را بهطور قابلتوجهی کاهش داده است (6). از طرف دیگر، روشهای دارورسانی مبتنی بر فناوری نانو در دنیای امروز، دروازه جدید و امیدبخشی در حوزه تشخیصی و درمانی به روی ما گشوده است. استفاده از نانو داروها از طریق افزایش دسترسپذیری و جذب دارو، کاهش پاکسازی دارو از جریان خون به دلیل اندازه کوچک و اصلاح سطحی ذرات (پگیلاسیون)، می-تواند کارایی و هدفمندی استفاده از داروهای شیمیدرمانی را بهطور مؤثری افزایش دهد (19). به همین منظور در مطالعه حاضر، جهت دارورسانی داروی پاکلیتاکسل به رده سلولی Saos-2 بهعنوان مدلی از استئوسارکوما، از نانو سامانههای نیوزومی استفاده شد. نیوزومها، به دلیل ویژگیهای منحصربهفردی که دارند، امروزه در استراتژیهای دارورسانی مبتنی بر فناوری نانو بسیار موردتوجه قرارگرفتهاند و مطالعات بسیاری در استفاده از این نانو سامانهها در دارورسانی سرطان تاکنون صورت گرفته است (20–23). در مطالعه حاضر، از فرمولاسیونهای مختلف با نسبت 75:25 کلسترول به سورفکتانت جهت ساخت نانو سامانههای نیوزومی استفاده شد. در همین راستا سورفکتانتهای اسپن40 (فرمول 1)، اسپن60 (فرمول 2)، اسپن80 (فرمول 3)، توئین 80(فرمول4) و توئین60 (فرمول 5) مورد استفاده قرار گرفت. مطالعات نشان دادهاند که اسپنها، گروه سر یکسان و زنجیره آلکیل متفاوت دارند که با افزایش طول زنجیره آلکیل میزان لود افزایش مییابد (24). در مطالعه حاضر نیز، میزان لود فرمولاسیون دو با اسپن 60 (زنجیره آلکیل 18 کربنی) از فرمولاسیون یک با اسپن 40 (زنجیره آلکیل 16 کربنی) بیشتر بوده است. بااینحال اسپن80 با زنجیره آلکیل 18 کربنی، میزان لود کمتری نشان را داد (Span60> Span40> Span80). این امر میتواند به این دلیل باشد که اسپن80 گروه اشباعنشده در ساختار خود دارد (25). در مورد توئین نیز این قاعده صادق است، باوجود اینکه توئین60 و توئین80 هر دو 18 کربن در زنجیره آلکیل خود دارند، فرمولاسیون حاوی توئین80 به دلیل وجود گروه اشباع نشده در ساختار خود لود کمتری را از خود نشان داد Tween60>Tween80)). استفاده از سورفکتانت توئین60 در فرمولاسیونهای استفادهشده در کنار کلسترول موجب ایجاد وزیکولهای پایدار شد که تمایل غشای نانو سامانه را به مولکولهای هیدرووفوب افزایش میدهد. از سوی دیگر فرمولاسیون تهیهشده از توئین 60 در مقایسه با فرمولاسیون تهیهشده از اسپن60 میزان رهایش مطلوبتری را نشان داد که با سایر پژوهش¬ها نیز همراستا است (26). در ادامه با اضافه کردن 5% فسفولیپید پگیله DSPE-mPEG(2000) به فرمول 5، افزایش پایداری و بازده بارگیری مشاهده شد. مطالعات متعدد نشان داده است که پگیلهشدن، پوشاندن و پنهانکردن نیوزومها را از سیستم ایمنی میزبان بهبود بخشیده و فیلتراسیون کلیوی را کاهش میدهد؛ بنابراین نیمهعمر بیشتری در شرایط درونتن (in vivo) بروز میدهد (27). پگیله شدن همچنین PDI نیوزومها را کاهش داده و سبب بهبود پایداری نیوزومها میگردد و از طریق کاهش PDI، تراکم و تجمع نانو سامانه بهصورت توده را کاهش میدهد (28). بهعنوان مثال، هونگ و همکاران در مطالعهای بهمنظور افزایش پایداری سامانه لیپوزومی از فسفولیپیدهای مختلف DPCC، DSPE و EggPC/CH به همراه PEG استفاده کردند که افزایش قابلتوجه پایداری سامانه را در هنگام استفاده از PEGدر سطح نانوذره گزارش کردند (29). از طرف دیگر، اندازه نانوذره، از عوامل بسیار مهم و تأثیرگذار در تجمع دارو در سایت تومور، بازده درمان، تراوشپذیری از رگها و پایداری نانو حاملها است (30) بهطوریکه نتایج حاصل از تحقیقات نشان دادهاند حاملهایی با اندازه کوچکتر، ارائهکننده هدفگیری و تجمع بهتری در سایت عمل بودهاند (31). در مطالعه حاضر، نتایج نشان داد که نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل دارای قطر هیدرودینامیکی با متوسط اندازه 115/4 بوده است که همراستا با مطالعات پیشین است و همچنین اندازه مطلوبی محسوب میشود (17,32,33). Hnog Sook و همکاران در سال 2015 بهمنظور افزایش پایداری سامانه لیپوزومی از فسفولیپیدهای مختلف DPCC،DSPE و EggPC/CH به همراه PEG استفاده کردند که افزایش قابلتوجه پایداری سامانه را در هنگام استفاده از PEGدر سطح نانوذره مشاهده کردند (29). در مطالعهای که توسط Bayindir و همکاران انجام شد، الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی بررسی شد. در این مطالعه مشخص شد الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی حاوی توئین ۶۰ و کلسترول موجب رهایش ابتدایی سریع دارو در فاز اول خواهد شد. با این وجود رهایش دارو در فاز دوم، آهستهتر دنبال میشود (16). در مطالعهای که توسط Manosroi و همکارانش انجام شد اثر وجود کلسترول را در فرمولاسیون نیوزومی حاوی تویین 60 بررسی کردند. نتایج نشان داد که کارایی بارگذاری دارو تحت تاثیر طول زنجیره آلکیل سورفکتانت غیر یونی و مقدار کلسترول به کار برده شده در تهیه وزیکولها بستگی دارد. مشخص شد که تویین 60 بدون حضور کلسترول امکان تشکیل نیوزوم را ندارد و با اضافه کردن کلسترول، نیوزوم با حداکثر بارگذاری دارو تشکیل میشود. بهعلاوه مشخص شد که سورفکتانت غیر یونی با زنجیره آلکیل 18 کربنِ مانند تویین 60 کارایی بارگذاری بالاتری نسبت به سورفکتانت غیر یونی با زنجیره آلکیل 12 کربنِ مانند تویین 20 دارد (34). بهطور خلاصه در مطالعه حاضر فرمولاسیون بهینه نیوزومی پگیله (فرمول6) حاوی توئین60 و کلسترول و فسفولیپید پگیله DSPE-mPEG(2000) با نسبت (75:25:5) از چند جهت دارای ویژگی¬های مطلوبی بود، ازجمله: قطر کوچک، رهایش کنترلشده دارو و بازده درونگیری بالا (جدول3). این نتایج با مطالعه که توسط بایندیر و همکاران انجام شد مطابقت دارد، در آن مطالعه الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی بررسی و مشخص شد الگوی رهایش پاکلیتاکسل از فرمولاسیون نیوزومی حاوی توئین۶۰ و کلسترول موجب رهایش ابتدایی سریع دارو در فاز اول خواهد شد، بااینوجود رهایش دارو در فاز دوم، آهستهتر دنبال میشود (16). علاوه بر آنچه ذکر گردید، نتایج آزمون MTT نشان داد که نانو سامانه بهینه نیوزومی پگیله حاوی پاکلی¬تاکسل بهطور قابلتوجهی در افزایش سمیت داروی پاکلیتاکسل در عین کاهش غلظت داروی استفادهشده، مؤثر عمل کرده است بهطوریکه IC50 نانو سامانه حاوی دارو در حدود 1/94 برابر بیشتر از مقدار IC50 دارو بود، درحالیکه نانو سامانه فاقد دارو سمیت قابلتوجهی چه در رده سلولی سرطانی Saos-2 و چه در رده سلولی نرمال HFF نداشت. این موضوع در کنار کاهش نسبت لیپید به دارو (L/D) بهکاررفته در فرمولاسیونهای نیوزومی که تنها 10% بوده است، نشان میدهد میزان داروی مورداستفاده نسبت به مطالعات پیشین کاهش پیدا کرده است (35–37). بهعبارتدیگر، با استناد به نتایج حاصل از تستهای سلولی میتوان ادعا نمود این پژوهش توانسته دوز مؤثر دارو را کم و درعینحال، خواص دارویی و درمانی آن را حفظ نماید.
جدول 3: مشخصات کلی نانو سامانه بهینه نیوزومی پگیله حاوی پاکلیتاکسل

نتیجهگیری
استفاده از نانو حاملهای دارویی بهعنوان رویکردی مؤثر برای تحویل هوشمند دارو در سالهای اخیر بسیار موردتوجه بوده است. طی این سالها استفاده از نانو حاملهایی که دارورسانی را بهصورت غیر هدفمند و یا هدفمند به سلولهای سرطانی تحویل نماید، با موفقیتهای چشمگیری همراه بوده است. استفاده از سیستمهای دارورسانی بر پایه سورفکتانتها همچون نیوزوم به دلیل شباهت ساختاری با غشای سلول و بدن انسان، موانع عبور از رگهای خونی و بافتهای متعدد را پشت سر میگذارد. همچنین تحویل داروهای شیمیایی مانند پاکلیتاکسل درون یک فضای محصورشده و کروی در مقیاس نانو عوارض سیتوتوکسیتی آن را برای سلولهای سالم تا حد زیادی کاهش میدهد. در این مطالعه، نانو سامانه نیوزومی طراحی و ساخته شد که علاوه برداشتن اندازه کوچک و قطر هیدرودینامیکی مناسب، مورفولوژی کروی و پایداری شیمیایی و شاخص پراکندگی مناسب، قادر به بارگیری و رهایش داروی پاکلیتاکسل با کارایی بالا بودند. علاوه بر این، نانو سامانه نیوزومی طراحی و ساختهشده با موفقیت توانست داروی موردنظر را بهصورت مؤثر به سلولهای سرطانی تحویل دهد و علیرغم میزان کمتر دارو در مقایسه با داروی آزاد، در این سلولها توانست سمیت بیشتری ایجاد نماید. همچنین اصلاح سطحی نانو حامل با پلیاتیلن گلیکول علاوه بر ایجاد پایداری نانو سامانه و کاهش شاخص پراکندگی آن در مطالعه حاضر، میتواند در مطالعات درونتنی نیز بهعنوان یک عامل برتری دهنده نسبت به داروی آزاد مورد بررسی و مطالعه قرار گیرد. بنابراین با توجه به اینکه نانو سامانه حاضر در شرایط حاکم بر سلولهای سرطانی بهصورت نیمه هدفمند عمل نموده، میتوان چنین پیشنهاد نمود سامانه مذکور قابلیت این را دارد تا در مطالعات برونتنی در مدلهای آزمایشگاهی، بهعنوان یک کاندید درمانی امیدبخش مورد مطالعه قرار گیرد.
سپاسگزاری
این مقاله حاصل بخشی از پایاننامه آقای محمدجواد پورمحمودیان دانشجو کارشناسی ارشد زیستفناوری پزشکی از دانشکده پزشکی دانشگاه علوم پزشکی شهید صدوقی یزد هست که در مرکز تحقیقات زیستفناوری پردیس بینالملل دانشگاه علوم پزشکی شهید صدوقی یزد انجام گرفت. صمیمانه از اساتید و مسئولین محترم این مرکز در خصوص تسهیل بهرهمندی از فضای آزمایشگاهی و دستگاهی تشکر میگردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Grimer R, Athanasou N, Gerrand C, Judson I, Lewis I, Morland B, et al. UK Guidelines for the Management of Bone Sarcomas. Sarcoma 2010; 2010.
2- Ottaviani G, Jaffe N. The Epidemiology of Osteosarcoma. Pediatr Adolesc Osteosarcoma 2009; 3-13.
3- Weber K, Damron TA, Frassica FJ, Sim FH. Malignant Bone Tumors. Instr Course Lect 2008; 57: 673-88.
4- Lin PP, Patel S. Osteosarcoma. In: Bone Sarcoma. Springer 2013; 75-97.
5- Zhang Y, Yang J, Zhao N, Wang C, Kamar S, Zhou Y, et al. Progress in the Chemotherapeutic Treatment of Osteosarcoma. Oncol Lett 2018; 16(5): 6228-37.
6- Li S, Sun W, Wang H, Zuo D, Hua Y, Cai Z. Research Progress on the Multidrug Resistance Mechanisms Of Osteosarcoma Chemotherapy And Reversal. Tumor Biol 2015; 36(3): 1329-38.
7- Majidinia M, Mirza‐Aghazadeh‐Attari M, Rahimi M, Mihanfar A, Karimian A, Safa A, et al. Overcoming Multidrug Resistance in Cancer: Recent Progress in Nanotechnology and New Horizons. IUBMB Life 2020; 72(5): 855-71.
8- Chen S, Hanning S, Falconer J, Locke M, Wen J. Recent Advances in Non-Ionic Surfactant Vesicles (Niosomes): Fabrication, Characterization, Pharmaceutical and Cosmetic Applications. Eur J Pharm Biopharm 2019; 144: 18-39.
9- Mohammadi M, Haghirosadat BF, Ehsani R, Yazdian F, Rashedi H, Jahanizadeh S, et al. Synthesis, Characterization and Evaluation of Liponiosome Containing Ginger Extract as a New Strategy for Potent Antifungal Formulation. J Clust Sci 2020; 31(5): 971-81.
10- Kazi KM, Mandal AS, Biswas N, Guha A, Chatterjee S, Behera M, et al. Niosome: A Future of Targeted Drug Delivery Systems. J Adv Pharm Technol Res 2010; 1(4): 374.
11- Weaver BA. How Taxol/Paclitaxel Kills Cancer Cells. Mol Biol Cell 2014; 25(18): 2677-81.
12- Liggins RT, Burt HM. Polyether–Polyester Diblock Copolymers for the Preparation of Paclitaxel Loaded Polymeric Micelle Formulations. Adv Drug Deliv Rev 2002; 54(2): 191-202.
13- Horwitz SB. Taxol (Paclitaxel): Mechanisms of Action. Ann Oncol Off J Eur Soc Med Oncol 1994; 5: S3-6.
14- Wang T, Wang H, Soong Y. Paclitaxel Induced Cell Death: Where the Cell Cycle and Apoptosis Come Together. Cancer Interdiscip Int J am Cancer Soc 2000; 88(11): 2619-28.
15- Alemi A, Zavar Reza J, Haghiralsadat F, Zarei Jaliani H, Haghi Karamallah M, Hosseini SA, et al. Paclitaxel and Curcumin Coadministration in Novel Cationic Pegylated Niosomal Formulations Exhibit Enhanced Synergistic Antitumor Efficacy. J Nanobiotechnology 2018; 16(1): 1-20.
16- Sezgin Bayindir Z, Beşikci A, Yüksel N. Paclitaxel-Loaded Niosomes for Intravenous Administration: Pharmacokinetics and Tissue Distribution in Rats. Turkish J Med Sci 2015; 45(6): 1403-12.
17- Alemi A, Reza JZ, Haghiralsadat F, Jaliani HZ, Karamallah MH, Hosseini SA, et al. Paclitaxel and Curcumin Coadministration in Novel Cationic Pegylated Niosomal Formulations Exhibit Enhanced Synergistic Antitumor Efficacy. J Nanobiotechnology 2018; 16(1): 1-20.
18- Yuan Y, Song J-X, Zhang M-N, Yuan B-S. A Multiple Drug Loaded, Functionalized Ph-Sensitive Nanocarrier as Therapeutic and Epigenetic Modulator for Osteosarcoma. Sci Rep 2020; 10(1): 1-11.
19- Bu H, Gao Y, Li Y. Overcoming Multidrug Resistance (MDR) in Cancer by Nanotechnology. Sci China Chem 2010; 53(11): 2226-32.
20- Shaker DS, Shaker MA, Hanafy MS. Cellular Uptake, Cytotoxicity and In-Vivo Evaluation of Tamoxifen Citrate Loaded Niosomes. Int J Pharm 2015; 493(1–2): 285-94.
21- Xu Y-Q, Chen W-R, Tsosie JK, Xie X, Li P, Wan J-B, et al. Niosome Encapsulation of Curcumin: Characterization and Cytotoxic Effect on Ovarian Cancer Cells. J Nanomater 2016; 2016.
22- Uchegbu IF, Double JA, Kelland LR, Turton JA, Florence AT. The Activity of Doxorubicin Niosomes Against an Ovarian Cancer Cell Line and Three in Vivo Mouse Tumour Models. J Drug Target 1996; 3(5): 399-409.
23- Sharma V, Anandhakumar S, Sasidharan M. Self-Degrading Niosomes for Encapsulation of Hydrophilic and Hydrophobic Drugs: An Efficient Carrier for Cancer Multi-Drug Delivery. Mater Sci Eng C 2015; 56: 393-400.
24- Yoshioka T, Sternberg B, Florence AT. Preparation and Properties of Vesicles (Niosomes) of Sorbitan Monoesters (Span 20, 40, 60 and 80) and a Sorbitan Triester (Span 85). Int J Pharm 1994; 105(1): 1-6.
25- Roque L, Fernández M, Benito JM, Escudero I. Stability And Characterization Studies of Span 80 Niosomes Modified with CTAB in the Presence of Nacl. Colloids Surfaces A Physicochem Eng Asp 2020; 601: 124999.
26- Akbari V, Abedi D, Pardakhty A, Sadeghi-Aliabadi H. Release Studies on Ciprofloxacin Loaded Non-Ionic Surfactant Vesicles. Avicenna J Med Biotechnol 2015; 7(2): 69.
27- Garbuzenko O, Barenholz Y, Priev A. Effect of Grafted PEG on Liposome Size and on Compressibility and Packing of Lipid Bilayer. Chem Phys Lipids 2005; 135(2):117-29.
28- Mohamed M, Abu Lila AS, Shimizu T, Alaaeldin E, Hussein A, Sarhan HA, et al. Pegylated Liposomes: Immunological Responses. Sci Technol Adv Mater 2019; 20(1): 710-24.
29- Hong M-S, Lim S-J, Lee M-K, Kim YB, Kim C-K. Prolonged Blood Circulation of Methotrexate by Modulation of Liposomal Composition. Drug Deliv 2001; 8(4): 231-7.
30- YANG L, HU R. The Size of Liposomes: A Factor which Affects their Targeting Efficiency to Tumors [J]. Foreign Med Sci (Section Pharmacy) 2007; 3.
31- Danaei M, Dehghankhold M, Ataei S, Hasanzadeh Davarani F, Javanmard R, Dokhani A, et al. Impact of Particle Size and Polydispersity Index on the Clinical Applications of Lipidic Nanocarrier Systems. Pharmaceutics 2018; 10(2): 1-17.
32- Haghiralsadat F, Amoabediny G, Naderinezhad S, Forouzanfar T, Helder MN, Zandieh-Doulabi B. Preparation of Pegylated Cationic Nanoliposome-Sirna Complexes for Cancer Therapy. Artif Cells, Nanomedicine, Biotechnol 2018; 46(Sup1): 684-92.
33- Hemati M, Haghiralsadat F, Jafary F, Moosavizadeh S, Moradi A. Targeting Cell Cycle Protein in Gastric Cancer with CDC20siRNA and Anticancer Drugs (Doxorubicin and Quercetin) Co-Loaded Cationic Pegylated Nanoniosomes. Int J Nanomedicine 2019; 14: 6575.
34- Manosroi A, Wongtrakul P, Manosroi J, Sakai H, Sugawara F, Yuasa M, et al. Characterization of Vesicles Prepared with Various Non-Ionic Surfactants Mixed with Cholesterol. Colloids Surfaces B Biointerfaces. 2003; 30(1-2): 129-38.
35- Aboeepoor S, Dehghani Ashkezari M, Aboee-Mehrizi F, Haghiralsadat BF, Nikoonahad Lotfabadi N. Designing and Characterizing Nano-Carriers Containing Nepeta Persica Extract and their Effect on Bone Cancer. Horiz Med Sci 2020; 26(2): 142-55.
36- Haghiralsadat BF, Naderinezhad S, Amoabediny G, Montazeri F, Zandieh Doulabi B. Evaluation of the Effects of Surface Charge on Cytotoxicity of Liposomal Doxorubicin on Bone Cancer Cell Line (Osteosarcoma). Daneshvar Med Basic Clin Res J 2020; 25(6): 19-26.
37- Alsadat BFH, Amirpour Z, Nafisi B. Development of Slow Release Berberine-Containing Nanoliposome for Delivery to Bone Cancer Cells Saos2. Iran J Pediatr Hematol Oncol 2020.
2- Ottaviani G, Jaffe N. The Epidemiology of Osteosarcoma. Pediatr Adolesc Osteosarcoma 2009; 3-13.
3- Weber K, Damron TA, Frassica FJ, Sim FH. Malignant Bone Tumors. Instr Course Lect 2008; 57: 673-88.
4- Lin PP, Patel S. Osteosarcoma. In: Bone Sarcoma. Springer 2013; 75-97.
5- Zhang Y, Yang J, Zhao N, Wang C, Kamar S, Zhou Y, et al. Progress in the Chemotherapeutic Treatment of Osteosarcoma. Oncol Lett 2018; 16(5): 6228-37.
6- Li S, Sun W, Wang H, Zuo D, Hua Y, Cai Z. Research Progress on the Multidrug Resistance Mechanisms Of Osteosarcoma Chemotherapy And Reversal. Tumor Biol 2015; 36(3): 1329-38.
7- Majidinia M, Mirza‐Aghazadeh‐Attari M, Rahimi M, Mihanfar A, Karimian A, Safa A, et al. Overcoming Multidrug Resistance in Cancer: Recent Progress in Nanotechnology and New Horizons. IUBMB Life 2020; 72(5): 855-71.
8- Chen S, Hanning S, Falconer J, Locke M, Wen J. Recent Advances in Non-Ionic Surfactant Vesicles (Niosomes): Fabrication, Characterization, Pharmaceutical and Cosmetic Applications. Eur J Pharm Biopharm 2019; 144: 18-39.
9- Mohammadi M, Haghirosadat BF, Ehsani R, Yazdian F, Rashedi H, Jahanizadeh S, et al. Synthesis, Characterization and Evaluation of Liponiosome Containing Ginger Extract as a New Strategy for Potent Antifungal Formulation. J Clust Sci 2020; 31(5): 971-81.
10- Kazi KM, Mandal AS, Biswas N, Guha A, Chatterjee S, Behera M, et al. Niosome: A Future of Targeted Drug Delivery Systems. J Adv Pharm Technol Res 2010; 1(4): 374.
11- Weaver BA. How Taxol/Paclitaxel Kills Cancer Cells. Mol Biol Cell 2014; 25(18): 2677-81.
12- Liggins RT, Burt HM. Polyether–Polyester Diblock Copolymers for the Preparation of Paclitaxel Loaded Polymeric Micelle Formulations. Adv Drug Deliv Rev 2002; 54(2): 191-202.
13- Horwitz SB. Taxol (Paclitaxel): Mechanisms of Action. Ann Oncol Off J Eur Soc Med Oncol 1994; 5: S3-6.
14- Wang T, Wang H, Soong Y. Paclitaxel Induced Cell Death: Where the Cell Cycle and Apoptosis Come Together. Cancer Interdiscip Int J am Cancer Soc 2000; 88(11): 2619-28.
15- Alemi A, Zavar Reza J, Haghiralsadat F, Zarei Jaliani H, Haghi Karamallah M, Hosseini SA, et al. Paclitaxel and Curcumin Coadministration in Novel Cationic Pegylated Niosomal Formulations Exhibit Enhanced Synergistic Antitumor Efficacy. J Nanobiotechnology 2018; 16(1): 1-20.
16- Sezgin Bayindir Z, Beşikci A, Yüksel N. Paclitaxel-Loaded Niosomes for Intravenous Administration: Pharmacokinetics and Tissue Distribution in Rats. Turkish J Med Sci 2015; 45(6): 1403-12.
17- Alemi A, Reza JZ, Haghiralsadat F, Jaliani HZ, Karamallah MH, Hosseini SA, et al. Paclitaxel and Curcumin Coadministration in Novel Cationic Pegylated Niosomal Formulations Exhibit Enhanced Synergistic Antitumor Efficacy. J Nanobiotechnology 2018; 16(1): 1-20.
18- Yuan Y, Song J-X, Zhang M-N, Yuan B-S. A Multiple Drug Loaded, Functionalized Ph-Sensitive Nanocarrier as Therapeutic and Epigenetic Modulator for Osteosarcoma. Sci Rep 2020; 10(1): 1-11.
19- Bu H, Gao Y, Li Y. Overcoming Multidrug Resistance (MDR) in Cancer by Nanotechnology. Sci China Chem 2010; 53(11): 2226-32.
20- Shaker DS, Shaker MA, Hanafy MS. Cellular Uptake, Cytotoxicity and In-Vivo Evaluation of Tamoxifen Citrate Loaded Niosomes. Int J Pharm 2015; 493(1–2): 285-94.
21- Xu Y-Q, Chen W-R, Tsosie JK, Xie X, Li P, Wan J-B, et al. Niosome Encapsulation of Curcumin: Characterization and Cytotoxic Effect on Ovarian Cancer Cells. J Nanomater 2016; 2016.
22- Uchegbu IF, Double JA, Kelland LR, Turton JA, Florence AT. The Activity of Doxorubicin Niosomes Against an Ovarian Cancer Cell Line and Three in Vivo Mouse Tumour Models. J Drug Target 1996; 3(5): 399-409.
23- Sharma V, Anandhakumar S, Sasidharan M. Self-Degrading Niosomes for Encapsulation of Hydrophilic and Hydrophobic Drugs: An Efficient Carrier for Cancer Multi-Drug Delivery. Mater Sci Eng C 2015; 56: 393-400.
24- Yoshioka T, Sternberg B, Florence AT. Preparation and Properties of Vesicles (Niosomes) of Sorbitan Monoesters (Span 20, 40, 60 and 80) and a Sorbitan Triester (Span 85). Int J Pharm 1994; 105(1): 1-6.
25- Roque L, Fernández M, Benito JM, Escudero I. Stability And Characterization Studies of Span 80 Niosomes Modified with CTAB in the Presence of Nacl. Colloids Surfaces A Physicochem Eng Asp 2020; 601: 124999.
26- Akbari V, Abedi D, Pardakhty A, Sadeghi-Aliabadi H. Release Studies on Ciprofloxacin Loaded Non-Ionic Surfactant Vesicles. Avicenna J Med Biotechnol 2015; 7(2): 69.
27- Garbuzenko O, Barenholz Y, Priev A. Effect of Grafted PEG on Liposome Size and on Compressibility and Packing of Lipid Bilayer. Chem Phys Lipids 2005; 135(2):117-29.
28- Mohamed M, Abu Lila AS, Shimizu T, Alaaeldin E, Hussein A, Sarhan HA, et al. Pegylated Liposomes: Immunological Responses. Sci Technol Adv Mater 2019; 20(1): 710-24.
29- Hong M-S, Lim S-J, Lee M-K, Kim YB, Kim C-K. Prolonged Blood Circulation of Methotrexate by Modulation of Liposomal Composition. Drug Deliv 2001; 8(4): 231-7.
30- YANG L, HU R. The Size of Liposomes: A Factor which Affects their Targeting Efficiency to Tumors [J]. Foreign Med Sci (Section Pharmacy) 2007; 3.
31- Danaei M, Dehghankhold M, Ataei S, Hasanzadeh Davarani F, Javanmard R, Dokhani A, et al. Impact of Particle Size and Polydispersity Index on the Clinical Applications of Lipidic Nanocarrier Systems. Pharmaceutics 2018; 10(2): 1-17.
32- Haghiralsadat F, Amoabediny G, Naderinezhad S, Forouzanfar T, Helder MN, Zandieh-Doulabi B. Preparation of Pegylated Cationic Nanoliposome-Sirna Complexes for Cancer Therapy. Artif Cells, Nanomedicine, Biotechnol 2018; 46(Sup1): 684-92.
33- Hemati M, Haghiralsadat F, Jafary F, Moosavizadeh S, Moradi A. Targeting Cell Cycle Protein in Gastric Cancer with CDC20siRNA and Anticancer Drugs (Doxorubicin and Quercetin) Co-Loaded Cationic Pegylated Nanoniosomes. Int J Nanomedicine 2019; 14: 6575.
34- Manosroi A, Wongtrakul P, Manosroi J, Sakai H, Sugawara F, Yuasa M, et al. Characterization of Vesicles Prepared with Various Non-Ionic Surfactants Mixed with Cholesterol. Colloids Surfaces B Biointerfaces. 2003; 30(1-2): 129-38.
35- Aboeepoor S, Dehghani Ashkezari M, Aboee-Mehrizi F, Haghiralsadat BF, Nikoonahad Lotfabadi N. Designing and Characterizing Nano-Carriers Containing Nepeta Persica Extract and their Effect on Bone Cancer. Horiz Med Sci 2020; 26(2): 142-55.
36- Haghiralsadat BF, Naderinezhad S, Amoabediny G, Montazeri F, Zandieh Doulabi B. Evaluation of the Effects of Surface Charge on Cytotoxicity of Liposomal Doxorubicin on Bone Cancer Cell Line (Osteosarcoma). Daneshvar Med Basic Clin Res J 2020; 25(6): 19-26.
37- Alsadat BFH, Amirpour Z, Nafisi B. Development of Slow Release Berberine-Containing Nanoliposome for Delivery to Bone Cancer Cells Saos2. Iran J Pediatr Hematol Oncol 2020.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







